Teknesium heksafluorida
Teknesium heksafluorida atau teknesium(VI) fluorida (TcF6) adalah sebuah senyawa anorganik berwarna kuning keemasan dengan titik lebur rendah. Senyawa ini pertama kali diidentifikasi pada tahun 1961.[3] Dalam senyawa ini, teknesium memiliki bilangan oksidasi +6, bilangan oksidasi tertinggi yang ditemukan dalam halida teknesium. Dalam hal ini, teknesium memiliki perbedaan dari renium, yang membentuk sebuah heptafluorida, ReF7.[4] Teknesium heksafluorida terdapat sebagai pengotor dalam uranium heksafluorida, karena teknesium merupakan produk fisi uranium (fisi spontan dalam uranium alami, kemungkinan kontaminasi dari fisi yang diinduksi di dalam reaktor dalam uranium yang diproses ulang). Titik didih heksafluorida uranium dan teknesium yang sangat dekat satu sama lain ini menimbulkan masalah dalam penggunaan volatilitas fluorida dalam pemrosesan ulang nuklir. PembuatanTeknesium heksafluorida dibuat dengan memanaskan logam teknesium dengan F2 berlebih pada suhu 400 °C.[3]
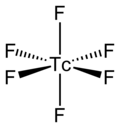
DeskripsiTeknesium heksafluorida adalah padatan berwarna kuning keemasan pada suhu kamar. Titik leburnya adalah 37,4 °C dan titik didihnya adalah 55,3 °C.[1] Teknesium heksafluorida mengalami transisi fase padat pada suhu −4,54 °C. Di atas suhu ini (yang diukur pada suhu 10 °C), struktur padatnya berbentuk kubik. Parameter kisinya adalah a = 6,16 Å. Terdapat dua unit formula (dalam hal ini, molekul diskret) per sel unit, yang menghasilkan massa jenis 3,02 g·cm−3. Di bawah suhu ini (yang diukur pada suhu −19 °C), struktur padatnya berbentuk ortorombik dengan grup ruang Pnma. Parameter kisinya adalah a = 9,55 Å, b = 8,74 Å, dan c = 5,02 Å. Terdapat empat unit formula (dalam hal ini, molekul diskret) per sel unit, yang menghasilkan massa jenis 3,38 g·cm−3. Pada suhu −140 °C, struktur padatnya masih berbentuk ortorombik, tetapi parameter kisinya sekarang adalah a = 9,360 Å, b = 8,517 Å, dan c = 4,934 Å, yang menghasilkan massa jenis 3,58 g·cm−3.[2] Molekul TcF6 sendiri (bentuk yang penting untuk fase cair atau gas) memiliki geometri molekul oktahedral, yang memiliki grup titik (Oh). Panjang ikatan Tc–F adalah 1,812 Å.[2] Momen magnetiknya telah diukur sebesar 0,45 μB.[5] SifatFisikTcF6 berbentuk oktahedral, seperti yang ditunjukkan melalui spektrum inframerah dan Raman.[6][7] Bentuk ortorombiknya pada suhu rendah berubah menjadi bentuk kubik berpusat-badan dengan simetri yang lebih tinggi pada suhu kamar, seperti heksafluorida logam lainnya seperti RhF6 dan OsF6.[8] Pengukuran awal momen magnetiknya menghasilkan nilai 0,45 μB, yang lebih rendah dari yang diperkirakan untuk sebuah senyawa oktahedral d1.[9] KimiaTcF6 bereaksi dengan klorida alkali dalam larutan iodin pentafluorida (IF5) untuk membentuk heksafluoroteknetat.[10][11] TcF6 mengalami disproporsionasi pada hidrolisis dengan NaOH untuk membentuk endapan hitam TcO2.[3] Dalam larutan hidrogen fluorida, TcF6 bereaksi dengan hidrazinium fluorida untuk menghasilkan N2H6TcF6 atau N2H6(TcF6)2.[12] Referensi
|
||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia