塩化セシウム
識別情報
ChemSpider
ECHA InfoCard 100.028.728
EC番号
UNII
InChI=1S/ClH.Cs/h1H;/q;+1/p-1
Key: AIYUHDOJVYHVIT-UHFFFAOYSA-M
InChI=1/ClH.Cs/h1H;/q;+1/p-1
Key: AIYUHDOJVYHWHXWOFAO
特性
化学式
CsCl
モル質量
168.36 g/mol
外観
白色の固体吸湿性
密度
3.988 g/cm3 [ 2]
融点
646 °C , 919 K, 1195 °F [ 2]
沸点
1297 °C , 1570 K, 2367 °F [ 2]
水 への溶解度
1910 g/L (25 °C)[ 2]
溶解度
エタノールに溶ける[ 2]
バンドギャップ
8.35 eV (80 K)[ 1]
磁化率
−56.7·10−6 cm3 /mol[ 4]
屈折率 (n D )
1.712 (0.3 μm)[ 3]
構造
CsCl, cP2
Pm3 m, No. 221[ 5]
a = 0.4119 nm
0.0699 nm3
1
Cubic (Cs+ )− )
危険性
GHS 表示
Warning
H302 , H341 , H361 , H373
P201 , P202 , P260 , P264 , P270 , P281 , P301+P312 , P308+P313 , P314 , P330 , P405 , P501
致死量または濃度 (LD, LC)
2600 mg/kg (経口, ラット)[ 6]
関連する物質
その他の陰イオン
フッ化セシウム 臭化セシウム ヨウ化セシウム
その他の陽イオン
塩化リチウム 塩化ナトリウム 塩化カリウム 塩化ルビジウム 塩化フランシウム
特記なき場合、データは常温 (25 °C )・常圧 (100 kPa) におけるものである。
塩化セシウム (えんかセシウム、cesium chloride)は化学式 CsCl で表される無機化合物 である。無色の固体であり、セシウム イオン源としてさまざまな用途に使われる。結晶構造型 のひとつとしても知られる。
水酸化セシウム または炭酸セシウム と塩酸 の反応によって調製される。得られる塩は再結晶 して精製される。
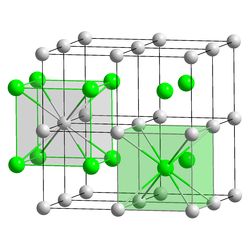
塩化セシウムの単位格子 固体はイオン結晶であり、アニオン(塩化物イオン、Cl− )とカチオン(セシウムイオン、Cs+ )の組み合わせからなる単純立方格子 である。1:1の組成比を持つ塩の結晶において、2種のイオンの半径がほぼ等しい(フィールドホッケー の球とテニス ボール程度のような)場合には塩化セシウム型の構造をとる。塩化セシウムの場合では、各塩化物イオンは8個のセシウムイオンと隣接する。塩化セシウム型構造をとる化合物として臭化セシウム 、ヨウ化セシウム 、また銅 ・亜鉛 や鉄 ・ロジウム の1:1合金などが知られる。一方、イオン半径が大きく異なる(バスケットボール とゴルフ ボールのような)場合には、バスケットボールの隙間にゴルフボールが挟まったような構造、すなわち塩化ナトリウム 型構造をとる。塩化ナトリウムの結晶中では、各塩化物イオンは6個のナトリウムイオンと隣接する。
導電性ガラス の製造に用いられる。
塩化セシウムはまた、DNA の遠心分離 を行う際に広く用いられる。等密度遠心法 (isopycnic centrifugation) と呼ばれる技法では、塩化セシウムの溶液を遠心分離し、遠心力と分散力によって遠心管中に濃度勾配(すなわち密度勾配)を作り出す。この溶液を使ってDNAを遠心分離すると、DNAの各断片は溶液中で密度の等しい部分にそれぞれ移動する。この現象を利用し、密度の異なるDNAを分離することができる。
非放射性の塩化セシウムはがんの代替医療に利用できると主張されているが、科学的根拠で裏付けられたものではない。カナダ保険省によれば、継続したセシウム化合物(主に塩化セシウム)の使用は命にかかわる心臓病のリスクをもたらす可能性がある[ 7]
放射性同位体 を含む塩化セシウムはがん治療におけるシンチグラフィ に使われる。放射線源の製造においては、普通、事故が起こった場合に備えて分散しにくい化学種が選択される。例えば原子力電池 には水に不溶なチタン酸ストロンチウム が使われる。しかしながら、体外放射線療法 (external beam radiotherapy, teletherapy) 用の線源には高い放射能 濃度が要求されるため、不溶性のセシウム化合物ではこれを調製することができない。放射性塩化セシウムは通常、指ぬき型の缶に入れて放射線治療用の線源として利用される。ブラジルにおいて、このような放射線源が廃病院から盗み出され、これを破砕することによってガンマ線被曝が発生する事件が起こった。
^ Lushchik, A; Feldbach, E; Frorip, A; Ibragimov, K; Kuusmann, I; Lushchik, C (1994). “Relaxation of excitons in wide-gap CsCl crystals”. Journal of Physics: Condensed Matter 6 (12): 2357–2366. Bibcode : 1994JPCM....6.2357L . doi :10.1088/0953-8984/6/12/009 . ^ a b c d e Haynes, p. 4.57
^ Haynes, p. 10.240
^ Haynes, p. 4.132
^ Watanabe, M.; Tokonami, M.; Morimoto, N. (1977). “The transition mechanism between the CsCl-type and NaCl-type structures in CsCl”. Acta Crystallographica Section A 33 (2): 294. Bibcode : 1977AcCrA..33..294W . doi :10.1107/S0567739477000722 . ^ Cesium chloride . nlm.nih.gov^ Health Canada Warns Canadians of Cardiac Risks Associated with Cesium ChlorideWarning 2009-153 /September 10, 2009 For immediate release / [1]