ТхЂтІЋсЃбсѓХсѓцсѓ»сЃбсЃЄсЃФ ТхЂтІЋсЃбсѓХсѓцсѓ»сЃбсЃЄсЃФ№╝ѕсѓісѓЁсЂєсЂЕсЂєсЃбсѓХсѓцсѓ»сЃбсЃЄсЃФсђЂУІ▒: fluid mosaic model№╝ЅсЂ»сђЂТЕЪУЃйуџёсЂфу┤░УЃъУєюсЂ«ТДІжђасЂФжќбсЂЎсѓІсЂЋсЂЙсЂќсЂЙсЂфуЪЦУдІсѓњУфгТўјсЂЎсѓІсЃбсЃЄсЃФсЂДсЂѓсѓІсђѓсЂЊсЂ«сЃбсЃЄсЃФсЂФсѓѕсѓІсЂесђЂу┤░УЃъУєюсЂ»сѓ┐сЃ│сЃЉсѓ»У│фтѕєтГљсЂїтЪІсѓЂУЙ╝сЂЙсѓїсЂЪУёѓУ│фС║їжЄЇт▒цсЂДсЂѓсѓІсђѓУёѓУ│фС║їжЄЇт▒цсЂ»УєюсЂИТхЂтІЋТђДсЂет╝ЙТђДсѓњСИјсЂѕсѓІсђѓсЂЊсЂ«сЃбсЃЄсЃФсЂ»1972т╣┤сЂФсѓисЃ╝сЃбсѓбсЃ╗сѓИсЃДсЃісѓхсЃ│сЃ╗сѓисЃ│сѓгсЃ╝сЂесѓгсЃ╝сѓ╣сЃ╗LсЃ╗сЃІсѓ│сЃФсѓйсЃ│сЂФсѓѕсЂБсЂдУђЃТАѕсЂЋсѓїсЂЪсѓѓсЂ«сЂДсђЂу┤░УЃъУєюсЂ»сЃфсЃ│УёѓУ│фсЂесѓ┐сЃ│сЃЉсѓ»У│фтѕєтГљсЂїт«╣ТўЊсЂФТІАТЋБсЂЎсѓІС║їТгАтЁЃТХ▓СйЊсЂДсЂѓсѓІсЂеУфгТўјсЂЋсѓїсѓІ[1]сђѓУєюсЂ«ТДІТѕљУдЂу┤асЂ«ТефТќ╣тљЉсЂИсЂ«ТІАТЋБсѓњтѕХжЎљсЂЎсѓІУєюсЃЅсЃАсѓцсЃ│сЂ«жЄЇУдЂТђДсЂїТќ░сЂЪсЂФуЎ║УдІсЂЋсѓїсђЂсЂЊсѓїсѓЅсЂ«уЪЦУдІсѓњУфгТўјсЂЎсѓІсЂЪсѓЂсЂФсЃбсЃЄсЃФсЂ»ТЏ┤Тќ░сЂЋсѓїсЂдсЂёсѓІсђѓсЂЊсЂ«сѓѕсЂєсЂфУєюсЃЅсЃАсѓцсЃ│сЂ»сђЂУёѓУ│фсЃЕсЃЋсЃѕсђЂсЂЙсЂЪсЂ»сѓ┐сЃ│сЃЉсѓ»У│фсѓёу│ќсѓ┐сЃ│сЃЉсѓ»У│фсЂ«УцЄтљѕСйЊсЂ«тйбТѕљсѓњС┐Ѓжђ▓сЂЎсѓІуЅ╣тѕЦсЂфУёѓУ│фсѓёсѓ┐сЃ│сЃЉсѓ»У│фсЂ«ухёТѕљсѓњТїЂсЂцжаўтЪЪсЂесЂЌсЂдт«џуЙЕсЂЋсѓїсѓІсђѓУєюсЃЅсЃАсѓцсЃ│сЂ»сђЂу┤░УЃъжфеТа╝у╣іуХГсѓёу┤░УЃътцќсЃъсЃѕсЃфсЃЃсѓ»сѓ╣сЂесЂ«Уєюсѓ┐сЃ│сЃЉсѓ»У│фсѓњС╗ІсЂЌсЂЪухљтљѕсЂФсѓѕсЂБсЂдсѓѓт«џуЙЕсЂЋсѓїсѓІ[2]сђѓуЈЙУАїсЂ«сЃбсЃЄсЃФсЂ»сђЂу┤░УЃъсѓисѓ░сЃісЃФС╝ЮжЂћсђЂсѓбсЃЮсЃѕсЃ╝сѓисѓ╣сђЂу┤░УЃътѕєУБѓсђЂУєюсЂ«тЄ║УійсђЂу┤░УЃъУъЇтљѕсЂфсЂЕсђЂтцџсЂЈсЂ«у┤░УЃъжЂјуеІсЂФжќбжђБсЂЎсѓІжЄЇУдЂсЂфуЅ╣тЙ┤сѓњУфгТўјсЂЎсѓІсЂЊсЂесЂїсЂДсЂЇсђЂу┤░УЃъУєюсЂ«сЃбсЃЄсЃФсЂесЂЌсЂдТюђсѓѓтЈЌсЂЉтЁЦсѓїсѓЅсѓїсЂдсЂёсѓІсђѓ тїќтГдуџёТДІТѕљу┤░УЃъУєюсЂ»тїќтГдуџёсЂФсЂ»сђЂсЃфсЃ│УёѓУ│фсђЂсѓ┐сЃ│сЃЉсѓ»У│фсђЂуѓГТ░┤тїќуЅЕсђЂсѓ│сЃгсѓ╣сЃєсЃГсЃ╝сЃФсЂесЂёсЂє4сЂцсЂ«УдЂу┤асЂІсѓЅТДІТѕљсЂЋсѓїсѓІсђѓ т«ЪжеЊуџёУе╝ТІаТЕЪУЃйуџёсЂфућЪСйЊУєюсЂ«ТїЂсЂцТхЂтІЋуџёТђДУ│фсЂ»сђЂсѓ╣сЃћсЃ│сЃЕсЃЎсЃфсЃ│сѓ░сђЂXуиџтЏъТіўсђЂсѓФсЃГсЃфсЃАсЃѕсЃфсЃ╝т«ЪжеЊсѓњжђџсЂўсЂдуц║сЂЋсѓїсЂдсЂЇсЂЪсђѓсЂЊсѓїсѓЅсЂ«уаћуЕХсЂФсѓѕсЂБсЂдсђЂУєюсѓ┐сЃ│сЃЉсѓ»У│фсЂ«ТІАТЋБжђЪт║дсЂ»УЄфсѓЅсЂїтЪІсѓЂУЙ╝сЂЙсѓїсЂЪУёѓУ│фС║їжЄЇт▒цсЂ«у▓ўт║дсЂ«тй▒жЪ┐сѓњтЈЌсЂЉсѓІсЂЊсЂесЂїуц║сЂЋсѓїсђЂу┤░УЃъУєютєЁсЂ«тѕєтГљсЂ»жЮЎуџёсЂДсЂ»сЂфсЂЈтІЋуџёсЂДсЂѓсѓІсЂЊсЂесЂїт«ЪУе╝сЂЋсѓїсЂЪ[1]сђѓ С╗ЦтЅЇсЂ«ућЪСйЊУєюсЂ«сЃбсЃЄсЃФсЂесЂЌсЂдсЂ»сђЂJ. David RobertsonсЂФсѓѕсѓІтЇўСйЇУєюсЃбсЃЄсЃФсѓёсЃђсЃќсѓйсЃ│РђЊсЃђсЃІсѓесЃфсЃбсЃЄсЃФсЂїсЂѓсЂБсЂЪ[2]сђѓсЂЊсѓїсѓЅсЂ«сЃбсЃЄсЃФсЂДсЂ»сђЂсѓ┐сЃ│сЃЉсѓ»У│фсЂ»сЃфсЃ│УёѓУ│фсЂ«С║їжЄЇт▒цсЂФтЈќсѓіУЙ╝сЂЙсѓїсЂдсЂёсѓІсЂ«сЂДсЂ»сЂфсЂЈсђЂУёѓУ│фт▒цсЂФжџБТјЦсЂЌсЂЪсѓисЃ╝сЃѕсЂесЂЌсЂдтГўтюесЂЌсЂдсЂёсѓІсЂесЂЋсѓїсЂЪсђѓС╗ќсЂ«сЃбсЃЄсЃФсЂДсЂ»сђЂсѓ┐сЃ│сЃЉсѓ»У│фсЂеУёѓУ│фсЂ«т▒цсЂїУдЈтЅЄТГБсЂЌсЂЈу╣░сѓіУ┐ћсЂЋсѓїсЂдсЂёсѓІсЂесЂЋсѓїсЂЪсђѓсЂЊсѓїсѓЅсЂ«сЃбсЃЄсЃФсЂ»жАЋтЙ«жЈАуџёсЃ╗ує▒тіЏтГдуџёсЂфсЃЄсЃ╝сѓ┐сЂФсѓѕсѓІТћ»ТїЂсЂїсЂѓсЂЙсѓітЙЌсѓЅсѓїсЂџсђЂУєюсЂ«тІЋуџёсЂфТђДУ│фсЂ«Уе╝ТІасѓњтЈќсѓітЁЦсѓїсѓІсЂЊсЂесѓѓсЂДсЂЇсЂфсЂІсЂБсЂЪ[2]сђѓ  ућЪСйЊУєюсЂ«ТхЂтІЋуџёТђДУ│фсѓњТћ»ТїЂсЂЎсѓІУе╝ТІасЂесЂфсѓІжЄЇУдЂсЂфт«ЪжеЊсЂ»FryeсЂеEdidinсЂФсѓѕсЂБсЂдУАїсѓЈсѓїсЂЪсђѓтй╝сѓЅсЂ»сђЂсѓ╗сЃ│сЃђсѓцсѓдсѓцсЃФсѓ╣сѓњућесЂёсЂдсЃњсЃѕсЂесЃъсѓдсѓ╣сЂ«у┤░УЃъсѓњУъЇтљѕсЂЋсЂЏсђЂсЃўсЃєсЃГсѓФсЃфсѓфсЃ│сѓњтйбТѕљсЂЋсЂЏсЂЪсђѓсЃъсѓдсѓ╣сЂесЃњсЃѕсЂ«сѓ┐сЃ│сЃЉсѓ»У│фсЂ»сђЂу┤░УЃъУъЇтљѕсЂ«уЏ┤тЙїсЂ»сЃўсЃєсЃГсѓФсЃфсѓфсЃ│сЂ«тљётЇіуљЃсЂФтѕєсЂІсѓїсЂдСйЇуй«сЂЌсЂдсЂёсѓІсЂЊсЂесЂїТіЌСйЊТЪЊУЅ▓сЂФсѓѕсЂБсЂдуц║сЂЋсѓїсЂЪсђѓсЂЌсЂІсЂЌсђЂсѓ┐сЃ│сЃЉсѓ»У│фсЂ»тЙљсђЁсЂФТІАТЋБсЂЌсђЂТЎѓжќЊсЂетЁ▒сЂФСИАтЇіуљЃсЂ«тбЃуЋїсЂ»тц▒сѓЈсѓїсЂЪсђѓТИЕт║дсѓњСИІсЂњсѓІсЂЊсЂесЂДУєюсЂ«сЃфсЃ│УёѓУ│фсЂ«ТхЂСйЊуЏИсЂІсѓЅсѓ▓сЃФуЏИсЂИсЂ«У╗буД╗сЂїт╝ЋсЂЇУхисЂЊсЂЋсѓїсђЂТІАТЋБсЂ«жђЪт║дсЂ»СйјСИІсЂЌсЂЪ[3]сђѓсѓисЃ│сѓгсЃ╝сЂесЃІсѓ│сЃФсѓйсЃ│сЂ»сђЂТхЂтІЋсЃбсѓХсѓцсѓ»сЃбсЃЄсЃФсѓњућесЂёсЂдсЂЊсѓїсѓЅсЂ«т«ЪжеЊсЂ«ухљТъюсѓњтљѕуљєуџёсЂФУфгТўјсЂЌсЂЪ[1]сђѓ ТхЂтІЋсЃбсѓХсѓцсѓ»сЃбсЃЄсЃФсЂ»сђЂу┤░УЃъУєюсЂ«ТДІжђасЂеТђДУ│фсЂ«ТИЕт║дсЂФсѓѕсѓІтцЅтїќсѓёсђЂУєюсЂеУєюсѓ┐сЃ│сЃЉсѓ»У│фсЂ«ухљтљѕсЂ«УфгТўјсЂїтЈ»УЃйсЂДсЂѓсЂБсЂЪсђѓсѓисЃ│сѓгсЃ╝сЂесЃІсѓ│сЃФсѓйсЃ│сЂ»УЄфсѓЅсЂ«сЃбсЃЄсЃФсѓњТћ»ТїЂсЂЎсѓІтцџсЂЈсЂ«Уе╝ТІасѓњУцЄТЋ░сЂ«тѕєжЄјсЂІсѓЅтЙЌсЂдсЂёсЂЪсЂїсђЂУ┐Љт╣┤сЂ«УЏЇтЁЅжАЋтЙ«жЈАсѓёТДІжђаућЪуЅЕтГдсЂ«жђ▓т▒ЋсЂФсѓѕсЂБсЂду┤░УЃъУєюсЂ«ТхЂтІЋсЃбсѓХсѓцсѓ»ТђДсЂ»уб║Уе╝сЂЋсѓїсЂЪсђѓ сЂЮсЂ«тЙїсЂ«уЎ║т▒ЋУєюсЂ«жЮът»ЙуД░ТђДућЪСйЊУєюсЂ«2сЂцсЂ«т▒цсЂ»жЮът»ЙуД░уџёсЂДсђЂсЂЋсѓЅсЂФуЅ╣т«џсЂ«сѓ┐сЃ│сЃЉсѓ»У│фсѓёУёѓУ│фухёТѕљсЂФсѓѕсЂБсЂдТДІТѕљсЂЋсѓїсѓІсѓхсЃќсЃЅсЃАсѓцсЃ│сЂИсЂетѕєтЅ▓сЂЋсѓїсѓІсђѓсЂЊсѓїсЂФсѓѕсЂБсЂдсђЂУєюсЂежќбжђБсЂЌсЂЪућЪуЅЕтГдуџёжЂјуеІсѓњуЕ║жќЊуџёсЂФтѕєжЏбсЂЎсѓІсЂЊсЂесЂїтЈ»УЃйсЂесЂфсЂБсЂдсЂёсѓІсђѓсѓ│сЃгсѓ╣сЃєсЃГсЃ╝сЃФсЂесѓ│сЃгсѓ╣сЃєсЃГсЃ╝сЃФухљтљѕсѓ┐сЃ│сЃЉсѓ»У│фсЂ»УёѓУ│фсЃЕсЃЋсЃѕсЂФжЏєСИГсЂЌсЂдсЂісѓісђЂсЂЊсѓїсѓЅсЂ«сЃЕсЃЋсЃѕсЂФжЎљт«џсЂЋсѓїсЂЪу┤░УЃъсѓисѓ░сЃісЃфсЃ│сѓ░сЂїУАїсѓЈсѓїсѓІ[4]сђѓС╗ќсЂ«жЮът»ЙуД░ТђДсЂ»MouritsenсЂеBloomсЂФсѓѕсЂБсЂд1984т╣┤сЂФуц║сЂЋсѓїсЂЪсђѓтй╝сѓЅсЂ»УёѓУ│ф-сѓ┐сЃ│сЃЉсѓ»У│фжќЊуЏИС║њСйюућесЂФсѓѕсЂБсЂдУёѓУ│фУєюсЂ«тјџсЂЋсѓёсѓ┐сЃ│сЃЉсѓ»У│фсЂ«уќјТ░┤ТђДжаўтЪЪсЂ«жЋисЂЋсЂїтцЅтїќсЂЎсѓІсЂесЂёсЂєсЃъсЃЃсЃѕсЃгсѓ╣сЃбсЃЄсЃФ№╝ѕMattress model№╝ЅсѓњТЈљтћ▒сЂЌсЂЪ[5]сђѓ С║їжЄЇт▒цсЂДсЂ»сЂфсЂёУєюТхЂтІЋсЃбсѓХсѓцсѓ»сЃбсЃЄсЃФсЂ«уЎ║УАетЙїсђЂжЄЇУдЂсЂфућЪуЅЕтГдуџёТЕЪУЃйсѓњТїЂсЂцсђЂС║їжЄЇУєюсЂДсЂ»сЂфсЂёУёѓУ│фТДІТѕљсЂ«тГўтюесЂїуб║УфЇсЂЋсѓїсЂЪсђѓсЂЊсѓїсѓЅсЂ«УєюТДІжђасЂ»у┤░УЃътѕєУБѓсѓёт»єуЮђухљтљѕсЂ«тйбТѕљТЎѓсЂФсЂ┐сѓЅсѓїсђЂу┤░УЃъсЂїжЮъС║їжЄЇт▒цТДІжђасѓњТІАтцДсЂЎсѓІт┐ЁУдЂсЂїсЂѓсѓІТЎѓсЂФТюЅућесЂДсЂѓсѓІтЈ»УЃйТђДсЂїсЂѓсѓІ[6]сђѓ УєюсЂ«Т╣ЙТЏ▓УєюсЂ«С║їжЄЇт▒цсЂ»тИИсЂФт╣│тЮдсЂДсЂѓсѓІсѓЈсЂЉсЂДсЂ»сЂфсЂёсђѓт▒ђТЅђуџёсЂфУєюсЂ«Т╣ЙТЏ▓сЂ»сђЂСИіУ┐░сЂЌсЂЪжЮът»ЙуД░уџёсЂфУёѓУ│фухёТѕљсѓёжЮъС║їжЄЇт▒цТДІжђасЂФсѓѕсЂБсЂдт╝ЋсЂЇУхисЂЊсЂЋсѓїсѓІсђѓсѓѕсѓітіЄуџёсЂДТЕЪУЃйуџёсЂфТ╣ЙТЏ▓сЂїBARсЃЅсЃАсѓцсЃ│сЂФсѓѕсЂБсЂдУАїсѓЈсѓїсѓІсђѓBARсЃЅсЃАсѓцсЃ│сЂ»УєюУАежЮбсЂ«сЃЏсѓ╣сЃЋсѓАсЃЂсѓИсЃФсѓцсЃјсѓисЃѕсЃ╝сЃФсЂФухљтљѕсЂЌсђЂт░ЈУЃъсѓёу┤░УЃът░ЈтЎет«ўсЂ«тйбТѕљсђЂу┤░УЃътѕєУБѓсѓњтіЕсЂЉсѓІ[7]сђѓтИИсЂФТхЂтІЋуџёсЂФТ╣ЙТЏ▓сЂ»тйбТѕљсЂЋсѓїуХџсЂЉсЂдсЂісѓісђЂућЪСйЊУєюсЂ«тІЋуџёсЂфТђДУ│фсЂФт»ёСИјсЂЌсЂдсЂёсѓІ[8]сђѓ УєютєЁсЂ«УёѓУ│фсЂ«уД╗тІЋ1970т╣┤С╗БсЂФсђЂтђІсђЁсЂ«УёѓУ│фтѕєтГљсЂ»УёѓУ│фУєюсЂ«тљёт▒цтєЁсѓњТефТќ╣тљЉсЂФУЄфућ▒сЂФТІАТЋБсЂЎсѓІсЂЊсЂесЂїТўјсѓЅсЂІсЂФсЂЋсѓїсЂЪ[9]сђѓт╣│тЮЄуџёсЂфУёѓУ│фтѕєтГљсЂ»1уДњсЂДу┤ё 2 ┬хmсЂежФўжђЪсЂДТІАТЋБсЂЌсђЂсЂЊсѓїсЂ»тцДсЂЇсЂфу┤░УЈїсЂ«у┤░УЃъсЂ«жЋисЂЋсЂФуЏИтйЊсЂЎсѓІ[9]сђѓсЂЙсЂЪтђІсђЁсЂ«УёѓУ│фтѕєтГљсЂїУЄфУ║ФсЂ«У╗ИсЂФТ▓┐сЂБсЂджФўжђЪсЂДтЏъУ╗бсЂЌсЂдсЂёсѓІсЂЊсЂесѓѓУд│т»ЪсЂЋсѓїсЂЪ[9]сђѓсЂЋсѓЅсЂФсЃфсЃ│УёѓУ│фтѕєтГљсЂ»сђЂуеђсЂФсЂДсЂ»сЂѓсѓІсЂїсђЂСИђТќ╣сЂ«т▒цсЂІсѓЅС╗ќТќ╣сЂ«т▒цсЂИуД╗тІЋсЂЎсѓІ№╝ѕсЃЋсЃфсЃЃсЃЌсЃЋсЃГсЃЃсЃЌ№╝ѕflip-flop№╝ЅсЂесЂЌсЂдуЪЦсѓЅсѓїсѓІ№╝ЅсђѓсЂЌсЂІсЂЌсђЂсЃЋсЃфсЃЃсЃЌсЃЋсЃГсЃЃсЃЌсЂ»сЃЋсЃфсЃЃсЃЉсЃ╝сѓ╝сЂетЉ╝сЂ░сѓїсѓІжЁху┤асЂФсѓѕсЂБсЂдтбЌт╝исЂЋсѓїсЂЪсѓѓсЂ«сЂДсЂѓсѓІтЈ»УЃйТђДсЂїсЂѓсѓІсђѓСИіУ┐░сЂЌсЂЪсЂЊсѓїсѓЅсЂ«жЂјуеІсЂ»сђЂУёѓУ│фтѕєтГљсЂеУёѓУ│фУєютєЁсЂДуЏИС║њСйюућесЂЎсѓІсѓ┐сЃ│сЃЉсѓ»У│фсЂ«уёАуДЕт║ЈТђДсЂФтй▒жЪ┐сЂЌсђЂУєюсЂ«ТхЂтІЋТђДсѓёсѓисѓ░сЃісЃФС╝ЮжЂћсђЂУ╝ИжђЂсђЂТЕЪУЃйсЂФтй▒жЪ┐сѓњсѓѓсЂЪсѓЅсЂЌсЂдсЂёсѓІсђѓ С║їжЄЇт▒цсЂ«ТхЂтІЋТђДсЂ«тѕХжЎљУёѓУ│фсѓёсѓ┐сЃ│сЃЉсѓ»У│фУдЂу┤асЂ«ТефТќ╣тљЉсЂ«уД╗тІЋТђДсЂ»сђЂУёѓУ│фС║їжЄЇт▒цтєЁсЂДсЂ«сѓхсЃќсЃЅсЃАсѓцсЃ│сЂ«тйбТѕљсЂФсѓѕсЂБсЂдтѕХжЎљсЂЋсѓїсѓІсђѓсЂЊсѓїсѓЅсЂ«сѓхсЃќсЃЅсЃАсѓцсЃ│сЂ»сђЂУєюУдЂу┤асЂ«у┤░УЃътцќсЃъсЃѕсЃфсЃЃсѓ»сѓ╣сЂИсЂ«ухљтљѕсЂфсЂЕсЂ«сЂёсЂЈсЂцсЂІсЂ«жЂјуеІсѓёсђЂсЂЙсЂЪсЂ»сѓ┐сЃ│сЃЉсѓ»У│фУцЄтљѕСйЊсѓёУёѓУ│фсЃЕсЃЋсЃѕсЂ«тйбТѕљсѓњС┐Ѓжђ▓сЂЎсѓІсѓѕсЂєсЂфуЅ╣т«џсЂ«ућЪтїќтГдуџёухёТѕљсѓњТїЂсЂцсЃісЃјсЃАсЃ╝сЃѕсЃФсѓ╣сѓ▒сЃ╝сЃФсЂ«УєюжаўтЪЪсЂфсЂЕсЂФсѓѕсЂБсЂдућЪсЂўсѓІ[2]сђѓсЂЋсѓЅсЂФсђЂсѓ┐сЃ│сЃЉсѓ»У│фсЂеу┤░УЃъжфеТа╝сЂ«ТјЦуЮђсЂФсѓѕсЂБсЂдРђюcytoskeletal fencesРђЮсЂїтйбТѕљсЂЋсѓїсѓІсђѓсЂЊсЂ«ТЪхсЂ«тєЁжЃесЂДсЂ»УёѓУ│фсѓёУєюсѓ┐сЃ│сЃЉсѓ»У│фсЂ»УЄфућ▒сЂФТІАТЋБсЂЎсѓІсЂїсђЂсЂЮсЂЊсЂІсѓЅтцќжЃесЂИжЏбсѓїсѓІсЂЊсЂесЂ»сѓЂсЂБсЂЪсЂФУхисЂЊсѓЅсЂфсЂё[2]сђѓУєюУдЂу┤асЂ«ТефТќ╣тљЉсЂ«ТІАТЋБжђЪт║дсЂ«тѕХжЎљсЂФсѓѕсЂБсЂду┤░УЃъУєюсЂ«уЅ╣т«џсЂ«жаўтЪЪсЂФуЅ╣т«џсЂ«ТЕЪУЃйсѓњС╗ўСИјсЂЎсѓІсЂЊсЂесЂїтЈ»УЃйсЂесЂфсѓІсЂЪсѓЂсђЂсЂЊсѓїсѓЅсЂ»ТЦхсѓЂсЂджЄЇУдЂсЂДсЂѓсѓІсђѓ УёѓУ│фсЃЕсЃЋсЃѕУёѓУ│фсЃЕсЃЋсЃѕсЂ»сђЂуЅ╣т«џсЂ«УёѓУ│фсЂесѓ┐сЃ│сЃЉсѓ»У│фухёТѕљсѓњТюЅсЂЎсѓІсЃісЃјсЃАсЃ╝сЃѕсЃФсѓ╣сѓ▒сЃ╝сЃФсЂ«жаўтЪЪсЂДсЂѓсѓісђЂТефТќ╣тљЉсЂФТІАТЋБсЂЌУёѓУ│фС║їжЄЇт▒цСИісѓњуД╗тІЋсЂЎсѓІсђѓсѓ╣сЃЋсѓБсЃ│сѓ┤сЃфсЃ│УёѓУ│фсЂесѓ│сЃгсѓ╣сЃєсЃГсЃ╝сЃФсЂ»сђЂУёѓУ│фсЃЕсЃЋсЃѕсЂ«жЄЇУдЂсЂфТДІТѕљУдЂу┤асЂДсЂѓсѓІ[10]сђѓ сѓ┐сЃ│сЃЉсѓ»У│фУцЄтљѕСйЊу┤░УЃъУєюсЂ«сѓ┐сЃ│сЃЉсѓ»У│фсѓёу│ќсѓ┐сЃ│сЃЉсѓ»У│фсЂ»сђЂсѓисЃ│сѓгсЃ╝сЂесЃІсѓ│сЃФсѓйсЃ│сЂї1972т╣┤сЂФТюђтѕЮсЂФТЈљтћ▒сЂЌсЂЪсѓѕсЂєсЂФУёѓУ│фУєюсЂФтЇўуІгсЂ«УдЂу┤асЂесЂЌсЂдтГўтюесЂЌсЂдсЂёсѓІсЂ«сЂДсЂ»сЂфсЂёсђѓсѓђсЂЌсѓЇсђЂУєютєЁсѓњТІАТЋБсЂЎсѓІУцЄтљѕСйЊсЂесЂЌсЂдтГўтюесЂЌсЂдсЂёсѓІ[2]сђѓсЂЊсЂ«сѓѕсЂєсЂфжФўтѕєтГљУцЄтљѕСйЊсЂИсЂ«жЏєтљѕсЂ»сђЂсѓцсѓфсЃ│сѓёС╗БУгЮућБуЅЕсЂ«У╝ИжђЂсђЂсѓисѓ░сЃісЃФС╝ЮжЂћсђЂу┤░УЃъТјЦуЮђсђЂу┤░УЃъжЂіУх░сЂесЂёсЂБсЂЪжЄЇУдЂсЂфу┤░УЃъТЕЪУЃйсѓњсѓѓсЂЪсѓЅсЂЌсЂдсЂёсѓІ[2]сђѓ cytoskeletal fencesсЂеу┤░УЃътцќсЃъсЃѕсЃфсЃЃсѓ»сѓ╣сЂИсЂ«ухљтљѕУёѓУ│фС║їжЄЇУєюсЂФтЪІсѓЂУЙ╝сЂЙсѓїсЂЪсѓ┐сЃ│сЃЉсѓ»У│фсЂ«СИђжЃесЂ»сђЂу┤░УЃътцќсЃъсЃѕсЃфсЃЃсѓ»сѓ╣сђЂу┤░УЃътєЁсЂ«у┤░УЃъжфеТа╝у╣іуХГсђЂсѓ╗сЃЌсЃЂсЃ│сЂ«сЃфсЃ│сѓ░уіХТДІжђасЂеуЏИС║њСйюућесЂЌсЂдсЂёсѓІсђѓсЂЊсѓїсѓЅсЂ«уЏИС║њСйюућесЂ»сђЂу┤░УЃъсЂ«тйбуіХсѓёТДІжђасђЂтї║ућ╗тїќсЂФт╝исЂётй▒жЪ┐сѓњСИјсЂѕсЂдсЂёсѓІсђѓсЂЋсѓЅсЂФсЂЊсѓїсѓЅсЂ»сђЂсѓ┐сЃ│сЃЉсѓ»У│фсЂеСИђжЃесЂ«УёѓУ│фсЂ«С║їжЄЇУєютєЁсЂ«ТефТќ╣тљЉсЂ«ТІАТЋБсЂФт»ЙсЂЎсѓІуЅЕуљєуџёсЂфжџютБЂсЂесЂфсЂБсЂдсЂёсѓІ[2]сђѓ УєюсЂИтЪІсѓЂУЙ╝сЂЙсѓїсЂЪсѓ┐сЃ│сЃЉсѓ»У│фсЂїу┤░УЃътцќсЃъсЃѕсЃфсЃЃсѓ»сѓ╣сЂИухљтљѕсЂЌсЂдсЂёсѓІсЂесЂЇсђЂсЂЮсѓїсѓЅсЂ»УЄфућ▒сЂФТІАТЋБсЂЎсѓІсЂЊсЂесЂ»сЂДсЂЇсЂфсЂёсђѓсЂЙсЂЪсђЂжЋисЂёу┤░УЃътєЁсЃЅсЃАсѓцсЃ│сѓњТїЂсЂцсѓ┐сЃ│сЃЉсѓ»У│фсЂ»сђЂу┤░УЃъжфеТа╝у╣іуХГсЂФсѓѕсЂБсЂдтйбТѕљсЂЋсѓїсЂЪТЪх№╝ѕcytoskeletal fences№╝ЅсЂеУАЮуфЂсЂЎсѓІ[11]сђѓсЂЕсЂАсѓЅсЂ«жЂјуеІсѓѓсѓ┐сЃ│сЃЉсѓ»У│фсЂеухљтљѕУёѓУ│фсЂ«ТІАТЋБсѓњтѕХжЎљсЂЌсђЂсЂЮсѓїсѓЅсЂеуЏИС║њСйюућесЂЌсЂдсЂёсѓІу┤░УЃъУєюсЂ«УдЂу┤асѓѓтљїТДўсЂФТІАТЋБсЂїтѕХжЎљсЂЋсѓїсѓІсђѓ 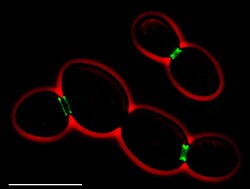 сѓ╗сЃЌсЃЂсЃ│сЂ»GTPухљтљѕсѓ┐сЃ│сЃЉсѓ»У│фсЂ«сЃЋсѓАсЃЪсЃфсЃ╝сЂДсђЂуюЪТаИућЪуЅЕсЂДжФўт║дсЂФС┐ЮтГўсЂЋсѓїсЂдсЂёсѓІсђѓтјЪТаИућЪуЅЕсѓѓсЃЉсЃЕсѓ╗сЃЌсЃЂсЃ│№╝ѕparaseptin№╝ЅсЂетЉ╝сЂ░сѓїсѓІжАъС╝╝сЂЌсЂЪсѓ┐сЃ│сЃЉсѓ»У│фсѓњТюЅсЂЌсЂдсЂёсѓІсђѓсЂЊсѓїсѓЅсЂ»у┤░УЃъУєюсЂет╝исЂЈухљтљѕсЂЌсЂЪсЃфсЃ│сѓ░уіХТДІжђасѓњтйбТѕљсЂЌсђЂу┤░УЃъсѓњтї║ућ╗тїќсЂЎсѓІсђѓсѓ╗сЃЌсЃЂсЃ│сЂ»сђЂу╣іТ»ЏсђЂжъГТ»ЏсђЂТе╣уіХуфЂУхисѓ╣сЃЉсѓцсЃ│сђЂжЁхТ»ЇсЂ«тЄ║УійТДІжђасЂфсЂЕсЂ«тйбТѕљсЂФжќбСИјсЂЌсЂдсЂёсѓІ[12]сђѓ ТГ┤тЈ▓т╣┤УАе
тЄ║тЁИ
|
Portal di Ensiklopedia Dunia













