ýŚ╝ÝÖö ÝüČŰíťŰ«┤(II)
ýŁ┤ŰŽä
IUPAC ýŁ┤ŰŽä
Chromium(II) chloride
Ű│äý╣ş
ýŚ╝ÝÖö ÝüČŰíťŰ«┤(II)
ýőŁŰ│äý×É
ChemSpider
ECHA InfoCard 100.030.136
RTECS Ű▓łÝśŞ
UNII
InChI=1S/2ClH.Cr/h2*1H;/q;;+2/p-2
ýśł Key: XBWRJSSJWDOUSJ-UHFFFAOYSA-L
ýśł InChI=1/2ClH.Cr/h2*1H;/q;;+2/p-2
Key: XBWRJSSJWDOUSJ-NUQVWONBAQ
ýä▒ýžł
Cl 2 Cr
۬░ ýžłŰčë
Ôłĺ1
ŕ▓ëŰ│┤ŕŞ░
Ű░▒ýâë´Ż×ÝÜîŰů╣ýâë(ŰČ┤ýłś), Ű╣äýâüýŁ┤ ýëŻŕ▓î ÝŁíýŐÁ ÝĽĘ
Űâäýâł
šäíŔçş
Ű░ÇŰĆä
2.88 g/cm3 (24 ┬░C)[ 1]
Űů╣ŰŐöýáÉ
824 ┬░C (1,097 K)´╝łŰČ┤ýłś´╝ë[ 1]
ŰüôŰŐöýáÉ
1,302 ┬░C (1,575 K)´╝łŰČ┤ýłś´╝ë[ 1]
ŕ░ÇýÜę[ 1]
ýÜęÝĽ┤ŰĆä
ýŚÉÝâäýśČ , ŰööýŚÉÝőŞýŚÉÝůîŰą┤ ýŚÉ ŰÂłýÜęýä▒
ýé░ýä▒ŰĆä (pK a )
2
+7230┬Ě10Ôłĺ6 cm3 /mol
ŕÁČýí░
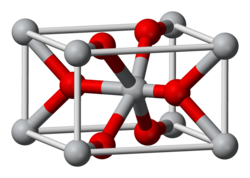
Orthorhombic (deformed rutile , ŰČ┤ýłś), oP6 [ 2] ňŹĽŠľťŠÖš│╗ (ňŤŤŠ░┤ňĺîšëę)[ 3]
Pnnm, No. 58 (anhydrous)[ 2] 1 /c, No. 14 (tetrahydrate)[ 3]
2/m 2/m 2/m (anhydrous)[ 2] [ 3]
a = 6.64 ├ů,
b = 5.98 ├ů,
c = 3.48 ├ů (ŰČ┤ýłś)
[ 2] ╬▒ = 90┬░, ╬▓ = 90┬░, ╬│ = 90┬░
Octahedral (Cr2+ , ŰČ┤ýłś)[ 2]
ýŚ┤ÝÖöÝĽÖ
71.2 J/mol┬ĚK[ 1]
115.3 J/mol┬ĚK[ 1]
Ôłĺ395.4 kJ/mol[ 1]
Ôłĺ356 kJ/mol[ 1]
ýťäÝŚś
ŰČ╝ýžł ýĽłýáä Ű│┤ŕ▒┤ ý×ÉŰúî
Oxford MSDS
GHS ŕĚŞŰŽ╝ŰČŞý×É
[ 4]
ýőáÝśŞýľ┤
ŕ▓Żŕ│á
H302 , H315 , H319 , H335 [ 4]
P261 , P305+351+338 [ 4]
NFPA 704
Ű░śýłś ý╣śýéČŰčë ŰśÉŰŐö Ű░śýłś ý╣śýéČŰćŹŰĆä (LD, LC):
1870 mg/kg (ŃâęŃââŃâł´╝îšÁîňĆúŠŐĽńŞÄ)[ 5]
ŕ┤ÇŰáĘ ÝÖöÝĽęŰČ╝
ń║îň╝ŚňîľŃé»ŃâşŃâá ń║îŔçşňîľŃé»ŃâşŃâá ń║îŠ▓âňîľŃé»ŃâşŃâá
ňíęňîľŃé»ŃâşŃâá ňŤŤňíęňîľŃé»ŃâşŃâá ń║îňíęňîľŃâóŃâ¬ŃâľŃâçŃâ│ ń║îňíęňîľŃé┐Ńâ│Ńé░Ńé╣ŃâćŃâ│
ŰőČŰŽČ Ű¬ůýőťŰÉť ŕ▓ŻýÜ░Űą╝ ýáťýÖŞÝĽśŰę┤,
ÝĹťýĄÇýâüÝâť (25 ┬░C [77 ┬░F], 100 kPa)ýŚÉýäť ŰČ╝ýžłýŁś ýáĽŰ│┤ŕ░Ç ýáťŕ│ÁŰÉĘ.
ýŁ┤ýŚ╝ÝÖö ÝüČŰíťŰ«┤ (ÝüČŰíČ), ýŽë ýŚ╝ÝÖö ÝüČŰíťŰ«┤(II) (Chromium(II) chloride)ýŁÇ ŰČ┤ŕŞ░ ÝÖöÝĽęŰČ╝ ýŁś ýŁ╝ýóůýť╝Űíť ÝÖöÝĽÖýőŁ CrCl2 (H2 O)n ýŁ┤ŰőĄ. ŰČ┤ýłś ýŁ┤ýŚ╝ÝÖö ÝüČŰíťŰ«┤ýŁÇ Ű░▒ýâë ŕ│áý▓┤ýŁ┤ýžÇŰžî ŰÂłýłťŰČ╝ ŰĽîŰČŞýŚÉ ÝÜîŰů╣ýâëýť╝Űíť Ű│ÇÝĽťŰőĄ. ýŁ┤ýŚ╝ÝÖö ÝüČŰíťŰ«┤ ýéČýłśÝÖöŰČ╝ Cr(H2 O)4 Cl2 ŰŐö Ű░ŁýŁÇ ý▓şýâë ŕ│áý▓┤ýŁ┤ŰőĄ. ýŁ┤ýŚ╝ÝÖö ÝüČŰíČýŁÇ ýâüýŚůýáüýť╝Űíť ýŁ┤ýÜęŰÉśýžÇ ýĽŐýžÇŰžî ŰőĄŰąŞ ÝüČŰíťŰ«┤ ý░ęŰČ╝ýŁä ÝĽęýä▒ÝĽśŕŞ░ ýťäÝĽ┤ ýőĄÝŚśýőĄ ŕ̝۬ĘŰíť ýéČýÜęŰÉťŰőĄ.
CrCl2 ŰŐö 500ÔäâýŚÉýäť ýé╝ýŚ╝ÝÖö ÝüČŰíČ ýť╝ŰíťŰÂÇÝä░ ýłśýćî ýŚÉ ýŁśÝĽ┤ ÝÖśýŤÉŰĆ╝ýäť ýâŁŕŞ┤ŰőĄ.
2 CrCl3 + H2 Ôćĺ 2 CrCl2 + 2 HCl Ýś╣ýŁÇ ýáäÝĽ┤ Űíť ýáťýí░ŰÉťŰőĄ[ 6]
ýŁ┤ýŚ╝ÝÖö ÝüČŰíťŰ«┤ýŁś ýćîŕĚťŰ¬Ę ÝĽęýä▒ýŁÇ LiAlH4 Űéś ýĽäýŚ░ ýŁ┤Űéś ŕŞ░ÝâÇ ÝÖśýŤÉýáťŰíť CrCl3 Űą╝ ÝÖśýŤÉÝĽĘýť╝ŰíťýŹĘ ýľ╗ýŁä ýłś ý׳ŰőĄ.
4 CrCl3 + LiAlH4 Ôćĺ 4 CrCl2 + LiCl + AlCl3 + 2 H2
2 CrCl3 + Zn Ôćĺ 2 CrCl2 + ZnCl2 CrCl2 ŰŐö ý×Ĺýé░ ÝüČŰíťŰ«┤ŕ│╝ ýŚ╝ÝÖöýłśýćîŰíťŰÂÇÝä░ ÝĽęýä▒ÝĽá ýłśŰĆä ý׳ŰőĄ[ 7]
Cr2 (OAc)4 + 4 HCl Ôćĺ 2 CrCl2 + 4 AcOH
Cr3+ + e- 2+ ýŁś ÝÖśýŤÉ ýáäýťä ŰŐö ´╝Ź0.41VýŁ┤ŰőĄ. ýőĄý▓┤ŰŐö ý┤ëŰžĄ ýŚćýť╝Űę┤ Ű░śýŁĹÝĽśýžÇ ýĽŐýžÇŰžî, ýé░ýä▒ ýí░ŕ▒┤ÝĽśýŚÉýäťŰŐö H+ ýŚÉýäť H2 ŰíťýŁś ÝÖśýŤÉ ýáäýťäŕ░Ç +0.00ýŁ┤ŕŞ░ ŰĽîŰČŞýŚÉ ÝüČŰíČ(II)ýŁ┤ýśĘýŁÇ ýé░ýŁä ýłśýćîŰíť ÝÖśýŤÉÝĽśŕŞ░ýŚÉ ýÂęŰÂäÝĽť ýáäýťäŰą╝ ŕ░ÇýžÇŕ│á ý׳ŰőĄ.
ÔćĹ ŕ░Ç Űéś ŰőĄ ŰŁ╝ Űžł Ű░ö ýéČ ýĽä Lide, David R., ÝÄŞýžĹ. (2009). ŃÇŐCRC Handbook of Chemistry and Physics ŃÇő 90ÝîÉ. Boca Raton, Florida : CRC Press . ISBN 978-1-4200-9084-0 ÔćĹ ŕ░Ç Űéś ŰőĄ ŰŁ╝ Űžł Tracy, Joseph W.; Gregory, N.W.; Lingafelter, E.C.; Dunitz, J.D.; Mez, H.-C.; Rundle, R.E.; Scheringer, Christian; Yakel, H.L.; Wilkinson, M.K. (1961). ÔÇťThe crystal structure of chromium(II) chlorideÔÇŁ. ŃÇŐActa CrystallographicaŃÇő 4 (9): 927ÔÇô929. doi :10.1107/S0365110X61002710 . ÔćĹ ŕ░Ç Űéś ŰőĄ Schnering, H.G. von; Brand, B.-H. (1973). ÔÇťStruktur und Eigenschaften des blauen Chrom(II)-chlorid-tetrahydrats CrCl2 .4H2 OÔÇŁ. ŃÇŐZeitschrift fuer Anorganische und Allgemeine ChemieŃÇő 402 (2): 159ÔÇô168. doi :10.1002/zaac.19734020206 . ÔćĹ ŕ░Ç Űéś ŰőĄ Sigma-Aldrich Co. Retrieved on 2014-07-04.
ÔćĹ ÔÇťMSDS of Chromium(II) chlorideÔÇŁ . ŃÇŐfishersci.caŃÇő. Fisher Scientific. 2014Űůä 7ýŤö 14ýŁ╝ýŚÉ ýŤÉŰ│Ş ŰČŞýäť ýŚÉýäť Ű│┤ýí┤ŰÉť ŰČŞýäť. 2014Űůä 7ýŤö 4ýŁ╝ýŚÉ ÝÖĽýŁŞÝĽĘ . ÔćĹ ÔÇťAnhydrous Chromium(II) ChlorideÔÇŁ. ŃÇŐInorg. Synth. ŃÇő 10 : 26-35. 1967. doi :10.1002/9780470132418.ch4 . ÔćĹ Riley, edited by Georg Brauer ; translated by Scripta Technica, Inc. Translation editor Reed F. (1963). ŃÇŐHandbook of preparative inorganic chemistry. Volume 1ŃÇő 2ÝîÉ. New York, N.Y.: Academic Press. 1337ý¬Ż. ISBN 978-0121266011 Riley, edited by Georg Brauer ; translated by Scripta Technica, Inc. Translation editor Reed F. (1963). ŃÇŐHandbook of preparative inorganic chemistry. Volume 1ŃÇő 2ÝîÉ. New York, N.Y.: Academic Press. 1337ý¬Ż. ISBN 978-0121266011