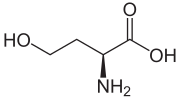
L-호모세린
이름
IUPAC 이름
(S )-2-amino-4-hydroxybutanoic acid
식별자
ChEBI
ChEMBL
ChemSpider
ECHA InfoCard 100.010.538
EC 번호
UNII
InChI=1S/C4H9NO3/c5-3(1-2-6)4(7)8/h3,6H,1-2,5H2,(H,7,8)
예 Key: UKAUYVFTDYCKQA-UHFFFAOYSA-N
예 InChI=1/C4H9NO3/c5-3(1-2-6)4(7)8/h3,6H,1-2,5H2,(H,7,8)
Key: UKAUYVFTDYCKQA-UHFFFAOYAZ
성질
C4 H9 NO3
몰 질량
119.12 g/mol
녹는점
203 °C (분해된다)
달리 명시된 경우를 제외하면,
표준상태 (25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
호모세린 (영어 : homoserine )은 화학식 이 HO2 CCH(NH2 )CH2 CH2 OH인 α-아미노산 이다. 아이소트레오닌 (영어 : isothreonine )이라고도 한다. L-호모세린은 DNA 에 의해 암호화되는 일반적인 아미노산 중 하나가 아니다. 호모세린은 골격에 추가적인 –CH2– 단위 가 삽입되어 있어서 단백질생성성 아미노산 인 세린 과 다르다. 호모세린 또는 그 락톤 형태는 메티오닌 의 분해에 의한 펩타이드 의 사이아노젠 브로마이드 절단의 산물이다.
호모세린은 세 가지 필수 아미노산 인 메티오닌 , 트레오닌 (호모세린의 이성질체 ), 아이소류신 의 생합성 과정에서의 대사 중간생성물 이다.[ 1] 해당과정 , 시트르산 회로 및 아스파르트산 대사 경로가 포함된다. 호모세린은 아스파르트산 세미알데하이드의 중간생성물을 통해 아스파르트산 의 두 번의 환원에 의해 형성된다.[ 2] 호모세린 탈수소효소 는 NADPH와 결합하여 L-아스파르트산 4-세미알데하이드를 L-호모세린으로 상호전환시키는 가역적인 반응을 촉매한다. 그런 다음 두 개의 다른 효소인 호모세린 키네이스 및 호모세린 O -석시닐트랜스퍼레이스 는 호모세린을 기질 로 사용하여 각각 포스포호모세린 및 O -석시닐 호모세린을 생성한다.[ 3]
상업적으로 호모세린은 아이소뷰탄올 과 1,4-뷰테인다이올 합성의 전구체 역할을 할 수 있다.[ 4] [ 5] 프로테오글리칸 당펩타이드 합성을 규명하기 위한 연구에서 중요한 역할을 했다.[ 6] 세균 세포주는 호모세린을 다량으로 만들 수 있다.[ 3] [ 4]
호모세린은 β-포스포아스파르트산으로부터 생성되는 아스파르트산-4-세미알데하이드를 통해 아스파르트산에서 생성된다. 호모세린 탈수소효소 의 작용에 의해 세미알데하이드는 호모세린으로 전환된다.[ 7]
호모세린의 생합성 경로
L-호모세린은 호모세린 키네이스 의 기질로, 포스포호모세린(호모세린-인산)을 생성한 다음, 트레오닌 생성효소 에 의해 L-트레오닌을 생성한다.
호모세린은 호모세린 O -석시닐트랜스퍼레이스 에 의해 L-메티오닌의 전구체인 O -석시닐 호모세린으로 전환된다.[ 8]
호모세린은 아스파르트산 키네이스와 글루탐산 탈수소효소 를 다른 자리 입체적으로 저해한다.[ 3] 글루탐산 탈수소효소는 시트르산 회로를 통해 글루탐산을 α-케토글루타르산으로, α-케토글루타르산을 옥살아세트산으로 가역적으로 전환시킨다. 트레오닌은 아스파르트산 키네이스와 호모세린 탈수소효소의 또 다른 다른 자리 입체성 저해제로 작용하지만, 호모세린 키네이스의 경쟁적 저해제이다.[ 8]
↑ Tanaka M, Kishi T, Kinoshita S (September 1961). “Studies on the Synthesis of l -Amino Acids: Part III. A Synthesis of l -Homoserine from l -Aspartic Acid” . 《Agricultural and Biological Chemistry》 (영어) 25 (9): 678–679. doi :10.1080/00021369.1961.10857862 . ISSN 0002-1369 . ↑ Berg, J. M.; Stryer, L. et al. (2002), Biochemistry . W.H. Freeman. ISBN 0-7167-4684-0
↑ 가 나 다 Liu P, Zhang B, Yao ZH, Liu ZQ, Zheng YG (October 2020). Zhou NY, 편집. “Multiplex Design of the Metabolic Network for Production of l-Homoserine in Escherichia coli” . 《Applied and Environmental Microbiology》 86 (20). doi :10.1128/AEM.01477-20 . PMC 7531971 . PMID 32801175 . ↑ 가 나 Huang JF, Zhang B, Shen ZY, Liu ZQ, Zheng YG (July 2018). “Metabolic engineering of E. coli for the production of O -succinyl-l-homoserine with high yield” . 《3 Biotech》 8 (7): 310. doi :10.1007/s13205-018-1332-x . PMC 6037649 . PMID 30002999 . ↑ Akai S, Ikushiro H, Sawai T, Yano T, Kamiya N, Miyahara I (February 2019). “The crystal structure of homoserine dehydrogenase complexed with l-homoserine and NADPH in a closed form”. 《Journal of Biochemistry》 165 (2): 185–195. doi :10.1093/jb/mvy094 . PMID 30423116 . ↑ Yang W, Ramadan S, Yang B, Yoshida K, Huang X (December 2016). “Homoserine as an Aspartic Acid Precursor for Synthesis of Proteoglycan Glycopeptide Containing Aspartic Acid and a Sulfated Glycan Chain” . 《The Journal of Organic Chemistry》 81 (23): 12052–12059. doi :10.1021/acs.joc.6b02441 . PMC 5215661 . PMID 27809505 . ↑ . doi :10.1021/ar000057q . ↑ 가 나 Petit C, Kim Y, Lee SK, Brown J, Larsen E, Ronning DR, 외. (January 2018). “Reduction of Feedback Inhibition in Homoserine Kinase (ThrB) of Corynebacterium glutamicum Enhances l-Threonine Biosynthesis” . 《ACS Omega》 3 (1): 1178–1186. doi :10.1021/acsomega.7b01597 . PMC 6045374 . PMID 30023797 .