എഥനോൾ
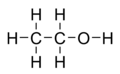
ബാഷ്പശീലമുള്ളതും എളുപ്പം തീ പിടിക്കുന്നതും നിറമില്ലാത്തതുമായ ഒരു ദ്രാവകമാണ് എഥനോൾ. ഈഥൈൽ ആൽക്കഹോൾ എന്നും ഇത് അറിയപ്പെടുന്നു. മദ്യങ്ങളിലും തെർമോമീറ്ററുകളിലും വ്യാപകമായി ഉപയോഗിക്കപ്പെടുന്ന എഥനോൾ കേന്ദ്ര നാഡീവ്യൂഹത്തിന്റെ പ്രവർത്തനത്തെ ബാധിക്കുന്ന ഒരു ആൽക്കഹോളാണ്. ആൽക്കഹോൾ എന്ന പദം സാധാരണ പ്രയോഗത്തിൽ എഥനോളിനെ വിവക്ഷിക്കാനാണ് ഉപയോഗിക്കാറ്. എഥിൽ ഗ്രൂപ്പിന്റെ (C2H5) പ്രതീകം Et ചേർത്ത് EtOH എന്നും എഥനോളിനെ സൂചിപ്പിക്കാറുണ്ട്. സ്ട്രെയിറ്റ് ചെയിൻ ആൽക്കഹോളായ എഥനോളിന്റെ രാസസമവാക്യം C2H5OH ആണ്. CH3-CH2-OH എന്ന രീതിയിലും ഇതിനെ പ്രതിനിധീകരിക്കാം. മെഥിൽ ഗ്രൂപ്പിലെ (CH3-) കാർബൺ മെഥിലീൻ ഗ്രൂപ്പിലെ (-CH2-) കാർബണുമായും, മെഥിലീൻ ഗ്രൂപ്പിലെ കാർബൺ ഹൈഡ്രോക്സിൽ ഗ്രൂപ്പിലെ (-OH) ഓക്സിജനുമായും ബന്ധനത്തിലേർപ്പെട്ടിരിക്കുന്നു എന്നാണ് ഇത് സൂചിപ്പിക്കുന്നത്. എഥനോളിന്റെ എമ്പറിക്കൽ സമവാക്യം C2H6O ആണ്. അതിനാൽ ഇത് ഡൈമെഥിൽ ഈഥറിന്റെ ഐസോമെറുകളിലൊന്നാണ്. ചരിത്രംമനുഷ്യർ ആദ്യമായി ഉപയോഗിച്ച ബയോടെക്നോളജികളിൽ ഒന്നാണ് പഞ്ചസാരയുടെ പുളിപ്പിക്കലിലൂടെ എഥനോൾ ഉണ്ടാക്കുന്ന പ്രക്രീയ. എഥനോളിന്റെ ലഹരി നൽകാനുള്ള കഴിവ് സംബന്ധിച്ച് പുരാതനകാലം മുതലേ മനുഷ്യർക്ക് അറിവുണ്ടായിരുന്നു. ചൈനയിൽ നിന്ന് കണ്ടെടുത്ത 9,000-വർഷം പഴക്കമുള്ള കളിമൺ പാത്രത്തിലെ ഉണങ്ങിയ അംശത്തിൽ നിന്ന് ആധുനിക ശിലായുഗത്തിലെ ആൾക്കാർ മദ്യം ഉപയോഗിച്ചിരുന്നു എന്ന് മനസ്സിലാക്കാം. [1] ആദ്യകാലത്തുതന്നെ ഗ്രീക്കുകാർക്കും അറബികൾക്കും വാറ്റൽ പ്രക്രീയയെപ്പറ്റി അറിവുണ്ടായിരുന്നുവെങ്കിലും പന്ത്രണ്ടാം നൂറ്റാണ്ടിൽ സ്കൂൾ ഓഫ് സാലെർണോയിലെ ആൽക്കെമിസ്റ്റുകളാണ് വൈനിൽ നിന്ന് ആദ്യമായി ആൾക്കഹോൾ വാറ്റിയതായി രേഖയുള്ളത്. [2] റെയ്മണ്ട് ലൾ എന്നയാളായിരുന്നു ആദ്യമായി 100% ആൾക്കഹോളിനെക്കുറിച്ച് (ആബ്സൊല്യൂട്ട് ആൾക്കഹോൾ) പരാമർശിച്ചയാൾ.[2] 1796-ൽ ജോഹാൻ ടോബിയാസ് ലോവിറ്റ്സ് എന്നയാൾ എഥനോളും വെള്ളവും കലർന്ന മിശ്രിതം ജലാംശമില്ലാത്ത ക്ഷാരത്തോട് (അൻഹൈഡ്രസ് ആൽക്കലി) ചേർത്ത് ഇളം ചൂടിൽ വാറ്റി 100% ശുദ്ധമായ എഥനോൾ ഉണ്ടാക്കി. [3] അന്റോയിൻ ലവോയ്സിയർ കാർബണും ഹൈഡ്രജനും ഓക്സിജനും കലർന്ന ഒരു തന്മാത്രയാണ് എഥനോളിന്റെതെന്ന് വിവരിക്കുകയുണ്ടായി. 1807-ൽ നിക്കോളാസ്-തിയഡോർ ഡെ സൗസ്സ്യൂർ എഥനോളിന്റെ രാസവാക്യം (കെമിക്കൽ ഫോർമുല) കണ്ടെത്തി.[4][5] അൻപതു വർഷത്തിനു ശേഷം ആർച്ചിബാൾഡ് സ്കോട്ട് കൂപ്പർ എഥനോളിന്റെ രാസഘടന (സ്ട്രക്ചറൽ ഫോർമുല) കണ്ടെത്തി. ഒരു രാസവസ്തുവിന്റെ ഘടന കണ്ടുപിടിച്ച ആദ്യ സംഭവങ്ങളിലൊന്നാണിത്. [6] കൃത്രിമമായി എഥനോൾ ആദ്യമായി നിർമിച്ചത് 1825-ലായിരുന്നു. മൈക്കൽ ഫാരഡേ ആയിരുന്നു സ്രഷ്ടാവ്. സൾഫ്യൂറിക് ആസിഡിന് വലിയ അളവിൽ കോൾ ഗാസ് വലിച്ചെടുക്കാൻ സാധിക്കുമെന്ന് അദ്ദേഹം കണ്ടെത്തി.[7] ഇതിന്റെ ഫലമായുണ്ടായ ലായനി അദ്ദേഹം ഹെൻട്രി ഹെന്നെൽ എന്ന് ബ്രിട്ടീഷുകാരനായ രസതന്ത്രജ്ഞന് കൈമാറി. ഈ ലായനിയിൽ "സൾഫോവിനിക് ആസിഡ്" (ഈഥൈൽ ഹൈഡ്രജൻ സൾഫേറ്റ്) കലർന്നിട്ടുണ്ടെന്ന് അദ്ദേഹം കണ്ടെത്തി.[8] 1828-ൽ സൾഫോവിനിക് ആസിഡ് വിശ്ലേഷണം ചെയ്താൽ എഥനോൾ ലഭിക്കുമെന്ന് ഹെന്നെലും ഫ്രഞ്ച് രസതന്ത്രജ്ഞനായ ജോർജ്ജസ്-സൈമൺ സെറുല്ലാസും സ്വതന്ത്രമായി കണ്ടെത്തുകയുണ്ടായി. [9][10] 1825-ൽ എഥനോൾ എഥിലീനിൽ (കോൾ ഗാസിന്റെ ഒരു ഭാഗം) നിന്ന് ആസിഡ് രാസത്വരകമായി ഉപയോഗിച്ചുള്ള ഹൈഡ്രേഷനിലൂടെ സൃഷ്ടിക്കാനാവുമെന്ന് ഫാരഡേ കണ്ടെത്തുകയായിരുന്നു (അറിയാതെയായിരുന്നു ഈ കണ്ടുപിടിത്തമെങ്കിലും). ഇപ്പോൾ വ്യാവസായികാടിസ്ഥാനത്തിൽ എഥനോൾ നിർമ്മിക്കുന്നത് സമാനമായ ഒരു പ്രക്രീയയിലൂടെയാണ്. [11] 1840-കളിൽ തന്നെ എഥനോൾ അമേരിക്കൻ ഐക്യനാടുകളിൽ വിളക്കുകളിൽ ഇന്ധനമായി ഉപയോഗിച്ചിരുന്നു. അമേരിക്കൻ ആഭ്യന്തരയുദ്ധസമയത്ത് വ്യാവസായികാടിസ്ഥാനത്തിൽ എഥനോൾ ഉപയോഗിക്കുന്നതിന് നികുതി ഏർപ്പെടുത്തിയതുമൂലം ഇത് ലാഭകരമല്ലാതെയായി. ഈ നികുതി 1906-ൽ പിൻവലിക്കപ്പെട്ടു.[12] ആദ്യമിറങ്ങിയ ഫോർഡ് മോഡൽ ടി കാറുകൾ 1908 വരെ എഥനോളിലാണ് ഓടിയിരുന്നത്. [13] വർത്തമാനകാലത്ത് ലബോറട്ടറികളിലെ സ്പിരിറ്റ് ലാമ്പ് കത്തിക്കാൻ എഥനോൾ ഉപയോഗിക്കുന്നുണ്ട്. വ്യവസായ ആവശ്യങ്ങൾക്കായുള്ള എഥനോൾ എഥിലീനിൽ നിന്നാണ് നിർമ്മിക്കുന്നത്.[14] മരുന്നുകൾ, നിറങ്ങൾ, പെർഫ്യൂമുകൾ എന്നിങ്ങനെ മനുഷ്യരുപയോഗിക്കുന്ന പല വസ്തുക്കളും എഥനോളിൽ ലയിപ്പിച്ചാണ് വിപണിയിലെത്തിക്കുന്നത്. രസന്തന്ത്രത്തിൽ എഥനോൾ മറ്റുവസ്തുക്കൾ ലയിപ്പിക്കാനും മറ്റു പദാർത്ഥങ്ങൾ സൃഷ്ടിക്കാനും ഉപയോഗിക്കുന്നുണ്ട്. ചൂടും പ്രകാശവും കിട്ടാൻ എഥനോൾ കത്തിക്കുന്ന രീതിക്ക് നീണ്ട ചരിത്രമുണ്ടെങ്കിലും ആന്തരദഹനയന്ത്രങ്ങളിൽ ഇതിന്റെ ഉപയോഗം പ്രായേണ പുതിയതാണ്. ഭൗതിക ഗുണങ്ങൾ  ബാഷ്പശീലമുള്ളതും എളുപ്പം തീ പിടിക്കുന്നതും നിറമില്ലാത്തതുമായ ഒരു ദ്രാവകമാണ് എഥനോൾ. രാസ ഗുണങ്ങൾഅമ്ല-ക്ഷാര രസതന്ത്രംഹൈഡ്രോക്സിൽ ഗ്രൂപ്പിന്റ സാന്നിധ്യം മൂലം എഥനോൾ തന്മാത്ര ഭാഗികമായി ക്ഷാരഗുണം കാണിക്കുന്നു. 100% എഥനോളിൻറെ പിഎച്ച് മൂല്യം 7.33 ആണ്. ഹാലോജിനേഷൻഎഥനോൾ ഹൈഡ്രജൻ ഹാലൈഡുമായി പ്രവർത്തിച്ച് ഈഥൈൽ ഹാലൈഡുകൾ ഉണ്ടാവുന്നു: HCL പ്രവർത്തനത്തനം നടക്കണമെങ്കിൽ അഭികാരകങ്ങൾ ആവശ്യമാണ്[15]. എസ്റ്റർ രൂപവത്കരണംഎഥനോൾ കാർബോക്സിലിക് ആസിഡുമായി പ്രവർത്തിച്ച് ഈഥൈൽ എസ്റ്ററും വെള്ളവും ഉണ്ടാവുന്നു.
നിർജ്ജലീകരണം (ഡീഹൈഡ്രേഷൻ)സൾഫ്യൂരിക് ആസിഡ് പോലുള്ള ശക്തിയേറിയ നിർജ്ജലീകാരികളുമായി എഥനോൾ പ്രതിപ്രവർത്തിക്കുമ്പോൾ ഡീഹൈഡ്രേഷന് വിധേയമായി ഡൈഈഥൈൽ ഈഥറോ എഥിലീനോ ഉണ്ടാവുന്നു.
ഓക്സീകരണംഅസറ്റാൽഡിഹൈഡും അസെറ്റിക് ആസിഡും ഉപയോഗിച്ച് എഥനോളിനെ ഓക്സീകരിക്കാവുന്നതാണ്. മനുഷ്യ ശരീരത്തിൽ, ഓക്സീകരണ പ്രവർത്തനങ്ങളെല്ലാം കാറ്റലൈസ് ചെയ്യുന്നത് എൻസൈമുകളാണ്. ക്രോമിക് ആസിഡോ പൊട്ടാസ്യം പെർമാംഗനേറ്റോ പോലുള്ള ശക്തിയേറിയ ഓക്സീകാരികളുടെ അക്വസ് ലായനികൾ എഥനോളിനെ ഓക്സീകരിച്ച് അസെറ്റിക് ആസിഡാക്കി മാറ്റുന്നു. ഇതിനെ പിരിഡിനിയം ക്രോമിക് ക്ലോറൈഡുമായി പ്രവർത്തിപ്പിച്ചാൽ ഓക്സീകരിച്ച് അസറ്റാൽഡിഹൈഡായി മാറുന്നു[15]. ക്രോമിക് ആസിഡ് ഉപയോഗിച്ചുള്ള എഥനോളിന്റെ ഓക്സീകരണം താഴെപ്പറയുന്നു.
ക്ലോറിനേഷൻഎഥനോൾ ക്ലോറിനുമായി പ്രവർത്തിക്കുമ്പോൾ എഥനോളിലെ ഇരു വശത്തുമുള്ള ആൽഫാ കാർബൺ ക്ലോറിനുമായി ചേർന്ന് ക്ലോറാൾ എന്ന സംയുക്തം രൂപം കൊള്ളുന്നു.
ജ്വലനംഎഥനോൾ ജ്വലിച്ച് വെള്ളവും കാർബൺ ഡൈയോക്സൈഡും ഉണ്ടാവുന്നു.
നിർമ്മാണംഎഥിലീന്റെ ഹൈഡ്രേഷൻ വഴിയും യീസ്റ്റ് മുഖേന പഞ്ചസാര പുളിപ്പിക്കുന്നതിലൂടെയും എഥനോൾ നിർമ്മിക്കാം[17]. എഥിലീൻ ഹൈഡ്രേഷൻപുളിപ്പിക്കൽആൽക്കഹോളിക് ബീവറേജുകളിൽ എഥനോൾ ഉപയോഗിക്കുന്നു.യീസ്റ്റ് പഞ്ചസാരയെ മെറ്റബോളൈസ് ചെയ്ത് എഥനോളും കാർബൺ ഡൈയോക്സൈഡും ഉണ്ടാവുന്നു. അവലംബം
കൂടുതൽ വായനയ്ക്ക്
പുറത്തേയ്ക്കുള്ള കണ്ണികൾWikimedia Commons has media related to എഥനോൾ.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia