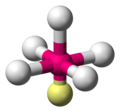
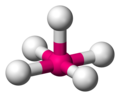
аҙөаҙҝ.аҙҺаҙёаөҚ.аҙҮ.аҙӘаҙҝ.аҙҶаөј аҙёаҙҝаҙҰаөҚаҙ§аҙҫаҙЁаөҚаҙӨаҙӮ аҙөаҙҝ.аҙҺаҙёаөҚ.аҙҮ.аҙӘаҙҝ.аҙҶаөј аҙёаҙҝаҙҰаөҚаҙ§аҙҫаҙЁаөҚаҙӨаҙӮ (Valence shell electron pair repulsion (VSEPR) theoryвҖҢ) аҙҺаҙЁаөҚаҙЁаҙӨаөҚ аҙ°аҙёаҙӨаҙЁаөҚаҙӨаөҚаҙ°аҙӨаөҚаҙӨаҙҝаөҪ аҙӨаҙЁаөҚаҙ®аҙҫаҙӨаөҚаҙ°аҙ•аҙіаөҒаҙҹаөҶ аҙ®аҙ§аөҚаҙҜаҙӨаөҚаҙӨаҙҝаҙІаөҒаҙіаөҚаҙі аҙ…аҙЈаөҒаҙ•аөҚаҙ•аҙіаөҶ аҙөаҙІаҙҜаҙӮ аҙҡаөҶаҙҜаөҚаҙӨаҙҝаҙ°аҙҝаҙ•аөҚаҙ•аөҒаҙЁаөҚаҙЁ аҙҮаҙІаҙ•аөҚаҙҹаөҚаҙ°аөӢаөә аҙңаөӢаҙЎаҙҝаҙ•аҙіаөҒаҙҹаөҶ аҙҺаҙЈаөҚаҙЈаҙӨаөҚаҙӨаҙҝаөҪ аҙЁаҙҝаҙЁаөҚаҙЁаөҚ аҙӨаҙЁаөҚаҙ®аҙҫаҙӨаөҚаҙ°аҙ•аҙіаөҒаҙҹаөҶ аҙңаөҚаҙҜаҙҫаҙ®аҙҝаҙӨаҙҝ аҙӘаөҚаҙ°аҙөаҙҡаҙҝаҙ•аөҚаҙ•аөҒаҙЁаөҚаҙЁаҙӨаҙҝаҙЁаөҚ аҙүаҙӘаҙҜаөӢаҙ—аҙҝаҙ•аөҚаҙ•аөҒаҙЁаөҚаҙЁ аҙ’аҙ°аөҒ аҙ®аҙҫаҙӨаөғаҙ•аҙҜаҙҫаҙЈаөҚ. [ 1] [ 2] [ 3]
аҙөаҙҝ.аҙҺаҙёаөҚ.аҙҮ.аҙӘаҙҝ.аҙҶаөј аҙ…аҙЁаөҒаҙёаҙ°аҙҝаҙҡаөҚаҙҡаөҚ аҙ’аҙ°аөҒ аҙҶаҙұаөҚаҙұаҙӨаөҚаҙӨаөҶ аҙөаҙІаҙҜаҙӮ аҙҡаөҶаҙҜаөҚаҙӨаҙҝаҙ°аҙҝаҙ•аөҚаҙ•аөҒаҙЁаөҚаҙЁ аҙ¬аҙҫаҙ№аөҚаҙҜаҙӨаҙ® аҙҮаҙІаҙ•аөҚаҙҹаөҚаҙ°аөӢаөә аҙңаөӢаҙЎаҙҝаҙ•аөҫ аҙӨаҙ®аөҚаҙ®аҙҝаөҪ аҙөаҙҝаҙ•аөјаҙ·аҙҝаҙ•аөҚаҙ•аҙҫаҙЁаөҒаҙіаөҚаҙі аҙ’аҙ°аөҒ аҙӘаөҚаҙ°аҙөаҙЈаҙӨ аҙ•аҙҫаҙЈаҙҝаҙ•аөҚаҙ•аөҒаҙЁаөҚаҙЁаөҒ. аҙ…аҙө аҙөаҙҝаҙ•аөјаҙ·аҙЈаҙӮ аҙ•аөҒаҙұаҙҜаөҚаҙ•аөҚаҙ•аөҒаҙЁаөҚаҙЁ аҙӨаҙ°аҙӮ аҙ•аөҚаҙ°аҙ®аөҖаҙ•аҙ°аҙЈаҙӨаөҚаҙӨаҙҝаөҪ аҙҺаҙӨаөҚаҙӨаөҒаҙЁаөҚаҙЁаөҒ. аҙҮаҙҷаөҚаҙҷаҙЁаөҶ аҙ…аҙөаҙҜаөҒаҙҹаөҶ аҙӨаҙЁаөҚаҙ®аҙҫаҙӨаөҚаҙ°аҙҫаҙңаөҚаҙҜаҙҫаҙ®аҙҝаҙӨаҙҝ аҙЁаҙҝаөјаҙЈаөҚаҙЈаҙҜаҙҝаҙ•аөҚаҙ•аҙҫаҙӮ. Gillespie аҙҜаөҒаҙҹаөҶ аҙөаҙҫаҙҰаҙ®аҙЁаөҒаҙёаҙ°аҙҝаҙҡаөҚаҙҡаөҚ, аҙӨаҙЁаөҚаҙ®аҙҫаҙӨаөҚаҙ°аҙҫаҙңаөҚаҙҜаҙҫаҙ®аҙҝаҙӨаҙҝ аҙЁаҙҝаөјаҙЈаөҚаҙЈаҙҜаҙҝаҙ•аөҚаҙ•аҙҫаҙЁаҙҫаҙҜаҙҝ аҙҮаҙІаҙ•аөҚаҙҹаөҚаҙ°аөҠаҙёаөҚаҙұаөҚаҙұаҙҫаҙұаөҚаҙұаҙҝаҙ•аөҚ аҙөаҙҝаҙ•аөјаҙ·аҙЈаҙӨаөҚаҙӨаөҮаҙ•аөҚаҙ•аҙҫаөҫ аҙӘаөӢаҙіаҙҝ аҙҺаҙ•аөҚаҙёаөҚаҙ•аөҚаҙІаөӮаҙ·аө» аҙӨаҙӨаөҚаҙӨаөҚаҙөаҙ®аҙЁаөҒаҙёаҙ°аҙҝаҙҡаөҚаҙҡаөҒаҙіаөҚаҙі аҙҮаҙІаҙ•аөҚаҙҹаөҚаҙ°аөӢаҙЈаөҒаҙӮ аҙҮаҙІаҙ•аөҚаҙҹаөҚаҙ°аөӢаҙЈаөҒаҙ®аҙҫаҙҜаөҒаҙіаөҚаҙі аҙөаҙҝаҙ•аөјаҙ·аҙЈаҙӮ аҙ•аөӮаҙҹаөҒаҙӨаөҪ аҙӘаөҚаҙ°аҙ§аҙҫаҙЁаҙ®аҙҫаҙЈаөҚ.[ 4]
[ 5] [ 4]
аҙӨаҙЁаөҚаҙ®аҙҫаҙӨаөҚаҙ°аҙ•аҙіаҙҝаҙІаөҶ аҙ№аөҲаҙЎаөҚаҙ°аҙңаҙЁаҙІаөҚаҙІаҙҫаҙӨаөҚаҙӨ аҙ…аҙЈаөҒаҙ•аөҚаҙ•аөҫаҙ•аөҚаҙ•аөҒ аҙҡаөҒаҙұаөҚаҙұаөҒаҙ®аөҒаҙіаөҚаҙі аҙҮаҙІаҙ•аөҚаҙҹаөҚаҙ°аөӢаөә аҙңаөӢаҙЎаҙҝаҙ•аҙіаөҒаҙҹаөҶ аҙ•аөҚаҙ°аҙ®аөҖаҙ•аҙ°аҙЈаҙӮ аҙӘаөҚаҙ°аҙөаҙҡаҙҝаҙ•аөҚаҙ•аҙҫаҙЁаҙҫаҙЈаөҚ аҙөаҙҝ.аҙҺаҙёаөҚ.аҙҮ.аҙӘаҙҝ.аҙҶаөј аҙёаҙҝаҙҰаөҚаҙ§аҙҫаҙЁаөҚаҙӨаҙӮ аҙүаҙӘаҙҜаөӢаҙ—аҙҝаҙ•аөҚаҙ•аөҒаҙЁаөҚаҙЁаҙӨаөҚ.
аҙӨаҙЁаөҚаҙ®аҙҫаҙӨаөҚаҙ°аҙҜаөҒаҙҹаөҶ Lewis structure аҙөаҙ°аҙҡаөҚаҙҡаөҚ, аҙ¬аҙЁаөҚаҙ§аҙҝаҙ•аөҚаҙ•аҙӘаөҚаҙӘаөҶаҙҹаөҚаҙҹаҙөаҙҜаөҒаҙӮ аҙ’аҙұаөҚаҙұаҙҜаөҚаҙ•аөҚаҙ•аөҒ аҙЁаҙҝаөҪаҙ•аөҚаҙ•аөҒаҙЁаөҚаҙЁаҙӨаөҒаҙ®аҙҫаҙҜ аҙҮаҙІаҙ•аөҚаҙҹаөҚаҙ°аөӢаҙЈаөҒаҙ•аҙіаөҒаҙҹаөҶ аҙңаөӢаҙЎаҙҝаҙ•аөҫ аҙӘаөҚаҙ°аҙҰаөјаҙ¶аҙҝаҙӘаөҚаҙӘаҙҝаҙ•аөҚаҙ•аөҒаҙӮ аҙөаҙҝаҙ§аҙӮ аҙҮаҙӨаҙҝаҙЁаөҶ аҙөаҙҝаҙ•аҙёаҙҝаҙӘаөҚаҙӘаҙҝаҙҡаөҚаҙҡаөҚ аҙ®аҙ§аөҚаҙҜаҙӨаөҚаҙӨаҙҝаҙІаөҒаҙіаөҚаҙі аҙ’аҙ°аөҒ аҙҶаҙұаөҚаҙұаҙӨаөҚаҙӨаҙҝаҙЁаөҚаҙұаөҶ аҙ¬аҙҫаҙ№аөҚаҙҜаҙӨаҙ® аҙ·аөҶаҙІаөҚаҙІаҙҝаҙІаөҶ аҙҮаҙІаҙ•аөҚаҙҹаөҚаҙ°аөӢаөә аҙңаөӢаҙЎаҙҝаҙ•аҙіаөҒаҙҹаөҶ аҙҺаҙЈаөҚаҙЈаҙӮ аҙЁаҙҝаөјаҙЈаөҚаҙЈаҙҜаҙҝаҙ•аөҚаҙ•аҙҫаҙӮ.[ 6] [ 6]
аҙөаҙҝ.аҙҺаҙёаөҚ.аҙҮ.аҙӘаҙҝ.аҙҶаөј аҙӨаҙӨаөҚаҙӨаөҚаҙөаҙӮ аҙүаҙӘаҙҜаөӢаҙ—аҙҝаҙ•аөҚаҙ•аөҒаҙ®аөҚаҙӘаөӢаөҫ AXE аҙ°аөҖаҙӨаҙҝаҙҜаҙҝаҙІаөҒаҙіаөҚаҙі аҙҮаҙІаҙ•аөҚаҙҹаөҚаҙ°аөӢаөә аҙҺаҙЈаөҚаҙЈаөҪ аҙ°аөҖаҙӨаҙҝ аҙёаҙҫаҙ§аҙҫаҙ°аҙЈаҙҜаөҒаҙӘаҙҜаөӢаҙ—аҙҝаҙ•аөҚаҙ•аөҒаҙЁаөҚаҙЁаөҒ.
Molecule Type
Shape[ 7]
Electron arrangementвҖ [ 7]
GeometryвҖЎ [ 7]
Examples
AX2 E0
Linear
BeCl2 ,[ 1] HgCl2 ,[ 1] CO2 [ 8]
AX2 E1
Bent
NOвҲ’ 2 [ 1] SO2 ,[ 7] O3 ,[ 1] CCl2
AX2 E2
Bent
H2 O ,[ 7] OF2 [ 13]
AX2 E3
Linear
XeF2 ,[ 7] IвҲ’ 3 [ 14] XeCl2
AX3 E0
Trigonal planar
BF3 ,[ 7] CO2вҲ’ 3 [ 15] NOвҲ’ 3 [ 1] SO3 [ 8]
AX3 E1
Trigonal pyramidal
NH3 ,[ 7] PCl3 [ 16]
AX3 E2
T-shaped
ClF3 ,[ 7] BrF3 [ 17]
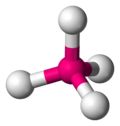
AX4 E0
Tetrahedral
CH4 ,[ 7] PO3вҲ’ 4 SO2вҲ’ 4 [ 8] ClOвҲ’ 4 [ 1] XeO4 [ 18]
AX4 E1
Seesaw (also called disphenoidal )
SF4 [ 7] [ 19]
AX4 E2
Square planar
XeF4 [ 7]
AX5 E0
Trigonal bipyramidal
PCl5 [ 7]
AX5 E1
Square pyramidal
ClF5 ,[ 17] BrF5 ,[ 7] XeOF4 [ 8]
AX5 E2
Pentagonal planar
XeFвҲ’ 5 [ 10]
AX6 E0
Octahedral
SF6 ,[ 7] WCl6 [ 20]
AX6 E1
Pentagonal pyramidal
XeOFвҲ’ 5 ,[ 9] IOF2вҲ’ 5 [ 9]
AX7 E0
Pentagonal bipyramidal [ 8] IF7 [ 8]
AX8 E0
Square antiprismatic [ 8] IFвҲ’ 8 , ZrF4вҲ’ 8 , ReFвҲ’ 8
AX9 E0
Tricapped trigonal prismatic (as drawn) capped square antiprismatic
ReH2вҲ’ 9 [ 11]
вҖ Electron arrangement including lone pairs, shown in pale yellow вҖЎ Observed geometry (excluding lone pairs)
вҶ‘ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 Jolly, W. L.,Modern Inorganic Chemistry, McGraw-Hill, 1984, p.77-90. ISBN 0-07-032760-2
вҶ‘ Petrucci R.H., Harwood W.S. and Herring F.G. General Chemistry: Principles and Modern Applications (Prentice-Hall 8th ed. 2002) p.410 ISBN 0-13-014329-4
вҶ‘ H. Stephen Stoker (2009). General, Organic, and Biological Chemistry . Cengage Learning. p. 119. ISBN 978-0-547-15281-3 вҶ‘ 4.0 4.1 R.J. Gillespie (2008), Coordination Chemistry Reviews vol.252, pp.1315-1327, Fifty years of the VSEPR model
вҶ‘ Gillespie, R.J. (2004), "Teaching molecular geometry with the VSEPR model", Journal of Chemical Education , 81 (3): 298вҖ“ 304, Bibcode :2004JChEd..81..298G , doi :10.1021/ed081p298 вҶ‘ 6.0 6.1 R.H. Petrucci, W.S. Harwood and F.G. Herring, General Chemistry (8th ed., Prentice-Hall 2002) pp.410-417. ISBN 0-13-014329-4
вҶ‘ 7.00 7.01 7.02 7.03 7.04 7.05 7.06 7.07 7.08 7.09 7.10 7.11 7.12 7.13 7.14 7.15 7.16 7.17 7.18 Steric numbers 2-6 from R.H. Petrucci, W.S. Harwood and F.G. Herring, General Chemistry (8th ed., Prentice-Hall 2002) Table 11.1, pp.413-414. ISBN 0-13-014329-4
вҶ‘ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 8.7 8.8 G.L. Miessler and D.A. Tarr, Inorganic Chemistry (2nd ed., Prentice-Hall 1999) pp.54-62. ISBN 0-13-841891-8
вҶ‘ 9.0 9.1 9.2 Baran, E. (2000). "Mean amplitudes of vibration of the pentagonal pyramidal XeOF5 вҲ’ and IOF5 2вҲ’ anions". Journal of Fluorine Chemistry . 101 : 61вҖ“ 63. doi :10.1016/S0022-1139(99)00194-3 . вҶ‘ 10.0 10.1 аҙүаҙҰаөҚаҙ§аҙ°аҙҝаҙҡаөҚаҙҡаҙӨаҙҝаөҪ аҙӘаҙҝаҙҙаҙөаөҚ: аҙ…аҙёаҙҫаҙ§аөҒаҙөаҙҫаҙҜ <ref> аҙҹаҙҫаҙ—аөҚ;
House498 аҙҺаҙЁаөҚаҙЁ аҙӘаөҮаҙ°аҙҝаҙІаөҶ аҙ…аҙөаҙІаҙӮаҙ¬аҙҷаөҚаҙҷаөҫаҙ•аөҚаҙ•аөҚ аҙҺаҙҙаөҒаҙӨаөҚаҙӨаөҠаҙЁаөҚаҙЁаөҒаҙӮ аҙЁаөҪаҙ•аҙҝаҙҜаҙҝаҙҹаөҚаҙҹаҙҝаҙІаөҚаҙІ.
вҶ‘ 11.0 11.1 аҙүаҙҰаөҚаҙ§аҙ°аҙҝаҙҡаөҚаҙҡаҙӨаҙҝаөҪ аҙӘаҙҝаҙҙаҙөаөҚ: аҙ…аҙёаҙҫаҙ§аөҒаҙөаҙҫаҙҜ <ref> аҙҹаҙҫаҙ—аөҚ;
House254 аҙҺаҙЁаөҚаҙЁ аҙӘаөҮаҙ°аҙҝаҙІаөҶ аҙ…аҙөаҙІаҙӮаҙ¬аҙҷаөҚаҙҷаөҫаҙ•аөҚаҙ•аөҚ аҙҺаҙҙаөҒаҙӨаөҚаҙӨаөҠаҙЁаөҚаҙЁаөҒаҙӮ аҙЁаөҪаҙ•аҙҝаҙҜаҙҝаҙҹаөҚаҙҹаҙҝаҙІаөҚаҙІ.
вҶ‘ 12.0 12.1 12.2 12.3 аҙүаҙҰаөҚаҙ§аҙ°аҙҝаҙҡаөҚаҙҡаҙӨаҙҝаөҪ аҙӘаҙҝаҙҙаҙөаөҚ: аҙ…аҙёаҙҫаҙ§аөҒаҙөаҙҫаҙҜ <ref> аҙҹаҙҫаҙ—аөҚ;
stericnoover9 аҙҺаҙЁаөҚаҙЁ аҙӘаөҮаҙ°аҙҝаҙІаөҶ аҙ…аҙөаҙІаҙӮаҙ¬аҙҷаөҚаҙҷаөҫаҙ•аөҚаҙ•аөҚ аҙҺаҙҙаөҒаҙӨаөҚаҙӨаөҠаҙЁаөҚаҙЁаөҒаҙӮ аҙЁаөҪаҙ•аҙҝаҙҜаҙҝаҙҹаөҚаҙҹаҙҝаҙІаөҚаҙІ.
вҶ‘ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2 ), p.448
вҶ‘ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2 ), p.483
вҶ‘ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2 ), p.368
вҶ‘ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2 ), p.407
вҶ‘ 17.0 17.1 Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2 ), p.481
вҶ‘ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2 ), p.499
вҶ‘ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2 ), p.45. This source uses the name disphenoidal .
вҶ‘ Housecroft, C.E. and Sharpe A.G. "Inorganic Chemistry" (2nd edn, Pearson 2005. ISBN 0130-39913-2 ), p.659
Chemistry: Foundations and Applications . J. J. Lagowski, ed. New York: Macmillan, 2004. ISBN 0-02-865721-7 . Volume 3, pages 99вҖ“104.
аҙөаҙҝаҙ•аөҚаҙ•аҙҝаҙӘаҙҫаҙ аҙ¶аҙҫаҙІ 3D Chem - Chemistry, Structures, and 3D MoleculesIUMSC - Indiana University Molecular Structure Center