Ионное произведение водыИо́нное произведе́ние воды́ KW (константа автопротолиза воды) — произведение концентраций ионов водорода Н+ и гидроксид-ионов OH− в воде или в водных растворах. При 20 - 25 °C константа диссоциации воды равна 1,8⋅10−16моль/л (pKd=15,74). Откуда ионное произведение воды KW = 10−14моль²/л²  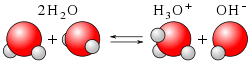 Вывод значения ионного произведения водыВода является слабым амфолитом (может быть донором и акцептором ), слабо диссоциирует.
(однако на самом деле в реакции участвуют 2 молекулы воды ) Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле: где:
Концентрация молекул воды, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л. При 20–25 °C константа диссоциации воды равна 1,8⋅10−16моль/л. Так как вода является слабым электролитом (амфолитом), можно записать для неё константу диссоциации непосредственно из диссоциации воды Обозначим произведение K·[H2O] = Kв = 1,8⋅10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C). Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот. Зависимость pKw от температуры
Эти данные можно аппроксимировать параболой (смотри на графике) pKw = 14.92 − 0.03992T + 0.00013122T2 или кубической параболой (что точнее) pKw = 14.94355 - 0.0429299 * T + 0.00021447938* T^2 - 5.6625156*10^(-7) * T^3
Практическое значение ионного произведения водыПрактическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH) и гидроксильным показателем (pOH). Так как Kв — константа, при добавлении к раствору кислоты (ионов H+), концентрация гидроксид-ионов OH− будет падать, и наоборот. В нейтральной среде [H+] = [OH−] = моль/л. При концентрации [H+] > 10−7 моль/л (соответственно, концентрации [OH−] < 10−7 моль/л) среда будет кислой; При концентрации [OH−] > 10−7 моль/л (соответственно, концентрации [H+] < 10−7 моль/л) — щелочной. Ионные произведения других растворителейИонное произведение можно рассчитать не только для воды. Ионное произведение воды является лишь одной (хотя практически наиболее важной) из констант автопротолиза. См. такжеПримечания
Ссылки
|
Portal di Ensiklopedia Dunia
![{\displaystyle {\mathsf {K_{W}=\left[H^{+}\right]\left[OH^{-}\right]=10^{-14}(mol/L)^{2}\ \ }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/86c9ad2bca31682f8b2e5b70534ab21f559d22b9)


![{\displaystyle {\mathsf {K={\frac {\left[H^{+}\right]\left[OH^{-}\right]}{\left[H_{2}O\right]}}}}\ \ \ (1)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/53a8ad0063d4e18041c8addd0dc58752fcbaa2df)
![{\displaystyle {\mathsf {K\left[H_{2}O\right]=\left[H^{+}\right]\left[OH^{-}\right]\ \ }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5af59dc7c6c31162a6aeb9b799091c1e30d74b76)


















