–Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞  –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ ‚Äî —Ñ–µ—Ä–º–µ–Ω—Ç, –æ—Å—É—â–µ—Å—Ç–≤–ª—è—é—â–∏–π —Å–∏–Ω—Ç–µ–∑ –º–æ–ª–µ–∫—É–ª –Ý–ù–ö. –í —É–∑–∫–æ–º —Å–º—ã—Å–ª–µ, –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–æ–π –æ–±—ã—á–Ω–æ –Ω–∞–∑—ã–≤–∞—é—Ç –î–ù–ö-–∑–∞–≤–∏—Å–∏–º—ã–µ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã, –æ—Å—É—â–µ—Å—Ç–≤–ª—è—é—â–∏–µ —Å–∏–Ω—Ç–µ–∑ –º–æ–ª–µ–∫—É–ª –Ý–ù–ö –Ω–∞ –º–∞—Ç—Ä–∏—Ü–µ –î–ù–ö, —Ç–æ –µ—Å—Ç—å –æ—Å—É—â–µ—Å—Ç–≤–ª—è—é—â–∏–µ —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏—é. –§–µ—Ä–º–µ–Ω—Ç—ã –∫–ª–∞—Å—Å–∞ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑ –æ—á–µ–Ω—å –≤–∞–∂–Ω—ã –¥–ª—è —Ñ—É–Ω–∫—Ü–∏–æ–Ω–∏—Ä–æ–≤–∞–Ω–∏—è –∫–ª–µ—Ç–∫–∏, –ø–æ—ç—Ç–æ–º—É –æ–Ω–∏ –∏–º–µ—é—Ç—Å—è –≤–æ –≤—Å–µ—Ö –æ—Ä–≥–∞–Ω–∏–∑–º–∞—Ö –∏ –≤–æ –º–Ω–æ–≥–∏—Ö –≤–∏—Ä—É—Å–∞—Ö. –•–∏–º–∏—á–µ—Å–∫–∏ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã —è–≤–ª—è—é—Ç—Å—è –Ω—É–∫–ª–µ–æ—Ç–∏–¥–∏–ª-—Ç—Ä–∞–Ω—Å—Ñ–µ—Ä–∞–∑–∞–º–∏, –ø–æ–ª–∏–º–µ—Ä–∏–∑—É—é—â–∏–º–∏ —Ä–∏–±–æ–Ω—É–∫–ª–µ–æ—Ç–∏–¥—ã –Ω–∞ 3'-–∫–æ–Ω—Ü–µ —Ü–µ–ø–∏ –Ý–ù–ö. –ò—Å—Ç–æ—Ä–∏—è –∏–∑—É—á–µ–Ω–∏—è–Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –±—ã–ª–∞ –æ—Ç–∫—Ä—ã—Ç–∞ –Ω–µ–∑–∞–≤–∏—Å–∏–º–æ –î–∂–µ—Ä–∞–ª—å–¥–æ–º –ì—É—Ä–≤–∏—Ü–µ–º[–∞–Ω–≥–ª.], –°—ç–º–æ–º –í–∞–π—Å–æ–º, –û–¥—Ä–∏ –°—Ç–∏–≤–µ–Ω—Å[–∞–Ω–≥–ª.] –∏ –î–∂–µ–π–º—Å–æ–º –ë–æ–Ω–Ω–µ—Ä–æ–º[–∞–Ω–≥–ª.] –≤ 1960 –≥–æ–¥—É[1][2]. –ü—Ä–∏ —ç—Ç–æ–º –ù–æ–±–µ–ª–µ–≤—Å–∫–∞—è –ø—Ä–µ–º–∏—è –ø–æ —Ñ–∏–∑–∏–æ–ª–æ–≥–∏–∏ –∏–ª–∏ –º–µ–¥–∏—Ü–∏–Ω–µ 1959 –≥–æ–¥–∞ –±—ã–ª–∞ –ø—Ä–∏—Å—É–∂–¥–µ–Ω–∞ –°–µ–≤–µ—Ä–æ –û—Ö–æ–∞ –∏ –ê—Ä—Ç—É—Ä—É –ö–æ—Ä–Ω–±–µ—Ä–≥—É ¬´–∑–∞ –æ—Ç–∫—Ä—ã—Ç–∏–µ –º–µ—Ö–∞–Ω–∏–∑–º–æ–≤ –±–∏–æ—Å–∏–Ω—Ç–µ–∑–∞ –Ý–ù–ö –∏ –î–ù–ö¬ª[3]. –û—Ö–æ–∞ –∏ –ö–æ—Ä–Ω–±–µ—Ä–≥ –æ—Ç–∫—Ä—ã—Ç–ª–∏ –ø–æ–ª–∏–Ω—É–∫–ª–µ–æ—Ç–∏–¥—Ñ–æ—Å—Ñ–æ—Ä–∏–ª–∞–∑—É[–∞–Ω–≥–ª.], –∫–æ—Ç–æ—Ä–∞—è —Å—á–∏—Ç–∞–ª–∞—Å—å –∫–∞—Ç–∞–ª–∏–∑–∏—Ä—É—é—â–µ–π —Å–∏–Ω—Ç–µ–∑ –Ý–ù–ö. –í–ø–æ—Å–ª–µ–¥—Å—Ç–≤–∏–∏ –±—ã–ª–æ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–æ, —á—Ç–æ —ç—Ç–æ—Ç —Ñ–µ—Ä–º–µ–Ω—Ç —è–≤–ª—è–µ—Ç—Å—è —Ä–∏–±–æ–Ω—É–∫–ª–µ–∞–∑–æ–π, —Ç–æ –µ—Å—Ç—å –µ–≥–æ —Ñ—É–Ω–∫—Ü–∏–µ–π —è–≤–ª—è–µ—Ç—Å—è –¥–µ–≥—Ä–∞–¥–∞—Ü–∏—è –Ý–ù–ö, –∞ –Ω–µ —Å–∏–Ω—Ç–µ–∑ –Ý–ù–ö, –Ω–µ—Å–º–æ—Ç—Ä—è –Ω–∞ —Ç–æ, —á—Ç–æ –æ–Ω –∑–∞–ø—É—Å–∫–∞–µ—Ç —Å–≤–æ—é –µ—Å—Ç–µ—Å—Ç–≤–µ–Ω–Ω—É—é —Ä–µ–∞–∫—Ü–∏—é –≤ –æ–±—Ä–∞—Ç–Ω–æ–º –Ω–∞–ø—Ä–∞–≤–ª–µ–Ω–∏–∏ in vitro[2]. –ù–æ–±–µ–ª–µ–≤—Å–∫–∞—è –ø—Ä–µ–º–∏—è –ø–æ —Ö–∏–º–∏–∏ –≤ 2006 –≥–æ–¥—É –±—ã–ª–∞ –ø—Ä–∏—Å—É–∂–¥–µ–Ω–∞ –Ý–æ–¥–∂–µ—Ä—É –ö–æ—Ä–Ω–±–µ—Ä–≥—É –∑–∞ –ø–æ–ª—É—á–µ–Ω–∏–µ —Ç–æ—á–Ω—ã—Ö –∏–∑–æ–±—Ä–∞–∂–µ–Ω–∏–π –º–æ–ª–µ–∫—É–ª –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã –≤ —Ä–∞–∑–ª–∏—á–Ω—ã–µ –º–æ–º–µ–Ω—Ç—ã –ø—Ä–æ—Ü–µ—Å—Å–∞ —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–∏[4]. –£–ø—Ä–∞–≤–ª–µ–Ω–∏–µ —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–µ–π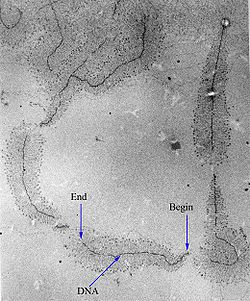 –£–ø—Ä–∞–≤–ª–µ–Ω–∏–µ –ø—Ä–æ—Ü–µ—Å—Å–æ–º —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–∏ –≥–µ–Ω–æ–≤ –ø–æ–∑–≤–æ–ª—è–µ—Ç –∫–æ–Ω—Ç—Ä–æ–ª–∏—Ä–æ–≤–∞—Ç—å —ç–∫—Å–ø—Ä–µ—Å—Å–∏—é –≥–µ–Ω–æ–≤ –∏ —Ç–∞–∫–∏–º –æ–±—Ä–∞–∑–æ–º –ø–æ–∑–≤–æ–ª—è–µ—Ç –∫–ª–µ—Ç–∫–µ –∞–¥–∞–ø—Ç–∏—Ä–æ–≤–∞—Ç—å—Å—è –∫ –∏–∑–º–µ–Ω—è—é—â–∏–º—Å—è —É—Å–ª–æ–≤–∏—è–º –≤–Ω–µ—à–Ω–µ–π —Å—Ä–µ–¥—ã, –ø–æ–¥–¥–µ—Ä–∂–∏–≤–∞—Ç—å –º–µ—Ç–∞–±–æ–ª–∏—á–µ—Å–∫–∏–µ –ø—Ä–æ—Ü–µ—Å—Å—ã –Ω–∞ –¥–æ–ª–∂–Ω–æ–º —É—Ä–æ–≤–Ω–µ, –∞ —Ç–∞–∫–∂–µ –≤—ã–ø–æ–ª–Ω—è—Ç—å —Å–ø–µ—Ü–∏—Ñ–∏—á–µ—Å–∫–∏–µ —Ñ—É–Ω–∫—Ü–∏–∏, –Ω–µ–æ–±—Ö–æ–¥–∏–º—ã–µ –¥–ª—è —Å—É—â–µ—Å—Ç–≤–æ–≤–∞–Ω–∏—è –æ—Ä–≥–∞–Ω–∏–∑–º–∞. –ù–µ—É–¥–∏–≤–∏—Ç–µ–ª—å–Ω–æ, —á—Ç–æ –¥–µ–π—Å—Ç–≤–∏–µ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã –æ—á–µ–Ω—å —Å–ª–æ–∂–Ω–æ –∏ –∑–∞–≤–∏—Å–∏—Ç –æ—Ç –º–Ω–æ–∂–µ—Å—Ç–≤–∞ —Ñ–∞–∫—Ç–æ—Ä–æ–≤ (—Ç–∞–∫, —É Escherichia coli –∏–¥–µ–Ω—Ç–∏—Ñ–∏—Ü–∏—Ä–æ–≤–∞–Ω–æ –±–æ–ª–µ–µ 100 —Ñ–∞–∫—Ç–æ—Ä–æ–≤, —Ç–µ–º –∏–ª–∏ –∏–Ω—ã–º —Å–ø–æ—Å–æ–±–æ–º –≤–ª–∏—è—é—â–∏—Ö –Ω–∞ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—É[5]). –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –Ω–∞—á–∏–Ω–∞–µ—Ç —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏—é —Å –æ—Å–æ–±—ã—Ö —É—á–∞—Å—Ç–∫–æ–≤ –î–ù–ö, –Ω–∞–∑—ã–≤–∞–µ–º—ã—Ö –ø—Ä–æ–º–æ—Ç–æ—Ä–∞–º–∏ –∏ –ø—Ä–æ–∏–∑–≤–æ–¥–∏—Ç —Ü–µ–ø–æ—á–∫—É –Ý–ù–ö, –∫–æ–º–ø–ª–µ–º–µ–Ω—Ç–∞—Ä–Ω—É—é —Å–æ–æ—Ç–≤–µ—Ç—Å—Ç–≤—É—é—â–µ–π —á–∞—Å—Ç–∏ –Ω–∏—Ç–∏ –î–ù–ö. –ü—Ä–æ—Ü–µ—Å—Å –Ω–∞—Ä–∞—â–∏–≤–∞–Ω–∏—è –º–æ–ª–µ–∫—É–ª—ã –Ý–ù–ö –Ω—É–∫–ª–µ–æ—Ç–∏–¥–∞–º–∏ –Ω–∞–∑—ã–≤–∞–µ—Ç—Å—è —ç–ª–æ–Ω–≥–∞—Ü–∏–µ–π. –í —ç—É–∫–∞—Ä–∏–æ—Ç–∏—á–µ—Å–∫–∏—Ö –∫–ª–µ—Ç–∫–∞—Ö –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –º–æ–∂–µ—Ç —Å–æ–±–∏—Ä–∞—Ç—å —Ü–µ–ø–æ—á–∫–∏ –∏–∑ –±–æ–ª–µ–µ 2,4 –º–ª–Ω —ç–ª–µ–º–µ–Ω—Ç–æ–≤ (–Ω–∞–ø—Ä–∏–º–µ—Ä, —Ç–∞–∫—É—é –¥–ª–∏–Ω—É –∏–º–µ–µ—Ç –ø–æ–ª–Ω—ã–π –≥–µ–Ω –±–µ–ª–∫–∞ –¥–∏—Å—Ç—Ä–æ—Ñ–∏–Ω–∞). –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –∑–∞–≤–µ—Ä—à–∞–µ—Ç —Ñ–æ—Ä–º–∏—Ä–æ–≤–∞–Ω–∏–µ —Ü–µ–ø–æ—á–∫–∏ –Ý–ù–ö, –∫–æ–≥–¥–∞ –≤—Å—Ç—Ä–µ—á–∞–µ—Ç –≤ –î–ù–ö —Å–ø–µ—Ü–∏—Ñ–∏—á–µ—Å–∫—É—é –ø–æ—Å–ª–µ–¥–æ–≤–∞—Ç–µ–ª—å–Ω–æ—Å—Ç—å, –Ω–∞–∑—ã–≤–∞–µ–º—É—é —Ç–µ—Ä–º–∏–Ω–∞—Ç–æ—Ä–æ–º. –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –ø—Ä–æ–∏–∑–≤–æ–¥–∏—Ç —Å–ª–µ–¥—É—é—â–∏–µ —Ä–∞–∑–Ω–æ–≤–∏–¥–Ω–æ—Å—Ç–∏ –Ý–ù–ö:
–Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –æ—Å—É—â–µ—Å—Ç–≤–ª—è–µ—Ç —Å–∏–Ω—Ç–µ–∑ —Å –Ω—É–ª—è. –≠—Ç–æ –≤–æ–∑–º–æ–∂–Ω–æ –≤—Å–ª–µ–¥—Å—Ç–≤–∏–µ —Ç–æ–≥–æ, —á—Ç–æ –≤–∑–∞–∏–º–æ–¥–µ–π—Å—Ç–≤–∏–µ –Ω–∞—á–∞–ª—å–Ω–æ–≥–æ –Ω—É–∫–ª–µ–æ—Ç–∏–¥–∞ –≥–µ–Ω–∞ –∏ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã –ø–æ–∑–≤–æ–ª—è–µ—Ç –µ–π –∑–∞–∫—Ä–µ–ø–∏—Ç—å—Å—è –Ω–∞ —Ü–µ–ø–æ—á–∫–µ –∏ –æ–±—Ä–∞–±–∞—Ç—ã–≤–∞—Ç—å —Å–ª–µ–¥—É—é—â–∏–µ –Ω—É–∫–ª–µ–æ—Ç–∏–¥—ã. –≠—Ç–æ –æ—Ç—á–∞—Å—Ç–∏ –æ–±—ä—è—Å–Ω—è–µ—Ç, –ø–æ—á–µ–º—É –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –æ–±—ã—á–Ω–æ –Ω–∞—á–∏–Ω–∞–µ—Ç —Ç—Ä–∞–Ω–∫—Å—Ä–∏–ø—Ü–∏—é —Å –ê–¢–§, –∑–∞ –∫–æ—Ç–æ—Ä—ã–º —Å–ª–µ–¥—É–µ—Ç –ì–¢–§, –£–¢–§ –∏ –∑–∞—Ç–µ–º –¶–¢–§. –í –æ—Ç–ª–∏—á–∏–µ –æ—Ç –î–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –æ–±–ª–∞–¥–∞–µ—Ç —Ç–∞–∫–∂–µ –≥–µ–ª–∏–∫–∞–∑–Ω—ã–º –¥–µ–π—Å—Ç–≤–∏–µ–º. –î–µ–π—Å—Ç–≤–∏–µ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã–°–≤—è–∑—ã–≤–∞–Ω–∏–µ –∏ –∏–Ω–∏—Ü–∏–∏—Ä–æ–≤–∞–Ω–∏–µ —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–∏ –í —Å–≤—è–∑—ã–≤–∞–Ω–∏–∏ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã —É—á–∞—Å—Ç–≤—É–µ—Ç Œ±-—Å—É–±—ä–µ–¥–∏–Ω–∏—Ü–∞, —Ä–∞—Å–ø–æ–∑–Ω–∞—é—â–∞—è —ç–ª–µ–º–µ–Ω—Ç –î–ù–ö, –ø—Ä–µ–¥—à–µ—Å—Ç–≤—É—é—â–∏–π –≥–µ–Ω—É (-40‚Ķ-70 —à–∞–≥–æ–≤), –∏ œÉ-—Ñ–∞–∫—Ç–æ—Ä, —Ä–∞—Å–ø–æ–∑–Ω–∞—é—â–∏–π —É—á–∞—Å—Ç–æ–∫ ‚àí10‚Ķ-35. –°—É—â–µ—Å—Ç–≤—É–µ—Ç –±–æ–ª—å—à–æ–µ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ œÉ-—Ñ–∞–∫—Ç–æ—Ä–æ–≤, –∫–æ–Ω—Ç—Ä–æ–ª–∏—Ä—É—é—â–∏—Ö —ç–∫—Å–ø—Ä–µ—Å—Å–∏—é –≥–µ–Ω–æ–≤. –ù–∞–ø—Ä–∏–º–µ—Ä: œÉ70, –∫–æ—Ç–æ—Ä—ã–π —Å–∏–Ω—Ç–µ–∑–∏—Ä—É–µ—Ç—Å—è –≤ –Ω–æ—Ä–º–∞–ª—å–Ω—ã—Ö —É—Å–ª–æ–≤–∏—è—Ö –∏ –ø–æ–∑–≤–æ–ª—è–µ—Ç –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–µ —Å–≤—è–∑—ã–≤–∞—Ç—å—Å—è —Å –≥–µ–Ω–∞–º–∏, –æ—Ç–≤–µ—á–∞—é—â–∏–º–∏ –∑–∞ –º–µ—Ç–∞–±–æ–ª–∏—á–µ—Å–∫–∏–µ –ø—Ä–æ—Ü–µ—Å—Å—ã –∫–ª–µ—Ç–∫–∏; –∏–ª–∏ œÉ32, –±–ª–æ–∫–∏—Ä—É—é—â–∏–π —Å–≤—è–∑—ã–≤–∞–Ω–∏–µ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã —Å –≥–µ–Ω–∞–º–∏ –±–µ–ª–∫–æ–≤ —Ç–µ–ø–ª–æ–≤–æ–≥–æ —à–æ–∫–∞. –ü–æ—Å–ª–µ —Å–≤—è–∑—ã–≤–∞–Ω–∏—è —Å –î–ù–ö —Å—Ç—Ä—É–∫—Ç—É—Ä–∞ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã –ø—Ä–µ–≤—Ä–∞—â–∞–µ—Ç—Å—è –∏–∑ –∑–∞–∫—Ä—ã—Ç–æ–π –≤ –æ—Ç–∫—Ä—ã—Ç—É—é. –≠—Ç–æ –ø—Ä–µ–≤—Ä–∞—â–µ–Ω–∏–µ –≤–∫–ª—é—á–∞–µ—Ç –≤ —Å–µ–±—è —Ä–∞–∑–¥–µ–ª–µ–Ω–∏–µ –º–æ–Ω–æ—Å–ø–∏—Ä–∞–ª–µ–π –î–ù–ö —Å –æ–±—Ä–∞–∑–æ–≤–∞–Ω–∏–µ–º —Ä–∞—Å–∫—Ä—É—á–µ–Ω–Ω–æ–≥–æ —É—á–∞—Å—Ç–∫–∞ –¥–ª–∏–Ω–æ–π –æ–∫–æ–ª–æ 13 —à–∞–≥–æ–≤. –Ý–∏–±–æ–Ω—É–∫–ª–µ–æ—Ç–∏–¥—ã –∑–∞—Ç–µ–º —Å–æ–±–∏—Ä–∞—é—Ç—Å—è –≤ —Ü–µ–ø–æ—á–∫—É –≤ —Å–æ–æ—Ç–≤–µ—Ç—Å—Ç–≤–∏–∏ —Å –±–∞–∑–æ–≤–æ–π –Ω–∏—Ç—å—é –î–ù–ö, –∏—Å–ø–æ–ª—å–∑—É–µ–º–æ–π –≤ –∫–∞—á–µ—Å—Ç–≤–µ —à–∞–±–ª–æ–Ω–∞. –°—É–ø–µ—Ä—Å–∫—Ä—É—á–µ–Ω–Ω–æ—Å—Ç—å –º–æ–ª–µ–∫—É–ª –î–ù–ö –∏–≥—Ä–∞–µ—Ç —Å—É—â–µ—Å—Ç–≤–µ–Ω–Ω—É—é —Ä–æ–ª—å –≤ –¥–µ—è—Ç–µ–ª—å–Ω–æ—Å—Ç–∏ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã: –ø–æ—Å–∫–æ–ª—å–∫—É —É—á–∞—Å—Ç–æ–∫ –î–ù–ö –ø–µ—Ä–µ–¥ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–æ–π —Ä–∞—Å–∫—Ä—É—á–µ–Ω, –≤ –Ω–µ–º —Å—É—â–µ—Å—Ç–≤—É—é—Ç –ø–æ–ª–æ–∂–∏—Ç–µ–ª—å–Ω—ã–µ –∫–æ–º–ø–µ–Ω—Å–∞—Ü–∏–æ–Ω–Ω—ã–µ —Å—É–ø–µ—Ä–≤–∏—Ç–∫–∏. –£—á–∞—Å—Ç–∫–∏ –î–ù–ö –ø–æ–∑–∞–¥–∏ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã —Å–Ω–æ–≤–∞ –∑–∞–∫—Ä—É—á–∏–≤–∞—é—Ç—Å—è –∏ –≤ –Ω–∏—Ö –ø—Ä–∏—Å—É—Ç—Å—Ç–≤—É—é—Ç –æ—Ç—Ä–∏—Ü–∞—Ç–µ–ª—å–Ω—ã–µ —Å—É–ø–µ—Ä–≤–∏—Ç–∫–∏. –≠–ª–æ–Ω–≥–∞—Ü–∏—è–í–æ –≤—Ä–µ–º—è —ç–ª–æ–Ω–≥–∞—Ü–∏–æ–Ω–Ω–æ–π —Ñ–∞–∑—ã —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–∏ –ø—Ä–æ–∏—Å—Ö–æ–¥–∏—Ç –¥–æ–±–∞–≤–ª–µ–Ω–∏–µ —Ä–∏–±–æ–Ω—É–∫–ª–µ–æ—Ç–∏–¥–æ–≤ –∫ —Ü–µ–ø–∏ –∏ –ø–µ—Ä–µ—Ö–æ–¥ –æ—Ç —Å—Ç—Ä—É–∫—Ç—É—Ä—ã –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–Ω–æ–≥–æ –∫–æ–º–ø–ª–µ–∫—Å–∞ –æ—Ç –æ—Ç–∫—Ä—ã—Ç–æ–π –∫ —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–æ–Ω–Ω–æ–π. –ü–æ –º–µ—Ä–µ —Å–±–æ—Ä–∫–∏ –º–æ–ª–µ–∫—É–ª—ã –Ý–ù–ö —É—á–∞—Å—Ç–æ–∫ –î–ù–ö –ø–µ—Ä–µ–¥ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–æ–π —Ä–∞—Å–∫—Ä—É—á–∏–≤–∞–µ—Ç—Å—è –¥–∞–ª–µ–µ, –∏ 13-–ø–∞—Ä–Ω—ã–π –æ—Ç–∫—Ä—ã—Ç—ã–π –∫–æ–º–ø–ª–µ–∫—Å –ø—Ä–µ–≤—Ä–∞—â–∞–µ—Ç—Å—è –≤ 17-–ø–∞—Ä–Ω—ã–π —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–æ–Ω–Ω—ã–π –∫–æ–º–ø–ª–µ–∫—Å. –í —ç—Ç–æ—Ç –º–æ–º–µ–Ω—Ç –ø—Ä–æ–º–æ—Ç–æ—Ä (—É—á–∞—Å—Ç–æ–∫ –î–ù–ö ‚àí10‚Ķ-35 —à–∞–≥–æ–≤) –∑–∞–≤–µ—Ä—à–∞–µ—Ç—Å—è, –∏ œÉ-—Ñ–∞–∫—Ç–æ—Ä –æ—Ç–¥–µ–ª—è–µ—Ç—Å—è –æ—Ç –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã. –≠—Ç–æ –ø–æ–∑–≤–æ–ª—è–µ—Ç –æ—Å—Ç–∞–ª—å–Ω–æ–º—É –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–Ω–æ–º—É –∫–æ–º–ø–ª–µ–∫—Å—É –Ω–∞—á–∞—Ç—å –¥–≤–∏–∂–µ–Ω–∏–µ –≤–ø–µ—Ä–µ–¥, —Ç–∞–∫ –∫–∞–∫ œÉ-—Ñ–∞–∫—Ç–æ—Ä —É–¥–µ—Ä–∂–∏–≤–∞–ª –µ–≥–æ –Ω–∞ –º–µ—Å—Ç–µ. 17-–ø–∞—Ä–Ω—ã–π —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–æ–Ω–Ω—ã–π –∫–æ–º–ø–ª–µ–∫—Å —Å–æ–¥–µ—Ä–∂–∏—Ç –≥–∏–±—Ä–∏–¥ –î–ù–ö –∏ –Ý–ù–ö, —Å–æ–¥–µ—Ä–∂–∞—â–∏–π 8 –ø–∞—Ä –æ—Å–Ω–æ–≤–∞–Ω–∏–π ‚Äî 8-—à–∞–≥–æ–≤—ã–π —É—á–∞—Å—Ç–æ–∫ –Ý–ù–ö, —Å–æ–µ–¥–∏–Ω–µ–Ω–Ω—ã–π —Å —à–∞–±–ª–æ–Ω–Ω–æ–π —Ü–µ–ø—å—é –î–ù–ö. –ü–æ –º–µ—Ä–µ –≤—ã–ø–æ–ª–Ω–µ–Ω–∏—è —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–∏ —Ä–∏–±–æ–Ω—É–∫–ª–µ–æ—Ç–∏–¥—ã –¥–æ–±–∞–≤–ª—è—é—Ç—Å—è –∫ 3'-–∫–æ–Ω—Ü—É —Å–æ–±–∏—Ä–∞–µ–º–æ–π –Ý–ù–ö, –∏ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–Ω—ã–π –∫–æ–º–ø–ª–µ–∫—Å –¥–≤–∏–∂–µ—Ç—Å—è –ø–æ —Ü–µ–ø–∏ –î–ù–ö. –•–æ—Ç—è –≤ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–µ –Ω–µ –æ–±–Ω–∞—Ä—É–∂–µ–Ω–æ —Å–≤–æ–π—Å—Ç–≤, —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω—ã—Ö –¥–ª—è 3'-—ç–∫–∑–æ–Ω—É–∫–ª–µ–∞–∑—ã, –∞–Ω–∞–ª–æ–≥–∏—á–Ω—ã—Ö –ø—Ä–æ–≤–µ—Ä–æ—á–Ω–æ–π –¥–µ—è—Ç–µ–ª—å–Ω–æ—Å—Ç–∏ –î–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã, –µ—Å—Ç—å —Å–≤–∏–¥–µ—Ç–µ–ª—å—Å—Ç–≤–∞ —Ç–æ–≥–æ, —á—Ç–æ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –æ—Å—Ç–∞–Ω–∞–≤–ª–∏–≤–∞–µ—Ç—Å—è –∏ –∫–æ—Ä—Ä–µ–∫—Ç–∏—Ä—É–µ—Ç –æ—à–∏–±–∫–∏ –≤ —Å–ª—É—á–∞—è—Ö –æ—à–∏–±–æ—á–Ω–æ–≥–æ —Ñ–æ—Ä–º–∏—Ä–æ–≤–∞–Ω–∏—è –ø–∞—Ä –æ—Å–Ω–æ–≤–∞–Ω–∏–π –î–ù–ö-–Ý–ù–ö. –î–æ–±–∞–≤–ª–µ–Ω–∏–µ —Ä–∏–±–æ–Ω—É–∫–ª–µ–æ—Ç–∏–¥–æ–≤ –∫ –Ý–ù–ö –æ–±–ª–∞–¥–∞–µ—Ç –º–µ—Ö–∞–Ω–∏–∑–º–æ–º, –æ—á–µ–Ω—å –±–ª–∏–∑–∫–∏–º –∫ –ø–æ–ª–∏–º–µ—Ä–∏–∑–∞—Ü–∏–∏ –î–ù–ö. –°—á–∏—Ç–∞–µ—Ç—Å—è, —á—Ç–æ –î–ù–ö- –∏ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã –º–æ–≥—É—Ç –±—ã—Ç—å —ç–≤–æ–ª—é—Ü–∏–æ–Ω–Ω–æ —Å–≤—è–∑–∞–Ω—ã. –ê—Å–ø–∞—Ä–∞–≥–∏–Ω–æ–≤—ã–µ –æ—Å—Ç–∞—Ç–∫–∏ –≤ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–µ —Å–≤—è–∑—ã–≤–∞—é—Ç—Å—è —Å –∏–æ–Ω–∞–º–∏ Mg2+, –∫–æ—Ç–æ—Ä—ã–µ, –≤ —Å–≤–æ—é –æ—á–µ—Ä–µ–¥—å, –æ—Å—É—â–µ—Å—Ç–≤–ª—è—é—Ç –≤—ã—Ä–∞–≤–Ω–∏–≤–∞–Ω–∏–µ —Ñ–æ—Å—Ñ–∞—Ç–Ω—ã—Ö –≥—Ä—É–ø–ø —Ä–∏–±–æ–Ω—É–∫–ª–µ–æ—Ç–∏–¥–æ–≤: –ø–µ—Ä–≤—ã–π Mg2+ —É–¥–µ—Ä–∂–∏–≤–∞–µ—Ç Œ±-—Ñ–æ—Å—Ñ–∞—Ç –Ω—É–∫–ª–µ–æ—Ç–∏–¥—Ç—Ä–∏—Ñ–æ—Å—Ñ–∞—Ç–∞, –ø–æ–¥–ª–µ–∂–∞—â–µ–≥–æ –¥–æ–±–∞–≤–ª–µ–Ω–∏—é –≤ —Ü–µ–ø–æ—á–∫—É. –≠—Ç–æ –ø–æ–∑–≤–æ–ª—è–µ—Ç –æ—Å—É—â–µ—Å—Ç–≤–∏—Ç—å —Å–≤—è–∑—ã–≤–∞–Ω–∏–µ –Ω—É–∫–ª–µ–æ—Ç–∏–¥–∞ —Å 3' OH-–≥—Ä—É–ø–ø–æ–π –∫–æ–Ω—Ü–∞ —Å–æ–±–∏—Ä–∞–µ–º–æ–π —Ü–µ–ø–æ—á–∫–∏ –∏ —Ç–∞–∫–∏–º –æ–±—Ä–∞–∑–æ–º –¥–æ–±–∞–≤–∏—Ç—å –ù–¢–§ –≤ —Ü–µ–ø–æ—á–∫—É. –í—Ç–æ—Ä–æ–π Mg2+ —É–¥–µ—Ä–∂–∏–≤–∞–µ—Ç –ø–∏—Ä–æ—Ñ–æ—Å—Ñ–∞—Ç –ù–¢–§. –û–±—â–µ–µ —É—Ä–∞–≤–Ω–µ–Ω–∏–µ —Ä–µ–∞–∫—Ü–∏–∏ —Ç–∞–∫–∏–º –æ–±—Ä–∞–∑–æ–º –∏–º–µ–µ—Ç –≤–∏–¥: (–ù–ú–§)n + –ù–¢–§ --> (–ù–ú–§)n+1 + –ü–§i –¢–µ—Ä–º–∏–Ω–∞—Ü–∏—è–¢–µ—Ä–º–∏–Ω–∞—Ü–∏—è —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–∏ –Ý–ù–ö –º–æ–∂–µ—Ç –±—ã—Ç—å œÅ-–Ω–µ–∑–∞–≤–∏—Å–∏–º–æ–π –ª–∏–±–æ œÅ-–∑–∞–≤–∏—Å–∏–º–æ–π. œÅ-–Ω–µ–∑–∞–≤–∏—Å–∏–º–∞—è —Ç–µ—Ä–º–∏–Ω–∞—Ü–∏—è –æ—Å—É—â–µ—Å—Ç–≤–ª—è–µ—Ç—Å—è –±–µ–∑ –ø–æ–º–æ—â–∏ œÅ-—Ñ–∞–∫—Ç–æ—Ä–∞. –¢—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏—è –ø–∞–ª–∏–Ω–¥—Ä–æ–º–Ω–æ–≥–æ —É—á–∞—Å—Ç–∫–∞ –î–ù–ö –ø—Ä–∏–≤–æ–¥–∏—Ç –∫ —Ñ–æ—Ä–º–∏—Ä–æ–≤–∞–Ω–∏—é —à–ø–∏–ª—å–∫–∏ –∏–∑ –Ý–ù–ö, –∑–∞—Ü–∏–∫–ª–µ–Ω–Ω–æ–π –∏ —Å–≤—è–∑–∞–Ω–Ω–æ–π —Å —Å–∞–º–æ–π —Å–æ–±–æ–π. –≠—Ç–∞ —à–ø–∏–ª—å–∫–∞ –±–æ–≥–∞—Ç–∞ –≥—É–∞–Ω–∏–Ω–æ–º –∏ —Ü–∏—Ç–æ–∑–∏–Ω–æ–º, —á—Ç–æ –¥–µ–ª–∞–µ—Ç –µ—ë –±–æ–ª–µ–µ —Å—Ç–∞–±–∏–ª—å–Ω–æ–π, –Ω–µ–∂–µ–ª–∏ –≥–∏–±—Ä–∏–¥ –î–ù–ö-–Ý–ù–ö. –í —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ 8-–ø–∞—Ä–Ω—ã–π –≥–∏–±—Ä–∏–¥ –î–ù–ö-–Ý–ù–ö –≤ —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–æ–Ω–Ω–æ–º –∫–æ–º–ø–ª–µ–∫—Å–µ —Å–æ–∫—Ä–∞—â–∞–µ—Ç—Å—è –¥–æ 4-–ø–∞—Ä–Ω–æ–≥–æ. –í —Å–ª—É—á–∞–µ –µ—Å–ª–∏ —ç—Ç–∏ 4 –ø–æ—Å–ª–µ–¥–Ω–∏–µ –ø–∞—Ä—ã –æ—Å–Ω–æ–≤–∞–Ω–∏–π —Å–æ—Å—Ç–∞–≤–ª–µ–Ω—ã —Å–ª–∞–±—ã–º–∏ –∞–¥–µ–Ω–∏–Ω–æ–º –∏ —É—Ä–∏–¥–∏–Ω–æ–º, –º–æ–ª–µ–∫—É–ª–∞ –Ý–ù–ö –æ—Ç–¥–µ–ª—è–µ—Ç—Å—è.[6] –ë–∞–∫—Ç–µ—Ä–∏–∞–ª—å–Ω–∞—è –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –£ –±–∞–∫—Ç–µ—Ä–∏–π –æ–¥–∏–Ω –∏ —Ç–æ—Ç –∂–µ —Ñ–µ—Ä–º–µ–Ω—Ç –∫–∞—Ç–∞–ª–∏–∑–∏—Ä—É–µ—Ç —Å–∏–Ω—Ç–µ–∑ —Ç—Ä—ë—Ö —Ç–∏–ø–æ–≤ –Ý–ù–ö: –º–Ý–ù–ö, —Ä–Ý–ù–ö –∏ —Ç–Ý–ù–ö. –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ ‚Äî –¥–æ—Å—Ç–∞—Ç–æ—á–Ω–æ –±–æ–ª—å—à–∞—è –º–æ–ª–µ–∫—É–ª–∞. –û—Å–Ω–æ–≤–Ω–æ–π —Ñ–µ—Ä–º–µ–Ω—Ç —Å–æ–¥–µ—Ä–∂–∏—Ç 5 —Å—É–±—ä–µ–¥–∏–Ω–∏—Ü (~400 –∫–î–∞):
–î–ª—è —Å–≤—è–∑—ã–≤–∞–Ω–∏—è —Å –ø—Ä–æ–º–æ—Ç–æ—Ä–Ω—ã–º–∏ –æ–±–ª–∞—Å—Ç—è–º–∏ –î–ù–ö, –æ—Å–Ω–æ–≤–Ω–æ–π —Ñ–µ—Ä–º–µ–Ω—Ç –Ω—É–∂–¥–∞–µ—Ç—Å—è –≤ –µ—â–µ –æ–¥–Ω–æ–π —Å—É–±—ä–µ–¥–∏–Ω–∏—Ü–µ ‚Äî —Å–∏–≥–º–∞ (œÉ). –°–∏–≥–º–∞-—Ñ–∞–∫—Ç–æ—Ä –∑–Ω–∞—á–∏—Ç–µ–ª—å–Ω–æ —Å–Ω–∏–∂–∞–µ—Ç —Å—Ä–æ–¥—Å—Ç–≤–æ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã –∫ –Ω–µ—Å–ø–µ—Ü–∏—Ñ–∏—á–Ω—ã–º –æ–±–ª–∞—Å—Ç—è–º –î–ù–ö, –∏ –≤ —Ç–æ –∂–µ –≤—Ä–µ–º—è –ø–æ–≤—ã—à–∞–µ—Ç –µ—ë —á—É–≤—Å—Ç–≤–∏—Ç–µ–ª—å–Ω–æ—Å—Ç—å –∫ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω—ã–º –ø—Ä–æ–º–æ—Ç–æ—Ä–∞–º, –≤ –∑–∞–≤–∏—Å–∏–º–æ—Å—Ç–∏ –æ—Ç —Å–≤–æ–µ–π —Å—Ç—Ä—É–∫—Ç—É—Ä—ã. –° –µ–≥–æ –ø–æ–º–æ—â—å—é —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏—è –Ω–∞—á–∏–Ω–∞–µ—Ç—Å—è —Å –Ω—É–∂–Ω–æ–≥–æ —É—á–∞—Å—Ç–∫–∞ –î–ù–ö. –ü–æ–ª–Ω—ã–π –≥–æ–ª–æ—ç–Ω–∑–∏–º —Ç–∞–∫–∏–º –æ–±—Ä–∞–∑–æ–º —Å–æ—Å—Ç–æ–∏—Ç –∏–∑ 6 —Å—É–±—ä–µ–¥–∏–Ω–∏—Ü: Œ±2Œ≤Œ≤'œÉœâ (~480 –∫–î–∞). –í —Å—Ç—Ä—É–∫—Ç—É—Ä–µ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã –ø—Ä–∏—Å—É—Ç—Å—Ç–≤—É–µ—Ç –∫–∞–Ω–∞–≤–∫–∞ –¥–ª–∏–Ω–æ–π 55 √Ö (5,5 –Ω–º) –∏ —à–∏—Ä–∏–Ω–æ–π 25 √Ö (2,5 –Ω–º). –ò–º–µ–Ω–Ω–æ –≤ —ç—Ç—É –∫–∞–Ω–∞–≤–∫—É –ø–æ–º–µ—â–∞–µ—Ç—Å—è –¥–≤–æ–π–Ω–∞—è —Å–ø–∏—Ä–∞–ª—å –î–ù–ö, –∏–º–µ—é—â–∞—è —à–∏—Ä–∏–Ω—É 20 √Ö (2 –Ω–º). –ù–∞ –¥–ª–∏–Ω–µ –∫–∞–Ω–∞–≤–∫–∏ —É–∫–ª–∞–¥—ã–≤–∞–µ—Ç—Å—è 16 –Ω—É–∫–ª–µ–æ—Ç–∏–¥–æ–≤. –ú–æ–ª–µ–∫—É–ª—ã –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã –Ω–µ —Ä–∞—Å—Ç–≤–æ—Ä–µ–Ω—ã –≤ —Ü–∏—Ç–æ–ø–ª–∞–∑–º–µ. –ö–æ–≥–¥–∞ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –Ω–µ –∏—Å–ø–æ–ª—å–∑—É–µ—Ç—Å—è, –æ–Ω–∞ —Å–≤—è–∑—ã–≤–∞–µ—Ç—Å—è —Å –Ω–µ—Å–ø–µ—Ü–∏—Ñ–∏—á–Ω—ã–º–∏ –æ–±–ª–∞—Å—Ç—è–º–∏ –î–ù–ö –≤ –æ–∂–∏–¥–∞–Ω–∏–∏ –æ—Ç–∫—Ä—ã—Ç–∏—è –∞–∫—Ç–∏–≤–Ω–æ–≥–æ –ø—Ä–æ–º–æ—Ç–æ—Ä–∞. –¢—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–æ–Ω–Ω—ã–µ –∫–æ—Ñ–∞–∫—Ç–æ—Ä—ã–°—É—â–µ—Å—Ç–≤—É—é—Ç –±–µ–ª–∫–∏, —Å–≤—è–∑—ã–≤–∞—é—â–∏–µ—Å—è —Å –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–æ–π –∏ –≤–ª–∏—è—é—â–∏–µ –Ω–∞ –µ—ë –ø–æ–≤–µ–¥–µ–Ω–∏–µ. –ù–∞–ø—Ä–∏–º–µ—Ä greA –∏ greB –∏–∑ E. coli —É—Å–∏–ª–∏–≤–∞—é—Ç —Å–ø–æ—Å–æ–±–Ω–æ—Å—Ç—å –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã —Ä–∞—Å—â–µ–ø–ª—è—Ç—å —à–∞–±–ª–æ–Ω –Ý–ù–ö —É —Ä–∞—Å—Ç—É—â–µ–≥–æ –∫–æ–Ω—Ü–∞ —Ü–µ–ø–∏. –¢–∞–∫–æ–µ —Ä–∞—Å—â–µ–ø–ª–µ–Ω–∏–µ –º–æ–∂–µ—Ç ¬´—Å–ø–∞—Å—Ç–∏¬ª –∑–∞—Å—Ç—Ä—è–≤—à—É—é –º–æ–ª–µ–∫—É–ª—É –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã, –∞ —Ç–∞–∫–∂–µ, –≤–µ—Ä–æ—è—Ç–Ω–æ, —É—á–∞—Å—Ç–≤—É–µ—Ç –≤ —É—Å—Ç—Ä–∞–Ω–µ–Ω–∏–∏ –æ—à–∏–±–æ–∫ —Å–±–æ—Ä–∫–∏ —Ü–µ–ø–∏ –Ý–ù–ö. –û—Ç–¥–µ–ª—å–Ω—ã–π –∫–æ—Ñ–∞–∫—Ç–æ—Ä Mfd –∑–∞–¥–µ–π—Å—Ç–≤–æ–≤–∞–Ω –≤ —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–æ–Ω–Ω–æ–º –≤–æ—Å—Å—Ç–∞–Ω–æ–≤–ª–µ–Ω–∏–∏ –î–ù–ö. –í–æ –≤—Ä–µ–º—è —ç—Ç–æ–≥–æ –ø—Ä–æ—Ü–µ—Å—Å–∞ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –æ–±–Ω–∞—Ä—É–∂–∏–≤–∞–µ—Ç –ø–æ–≤—Ä–µ–∂–¥–µ–Ω–Ω—ã–µ —É—á–∞—Å—Ç–∫–∏ –î–ù–ö –∏ –ø—Ä–∏–≤–ª–µ–∫–∞–µ—Ç –¥—Ä—É–≥–∏–µ —Ñ–µ—Ä–º–µ–Ω—Ç—ã –¥–ª—è –µ—ë –≤–æ—Å—Å—Ç–∞–Ω–æ–≤–ª–µ–Ω–∏—è. –ú–Ω–æ–≥–∏–µ –¥—Ä—É–≥–∏–µ –∫–æ—Ñ–∞–∫—Ç–æ—Ä—ã –æ–±–ª–∞–¥–∞—é—Ç —Ä–µ–≥—É–ª–∏—Ä—É—é—â–∏–º –≤–ª–∏—è–Ω–∏–µ–º, –∑–∞—Å—Ç–∞–≤–ª—è—è –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—É —ç–∫—Å–ø—Ä–µ—Å—Å–∏—Ä–æ–≤–∞—Ç—å –∏–ª–∏ –Ω–µ —ç–∫—Å–ø—Ä–µ—Å—Å–∏—Ä–æ–≤–∞—Ç—å –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω—ã–µ –≥–µ–Ω—ã. –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –≤ —ç—É–∫–∞—Ä–∏–æ—Ç–∏—á–µ—Å–∫–∏—Ö –∫–ª–µ—Ç–∫–∞—Ö –≠—É–∫–∞—Ä–∏–æ—Ç—ã –æ–±–ª–∞–¥–∞—é—Ç —Ä–∞–∑–ª–∏—á–Ω—ã–º–∏ —Ç–∏–ø–∞–º–∏ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑, –∫–ª–∞—Å—Å–∏—Ñ–∏—Ü–∏—Ä—É–µ–º—ã–º–∏ –ø–æ —Ç–∏–ø–∞–º –Ý–ù–ö, –∫–æ—Ç–æ—Ä—ã–µ –æ–Ω–∏ –ø—Ä–æ–∏–∑–≤–æ–¥—è—Ç:
–°—É—â–µ—Å—Ç–≤—É—é—Ç —Ç–∞–∫–∂–µ –∏ –¥—Ä—É–≥–∏–µ —Ç–∏–ø—ã –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã, –∏—Å–ø–æ–ª—å–∑—É–µ–º—ã–µ –≤ –º–∏—Ç–æ—Ö–æ–Ω–¥—Ä–∏—è—Ö –∏ —Ö–ª–æ—Ä–æ–ø–ª–∞—Å—Ç–∞—Ö. –ú–æ–ª–µ–∫—É–ª—è—Ä–Ω–∞—è –º–∞—Å—Å–∞ —ç—Ç–∏—Ö —Ñ–µ—Ä–º–µ–Ω—Ç–æ–≤ —Å–æ—Å—Ç–∞–≤–ª—è–µ—Ç –≤–µ–ª–∏—á–∏–Ω—É –ø–æ—Ä—è–¥–∫–∞ 500 000. –û–Ω–∏ —Ä–∞–∑–ª–∏—á–∞—é—Ç—Å—è –ø–æ —á—É–≤—Å—Ç–≤–∏—Ç–µ–ª—å–Ω–æ—Å—Ç–∏ –∫ –∞–ª—å—Ñ–∞-–∞–º–∞–Ω–∏—Ç–∏–Ω—É. –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ I –Ω–µ—á—É–≤—Å—Ç–≤–∏—Ç–µ–ª—å–Ω–∞ –∫ –Ω–µ–º—É, –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ III —É–º–µ—Ä–µ–Ω–Ω–æ —á—É–≤—Å—Ç–≤–∏—Ç–µ–ª—å–Ω–∞, –∞ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ II —Å–∏–ª—å–Ω–æ –∏–Ω–≥–∏–±–∏—Ä—É–µ—Ç—Å—è –∏–º.[12] –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ —É –∞—Ä—Ö–µ–π–ê—Ä—Ö–µ–∏ –∏—Å–ø–æ–ª—å–∑—É—é—Ç –æ–¥–∏–Ω –≤–∏–¥ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã, –∫–æ—Ç–æ—Ä—ã–π —Ç–µ–º –Ω–µ –º–µ–Ω–µ–µ –æ—á–µ–Ω—å –ø–æ—Ö–æ–∂ –Ω–∞ —Ç—Ä–∏ –æ—Å–Ω–æ–≤–Ω—ã—Ö —Ç–∏–ø–∞ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑ —É —ç—É–∫–∞—Ä–∏–æ—Ç. –ù–µ–∫–æ—Ç–æ—Ä—ã–µ —É—á–µ–Ω—ã–µ –ø—Ä–µ–¥–ø–æ–ª–∞–≥–∞—é—Ç, —á—Ç–æ –∞—Ä—Ö–µ–π–Ω–∞—è –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –≤ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω–æ–º –ø—Ä–∏–±–ª–∏–∂–µ–Ω–∏–∏ –º–æ–∂–µ—Ç —è–≤–ª—è—Ç—å—Å—è —ç–≤–æ–ª—é—Ü–∏–æ–Ω–Ω—ã–º –ø—Ä–µ–¥–∫–æ–º —Å–ø–µ—Ü–∏–∞–ª–∏–∑–∏—Ä–æ–≤–∞–Ω–Ω—ã—Ö —ç—É–∫–∞—Ä–∏–æ—Ç–∏—á–µ—Å–∫–∏—Ö –ø–æ–ª–∏–º–µ—Ä–∞–∑.[13] –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ —É –≤–∏—Ä—É—Å–æ–≤ –ú–Ω–æ–≥–∏–µ –≤–∏—Ä—É—Å—ã —Å–æ–¥–µ—Ä–∂–∞—Ç –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—É. –ü–æ–∂–∞–ª—É–π, –Ω–∞–∏–±–æ–ª–µ–µ —Ö–æ—Ä–æ—à–æ –∏–∑—É—á–µ–Ω–Ω–∞—è –≤–∏—Ä—É—Å–Ω–∞—è –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –∏–º–µ–µ—Ç—Å—è —É –±–∞–∫—Ç–µ—Ä–∏–æ—Ñ–∞–≥–∞ T7[–∞–Ω–≥–ª.]. –≠—Ç–∞ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞, —Å–æ—Å—Ç–æ—è—â–∞—è –∏–∑ –æ–¥–Ω–æ–π —Å—É–±—ä–µ–¥–∏–Ω–∏—Ü—ã, –ø–æ—Ö–æ–∂–∞ –Ω–∞ –º–∏—Ç–æ—Ö–æ–Ω–¥—Ä–∏–∞–ª—å–Ω—É—é –∏ —Ö–ª–æ—Ä–æ–ø–ª–∞—Å—Ç–Ω—É—é, –∞ —Ç–∞–∫–∂–µ –Ω–∞ –î–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—É.[15] –°—á–∏—Ç–∞–µ—Ç—Å—è, —á—Ç–æ –±–æ–ª—å—à–∏–Ω—Å—Ç–≤–æ –≤–∏—Ä—É—Å–Ω—ã—Ö –ø–æ–ª–∏–º–µ—Ä–∞–∑ –ø—Ä–æ–∏–∑–æ—à–ª–∏ –æ—Ç –î–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã, –∞ –Ω–µ –æ—Ç —Å–ª–æ–∂–Ω—ã—Ö –º–Ω–æ–≥–æ–∫–æ–º–ø–æ–Ω–µ–Ω—Ç–Ω—ã—Ö –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑. –í–∏—Ä—É—Å–Ω—ã–µ –ø–æ–ª–∏–º–µ—Ä–∞–∑—ã –æ—á–µ–Ω—å –º–Ω–æ–≥–æ—á–∏—Å–ª–µ–Ω–Ω—ã. –ú–Ω–æ–≥–∏–µ –∏–∑ –Ω–∏—Ö –º–æ–≥—É—Ç –∏—Å–ø–æ–ª—å–∑–æ–≤–∞—Ç—å –≤ –∫–∞—á–µ—Å—Ç–≤–µ —à–∞–±–ª–æ–Ω–∞ –Ý–ù–ö, –∞ –Ω–µ –î–ù–ö, –∫–∞–∫, –Ω–∞–ø—Ä–∏–º–µ—Ä, —É –≤–∏—Ä—É—Å–æ–≤ —Å –¥–≤—É—Ü–µ–ø–æ—á–µ—á–Ω–æ–π –Ý–ù–ö –∏–ª–∏ —Å –æ–¥–Ω–æ—Ü–µ–ø–æ—á–µ—á–Ω–æ–π –Ý–ù–ö –Ω–µ–≥–∞—Ç–∏–≤–Ω–æ–π –ø–æ–ª—è—Ä–Ω–æ—Å—Ç–∏. –ù–µ–∫–æ—Ç–æ—Ä—ã–µ –≤–∏—Ä—É—Å—ã —Å –æ–¥–Ω–æ—Ü–µ–ø–æ—á–µ—á–Ω–æ–π –Ý–ù–ö –ø–æ–∑–∏—Ç–∏–≤–Ω–æ–π –ø–æ–ª—è—Ä–Ω–æ—Å—Ç–∏ —Ç–∞–∫–∂–µ —Å–æ–¥–µ—Ä–∂–∞—Ç –Ý–ù–ö-–∑–∞–≤–∏—Å–∏–º—ã–µ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã.[16] –§—É–Ω–∫—Ü–∏–æ–Ω–∞–ª—å–Ω—ã–µ –æ–±–ª–∞—Å—Ç–∏C-–∫–æ–Ω—Ü–µ–≤–æ–π –¥–æ–º–µ–Ω –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã–ò–Ω–∏—Ü–∏–∏—Ä–æ–≤–∞–Ω–∏–µ —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–∏–î–æ–º–µ–Ω, —Ä–∞—Å–ø–æ–ª–æ–∂–µ–Ω–Ω—ã–π –Ω–∞ —É–≥–ª–µ–∫–∏—Å–ª–æ–º –∫–æ–Ω—Ü–µ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã II –æ—Å—É—â–µ—Å—Ç–≤–ª—è–µ—Ç –∏–Ω–∏—Ü–∏–∏—Ä–æ–≤–∞–Ω–∏–µ —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–∏ –î–ù–ö. C-–∫–æ–Ω—Ü–µ–≤–æ–π –¥–æ–º–µ–Ω –æ–±—ã—á–Ω–æ —Å–æ—Å—Ç–æ–∏—Ç –∏–∑ –ø–æ—Ä—è–¥–∫–∞ 52 –ø–æ–≤—Ç–æ—Ä–µ–Ω–∏–π –ø–æ—Å–ª–µ–¥–æ–≤–∞—Ç–µ–ª—å–Ω–æ—Å—Ç–∏ Tyr-Ser-Pro-Thr-Ser-Pro-Ser [17]. –§–∞–∫—Ç–æ—Ä —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–∏ TFIIH, —è–≤–ª—è—é—â–∏–π—Å—è –∫–∏–Ω–∞–∑–æ–π, –≥–∏–ø–µ—Ä—Ñ–æ—Å—Ñ–æ—Ä–∏–ª–∏—Ä—É–µ—Ç C-–∫–æ–Ω—Ü–µ–≤–æ–π –¥–æ–º–µ–Ω –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã, —Ç–µ–º —Å–∞–º—ã–º –∑–∞—Å—Ç–∞–≤–ª—è—è –ø–æ–ª–∏–º–µ—Ä–∞–∑–Ω—ã–π –∫–æ–º–ø–ª–µ–∫—Å –Ω–∞—á–∞—Ç—å –¥–≤–∏–∂–µ–Ω–∏–µ –æ—Ç –º–µ—Å—Ç–∞ –∏–Ω–∏—Ü–∏–∏—Ä–æ–≤–∞–Ω–∏—è —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–∏. 5'-–∫—ç–ø–∏—Ä–æ–≤–∞–Ω–∏–µ–°-–∫–æ–Ω—Ü–µ–≤–æ–π –¥–æ–º–µ–Ω —Ç–∞–∫–∂–µ —è–≤–ª—è–µ—Ç—Å—è –º–µ—Å—Ç–æ–º —Å–≤—è–∑—ã–≤–∞–Ω–∏—è –∫–æ–º–ø–ª–µ–∫—Å–∞ –∫—ç–ø–∏—Ä–æ–≤–∞–Ω–∏—è. –£ —ç—É–∫–∞—Ä–∏–æ—Ç –ø–æ—Å–ª–µ —Å–∏–Ω—Ç–µ–∑–∞ 5'-–∫–æ–Ω—Ü–∞ –º–Ý–ù–ö —Ñ–æ—Å—Ñ–∞—Ç–∞–∑–∞ –∫–æ–Ω—Ü–µ–≤–æ–π —Ñ–æ—Å—Ñ–∞—Ç —Å 5'-–∫–æ–Ω—Ü–∞ –ø–æ–ª–∏—Ä–∏–±–æ–Ω—É–∫–ª–µ–æ—Ç–∏–¥–∞ —Ñ–µ—Ä–º–µ–Ω—Ç –≥—É–∞–Ω–æ–∑–∏–Ω—Ç—Ä–∞–Ω—Å—Ñ–µ—Ä–∞–∑–∞ –ø—Ä–∏—Å–æ–µ–¥–∏–Ω—è–µ—Ç –∫ –Ω–µ–º—É –≥—É–∞–Ω–æ–∑–∏–Ω–º–æ–Ω–æ—Ñ–æ—Å—Ñ–∞—Ç. –ü—Ä–∏ —ç—Ç–æ–º –æ–±—Ä–∞–∑—É–µ—Ç—Å—è 5',5'-—Ç—Ä–∏—Ñ–æ—Å—Ñ–∞—Ç–Ω–∞—è —Å–≤—è–∑—å. –ö—ç–ø–∏—Ä—É—é—â–∏–π –∫–æ–º–ø–ª–µ–∫—Å –∑–∞—Ç–µ–º –¥–∏—Å—Å–æ—Ü–∏–∏—Ä—É–µ—Ç –æ—Ç –º–Ý–ù–ö, 5'-–∫—ç–ø –∏–∑ –ì–¢–§ —Å–≤—è–∑—ã–≤–∞–µ—Ç—Å—è —Å –∫—ç–ø-—Å–≤—è–∑—ã–≤–∞—é—â–∏–º –∫–æ–º–ø–ª–µ–∫—Å–æ–º, C-–∫–æ–Ω—Ü–µ–≤–æ–≥–æ –¥–æ–º–µ–Ω–∞ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã. 5'-–∫—ç–ø –≤ —Å—Ç—Ä—É–∫—Ç—É—Ä–µ –º–Ý–ù–ö —ç—É–∫–∞—Ä–∏–æ—Ç –∏–º–µ–µ—Ç –±–æ–ª—å—à–æ–µ –∑–Ω–∞—á–µ–Ω–∏–µ –¥–ª—è —Å–≤—è–∑—ã–≤–∞–Ω–∏—è –º–æ–ª–µ–∫—É–ª –º–Ý–ù–ö —Å —Ä–∏–±–æ—Å–æ–º–∞–º–∏, –∞ —Ç–∞–∫–∂–µ –ø—Ä–µ–¥–æ—Ç–≤—Ä–∞—â–∞–µ—Ç –¥–µ–≥—Ä–∞–¥–∞—Ü–∏—é –Ý–ù–ö. –°–ø–ª–∞–π—Å–æ—Å–æ–º–∞–°-–∫–æ–Ω—Ü–µ–≤–æ–π –¥–æ–º–µ–Ω –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã —Ç–∞–∫–∂–µ —è–≤–ª—è–µ—Ç—Å—è –æ–±–ª–∞—Å—Ç—å—é —Å–≤—è–∑—ã–≤–∞–Ω–∏—è —Å–æ —Å–ø–ª–∞–π—Å–æ—Å–æ–º–Ω—ã–º–∏ —Ñ–∞–∫—Ç–æ—Ä–∞–º–∏, —É—á–∞—Å—Ç–≤—É—é—â–∏–º–∏ –≤ –ø—Ä–æ—Ü–µ—Å—Å–µ —Å–ø–ª–∞–π—Å–∏–Ω–≥–∞ –Ý–ù–ö. –≠—Ç–∏ —Ñ–∞–∫—Ç–æ—Ä—ã —Å–ø–æ—Å–æ–±—Å—Ç–≤—É—é—Ç –æ—Å—É—â–µ—Å—Ç–≤–ª–µ–Ω–∏—é —Å–ø–ª–∞–π—Å–∏–Ω–≥–∞ –∏ —É–¥–∞–ª–µ–Ω–∏—é –∏–Ω—Ç—Ä–æ–Ω–æ–≤ –≤ –ø—Ä–æ—Ü–µ—Å—Å–µ —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏–∏ –Ý–ù–ö. –ú—É—Ç–∞—Ü–∏—è –≤ C-–∫–æ–Ω—Ü–µ–≤–æ–º –¥–æ–º–µ–Ω–µ–ë—ã–ª –ø—Ä–æ–≤–µ–¥–µ–Ω —Ä—è–¥ –∏—Å—Å–ª–µ–¥–æ–≤–∞–Ω–∏–π –ø–æ–≤–µ–¥–µ–Ω–∏—è –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã –ø—Ä–∏ —É–¥–∞–ª–µ–Ω–∏–∏ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω—ã—Ö –∞–º–∏–Ω–æ–∫–∏—Å–ª–æ—Ç –∏–∑ –µ—ë C-–∫–æ–Ω—Ü–µ–≤–æ–≥–æ –¥–æ–º–µ–Ω–∞. –ü–æ–∫–∞–∑–∞–Ω–æ, —á—Ç–æ –º—É—Ç–∞—Ü–∏–∏ —É—Å–µ—á–µ–Ω–∏—è C-–∫–æ–Ω—Ü–µ–≤–æ–≥–æ –¥–æ–º–µ–Ω–∞ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã II –≤–ª–∏—è—é—Ç –Ω–∞ –µ—ë —Å–ø–æ—Å–æ–±–Ω–æ—Å—Ç—å –Ω–∞—á–∏–Ω–∞—Ç—å —Ç—Ä–∞–Ω—Å–∫—Ä–∏–ø—Ü–∏—é –Ω–∞–±–æ—Ä–∞ –≥–µ–Ω–æ–≤ in vivo, —Å–Ω–∏–∂–∞—è —á—É–≤—Å—Ç–≤–∏—Ç–µ–ª—å–Ω–æ—Å—Ç—å –∫ –∞–∫—Ç–∏–≤–∞—Ü–∏–æ–Ω–Ω—ã–º –ø–æ—Å–ª–µ–¥–æ–≤–∞—Ç–µ–ª—å–Ω–æ—Å—Ç—è–º —ç—Ç–∏—Ö –≥–µ–Ω–æ–≤. –û—á–∏—Å—Ç–∫–∞ –Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑—ã–Ý–ù–ö-–ø–æ–ª–∏–º–µ—Ä–∞–∑–∞ –º–æ–∂–µ—Ç –±—ã—Ç—å –≤—ã–¥–µ–ª–µ–Ω–∞ —Å–ª–µ–¥—É—é—â–∏–º–∏ —Å–ø–æ—Å–æ–±–∞–º–∏:
–ê —Ç–∞–∫–∂–µ –∫–æ–º–±–∏–Ω–∞—Ü–∏—è–º–∏ –≤—ã—à–µ—É–∫–∞–∑–∞–Ω–Ω—ã—Ö –º–µ—Ç–æ–¥–æ–≤. –°–º. —Ç–∞–∫–∂–µ
–ü—Ä–∏–º–µ—á–∞–Ω–∏—è
–õ–∏—Ç–µ—Ä–∞—Ç—É—Ä–∞
–°—Å—ã–ª–∫–∏
|
Portal di Ensiklopedia Dunia













