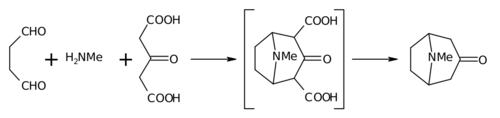
Реакция Робинсона — ШёпфаРеакция Робинсона-Шепфа — метод синтеза тропинонов и их гомологов конденсацией дикарбонильных соединений с ацетондикарбоновой кислотой и первичными аминами. Разработан Робинсоном в 1917 г. как метод синтеза тропинона конденсацией диальдегида янтарной кислоты с ацетондикарбоновой кислотой и метиламином[1] в рамках его работ по механизмам синтеза алкалоидов тропанового ряда[2]: Метод модифицирован в 1937 г. Шепфом[3]. МеханизмРеакция Робинсона-Шепфа является модификацией реакции Манниха, в которой циклическая иминиевая соль, образующаяся из янтарного диальдегида, алкилирует енольную форму ацетондикарбоновой кислоты: На первой стадии происходит конденсация альдегида с амином с образованием шиффова основания (1), которое затем претерпевает циклоконденсацию в иминиевую соль (2). Иминиевая соль, в свою очередь, атакует C-нуклеофильный центр енола ацетондикарбоновой кислоты с образованием основания Манниха (3). 2-Гидроксипиррольный фрагмент основания Манниха затем дегидратируется с образованием иминиевой соли (4), после чего происходит внутримолекулярная конденсация Манниха, в которой C-электрофильный иминиевый фрагмент атакует C-нуклеофильный центр енола (5) с замыканием пиперидинового фрагмента тропана. МодификацииВ первоначальном варианте, описанном Робинсоном, реакция проводилась в присутствии щелочи, выходы при этом были невелики, ~20 %, однако Шепф модифицировал условия реакции, проводя синтез в условиях, близких к физиологическим — при комнатной температуре и в присутствии буфера (при pH ~5.5). В современном варианте реакцию обычно проводят в водном растворе, при этом к раствору смеси ацетондикарбоновой кислоты и амина, буферизованном дигидрофосфатом или цитратом натрия, прибавляют раствор диальдегида или другого дикарбонильного соединения, после чего реакционную смесь выдерживают при комнатной температуре[4]. При необходимости декарбоксилирования первоначального продукта конденсации, реакционную смесь подкисляют соляной кислотой и проводят декарбоксилирование нагревом на паровой бане. В этих условиях выходы достигают 50-90 %[5],[4]. Реакция идет и при использовании гомологов янтарного диальдегида, при этом образуются гомологи тропинона, так, используя глутарового альдегида вместо янтарного, Мензис и Робинсон синтезировали алкалоид граната псевдопельтьерин[6]. В качестве синтетических аналогов дикарбонильных соединений могут использоваться их циклические ацетали — 2,5-диалкокситетрагидро- и 2,5-алкоксидигидрофураны вместо янтарного диальдегида и его гидроксипроизводного[7],[8] 2-этокси-3,4-дигидро-2H-пиран[5] и т. п. При проведении реакции с ацетондикарбоновой кислотой, как правило, происходит декарбоксилирование промежуточно образующихся при замыкании цикла дикарбоксильных производных, для сохранения карбоксильных фрагментов применяют защиту карбоксильных групп, вводя в реакцию эфиры ацетондикарбоновой кислоты. Так, например, при синтезе 2-карбометокситропинона, предшественника метилового эфира экгонина, использующегося в полном синтезе кокаина, в реакцию вводят моноэфир ацетондикарбоновой кислоты[4]. Синтетическое значениеРеакция Робинсона-Шепфа является первым примером сочетания ретросинтетического анализа и биомиметического подхода в планировании органического синтеза. Исследуя возможные пути биосинтеза тропановых алкалоидов, Робинсон, проанализировав структуру тропинона, пришел к выводу, что его «воображаемый гидролиз» может идти с образованием янтарного диальдегида, метиламина и ацетона — и предположил, что стратегия синтеза может быть обратной по отношению к «воображаемому гидролизу» — а именно, конденсацией этих фрагментов[1]. Эта гипотеза нашла блестящее экспериментальное подтверждение — используя ацетондикарбоновую кислоту как синтетический єквивалент ацетона с повышенной нуклеофильностью метиленовых групп, Робинсон синтезировал тропинон, ключевой предшественник в синтезе экгонина — структурной основы тропановых алкалоидов. Сама методика Робинсона — проведение одностадийного синтеза, в ходе которого осуществляется последовательность нескольких реакций, ведущих к хорошему выходу целевого продукта, в дальнейшем получила название one-pot synthesis. Реакция используется как метод синтеза полициклических гетероциклов (аминодиальдегиды), пиперидинового цикла (при использовании глутарового альдегида — синтезы лобеланина[9], пиперидонов[10], оксазолопиперидинов и дальнейшего синтеза из них кониина[11],[12] гидроазуленов[13], беталаинов[14]. Примечания
|
Portal di Ensiklopedia Dunia