Феррохелатаза
Феррохелатаза, также протопорфирин феррохелатаза или протогем ферро-лиаза (протопорфиринобразующая) — фермент (КФ 4.98.1.1) из класса лиаз, который катализирует последнюю (8-ю) реакцию биосинтеза гема — превращение молекул протопорфирина IX в гем Б. У человека фермент кодируется геном FECH, локализованный на коротком плече (p-плече) 18-й хромосомы[1]. Реакция, катализируемая данным ферментом:
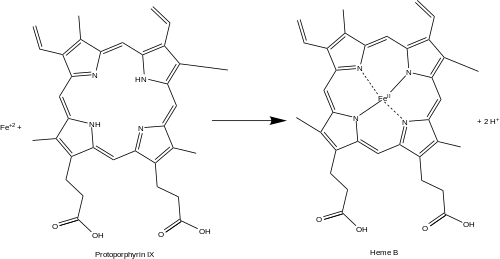 Феррохелатаза обнаруживается в больших количествах в митохондриях эритропоэтических клеток (проэритробластах, эритробластах, ретикулоцитах) и гепатоцитах печени. СтруктураФеррохелатаза человека представляет собой гомодимер, состоящий из двух полипептидных цепей, включающие 359 аминокислотных остатков. Его общая молекулярная масса составляет 85,07 кДа[2]. Каждая субъединица состоит из пяти областей: последовательности митохондриальной локализации, N-концевого домена, двух складчатых доменов и С-концевого удлинения. Остатки 1-62 образуют домен митохондриальной локализации, который расщепляется в посттрансляционной модификации. Свёрнутые домены содержат в общей сложности 17 α-спиралей и 8 β-листов. С-концевое удлинение содержит три из четырёх цистеиновых остатков (Cys-403, Cys-406, Cys-411), которые координируют каталитический железосерный кластер (2Fe-2S). Четвёртый координирующий цистеин находится в N-концевом домене (Cys-196)[3]. Активный карман феррохелатазы состоит из двух гидрофобных «губ» и гидрофильной внутренней части. Гидрофобные «губы», состоящие из высококонсервативных остатков 300—311, обращены к внутренней митохондриальной мембране и облегчают прохождение через мембрану малорастворимого субстрата протопорфирина IX и продукта гема. Внутренняя часть кармана активного центра содержит высококонсервативную кислую поверхность, которая облегчает извлечение протонов из протопорфирина. Остатки гистидина и аспартата примерно в 20 ангстремах (2 нм) от центра активного центра на стороне митохондриального матрикса фермента координируют связывание ионов металлов[3]. Механизм катализа Механизм металлирования (связывание ионов железа) протопорфирина человека остаётся в стадии изучения. Многие исследователи выдвинули гипотезу о том, что искажение макроцикла порфирина является ключом к катализу. Исследователи, изучающие феррохелатазу Bacillus subtilis, предлагают механизм введения железа в протопорфирин, при котором фермент плотно захватывает кольца B, C и D, изгибая кольцо A на 36°. Обычно кольцо А плоское и данное искажение подвергает неподелённую пару электронов азота в кольце A мигрировать к иону Fe2+[4]. Последующее исследование выявило искажение на 100° в протопорфирине, связанное с феррохелатазой человека. Высококонсервативный остаток гистидина (His-183 у B. subtilis, His-263 у человека) необходим для определения типа искажения, а также действует как исходный акцептор протона из протопорфирина[3][5]. Анионные остатки образуют путь, облегчающий отвод протонов от каталитического гистидина[3]. Фратаксин связывает железо с матриксной стороны феррохелатазы, где остатки аспартата и гистидина в обоих белках координируют перенос железа в феррохелатазу[6]. Два остатка аргинина и тирозина в активном центре (Arg-164, Tyr-165) могут осуществлять окончательное металлирование[3]. ФункцииВ процессе биосинтеза гема феррохелатаза катализирует встраивание двухвалентного железа (Fe2+) в протопорфирин IX с образованием гема Б. Фермент локализован на обращённой к матриксу стороне внутренней митохондриальной мембраны. Феррохелатаза является наиболее известным представителем семейства ферментов, которые добавляют катионы двухвалентных металлов к тетрапиррольным структурам[4]. Например, хелатаза магния добавляет магний к протопорфирину IX на первой стадии биосинтеза бактериохлорофилла[7]. Гем Б является важной простетической группой многих белков и ферментов. В частности, гем Б играет ключевую роль в качестве переносчика кислорода в гемоглобине в эритроцитах и миоглобине в мышечных клетках. Кроме того, гем Б обнаружен в цитохроме b, ключевом компоненте убихинол-цитохром с оксидоредуктазы (комплекс III) окислительного фосфорилирования[8]. Клиническое значениеДефекты феррохелатазы создают накопление протопорфирина IX, вызывая заболевание эритропоэтическую протопорфирию (ЭПП)[9]. Заболевание может быть результатом различных мутаций гена FECH, большинство из которых носят аутосомно-доминантный характер с низкой клинической пенетрантностью. Клинически у пациентов с ЭПП проявляется ряд симптомов, от бессимптомных до крайне болезненной светочувствительности. Менее чем в пяти процентах случаев накопление протопорфирина IX в печени приводит к холестазу (блокировке оттока жёлчи из печени в тонкую кишку) и терминальной печёночной недостаточности[10]. В случаях отравления свинцом происходит ингибирование активности феррохелатазы, что частично приводит к порфирии[11]. ВзаимодействияФеррохелатаза взаимодействует со многими другими ферментами, участвующими в биосинтезе, катаболизме и транспорте гема, включая протопорфириногеноксидазу, АЛК-синтазу, ABCB10, ABCB7, сукцинил-КоА-синтетазу[12] и митоферрин-1[13]. Многочисленные исследования показали существование олигомерного комплекса, который обеспечивает передачу субстрата и координацию общего метаболизма железа и порфирина по всей клетке[12][13]. N-метилмезопорфирин (N-MeMP) является конкурентным ингибитором протопорфирина IX и считается аналогом переходного состояния. Таким образом, N-MeMP широко используется в качестве стабилизирующего лиганда для определения структуры с помощью рентгеновской кристаллографии[14]. Фратаксин действует как шаперон Fe2+ и образует комплексы с феррохелатазой на стороне митохондриального матрикса[6]. Феррохелатаза также может вставлять ионы других двухвалентных металлов в протопорфирин. Некоторые ионы, такие как Zn2+, Ni2+ и Co2+, образуют другие металлопорфирины, в то время как ионы более тяжёлых металлов, такие как Mn2+, Pb2+, Hg2+ и Cd2+, препятствуют высвобождению продукта после металлирования[15]. См. такжеПримечания
|
||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia














