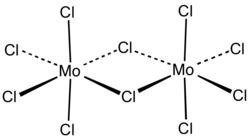
Хлорид молибдена(V) — неорганическое соединение, соль металла молибдена и соляной кислоты с формулой MoCl5, чёрные гигроскопичные кристаллы, реагирует с водой.
–ü–æ–ª—É—á–µ–Ω–∏–µ
- –Ý–µ–∞–∫—Ü–∏—è –ø–æ—Ä–æ—à–∫–æ–æ–±—Ä–∞–∑–Ω–æ–≥–æ –º–æ–ª–∏–±–¥–µ–Ω–∞ –∏ —Ö–ª–æ—Ä–∞:


–§–∏–∑–∏—á–µ—Å–∫–∏–µ —Å–≤–æ–π—Å—Ç–≤–∞
Хлорид молибдена(V) образует чёрные гигроскопичные кристаллы моноклинной сингонии, пространственная группа C 2/m, параметры ячейки a = 1,731 нм, b = 1,781 нм, c = 0,6079 нм, β = 95,7°, Z = 12.
–Ý–∞—Å—Ç–≤–æ—Ä—è–µ—Ç—Å—è –≤ –¥–∏—ç—Ç–∏–ª–æ–≤–æ–º —ç—Ñ–∏—Ä–µ, —Å–ø–∏—Ä—Ç–∞—Ö, —Ç–µ—Ç—Ä–∞—Ö–ª–æ—Ä–º–µ—Ç–∞–Ω–µ, —Ö–ª–æ—Ä–æ—Ñ–æ—Ä–º–µ, –¥–∏—Ö–ª–æ—Ä—ç—Ç–∞–Ω–µ.
–•–∏–º–∏—á–µ—Å–∫–∏–µ —Å–≤–æ–π—Å—Ç–≤–∞
- При сильном нагревании (в пара́х) в инертной атмосфере разлагается:

- –Ý–µ–∞–≥–∏—Ä—É–µ—Ç —Å –≤–ª–∞–≥–æ–π –≤–æ–∑–¥—É—Ö–∞:

- –Ý–µ–∞–≥–∏—Ä—É–µ—Ç —Å –≤–æ–¥–æ–π:
![{\displaystyle {\mathsf {2MoCl_{5}+5H_{2}O\ {\xrightarrow {}}\ MoO(OH)_{3}\downarrow +H_{2}[MoCl_{5}O]+5HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f46c9955a3bd638b8a3bf3f49f5a9bf2785a3847)









–ü—Ä–∏–º–µ–Ω–µ–Ω–∏–µ
- –ü–æ–ª—É—á–µ–Ω–∏–µ –ø–æ—Ä–æ—à–∫–æ–≤ –º–æ–ª–∏–±–¥–µ–Ω–∞.
- –ù–∞–Ω–µ—Å–µ–Ω–∏–µ –ø–æ–∫—Ä—ã—Ç–∏—è –º–æ–ª–∏–±–¥–µ–Ω–∞ –Ω–∞ –Ω–µ–º–µ—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏–µ –ø–æ–≤–µ—Ä—Ö–Ω–æ—Å—Ç–∏.
–õ–∏—Ç–µ—Ä–∞—Ç—É—Ä–∞
- –•–∏–º–∏—á–µ—Å–∫–∞—è —ç–Ω—Ü–∏–∫–ª–æ–ø–µ–¥–∏—è / –Ý–µ–¥–∫–æ–ª.: –ö–Ω—É–Ω—è–Ω—Ü –ò.–õ. –∏ –¥—Ä.. ‚Äî –ú.: –°–æ–≤–µ—Ç—Å–∫–∞—è —ç–Ω—Ü–∏–∫–ª–æ–ø–µ–¥–∏—è, 1992. ‚Äî –¢. 3. ‚Äî 639 —Å. ‚Äî ISBN 5-82270-039-8.
- –°–ø—Ä–∞–≤–æ—á–Ω–∏–∫ —Ö–∏–º–∏–∫–∞ / –Ý–µ–¥–∫–æ–ª.: –ù–∏–∫–æ–ª—å—Å–∫–∏–π –ë.–ü. –∏ –¥—Ä.. ‚Äî 3-–µ –∏–∑–¥., –∏—Å–ø—Ä. ‚Äî –õ.: –•–∏–º–∏—è, 1971. ‚Äî –¢. 2. ‚Äî 1168 —Å.
- –õ–∏–¥–∏–Ω –Ý.–ê. –∏ –¥—Ä. –•–∏–º–∏—á–µ—Å–∫–∏–µ —Å–≤–æ–π—Å—Ç–≤–∞ –Ω–µ–æ—Ä–≥–∞–Ω–∏—á–µ—Å–∫–∏—Ö –≤–µ—â–µ—Å—Ç–≤: –£—á–µ–±. –ø–æ—Å–æ–±–∏–µ –¥–ª—è –≤—É–∑–æ–≤. ‚Äî 3-–µ –∏–∑–¥., –∏—Å–ø—Ä. ‚Äî –ú.: –•–∏–º–∏—è, 2000. ‚Äî 480 —Å. ‚Äî ISBN 5-7245-1163-0.
- –Ý–∏–ø–∞–Ω –Ý., –ß–µ—Ç—è–Ω—É –ò. –ù–µ–æ—Ä–≥–∞–Ω–∏—á–µ—Å–∫–∞—è —Ö–∏–º–∏—è. –•–∏–º–∏—è –º–µ—Ç–∞–ª–ª–æ–≤. ‚Äî –ú.: –ú–∏—Ä, 1972. ‚Äî –¢. 2. ‚Äî 871 —Å.
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 352 с.




![{\displaystyle {\mathsf {2MoCl_{5}+5H_{2}O\ {\xrightarrow {}}\ MoO(OH)_{3}\downarrow +H_{2}[MoCl_{5}O]+5HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f46c9955a3bd638b8a3bf3f49f5a9bf2785a3847)






















