Геометрија молекула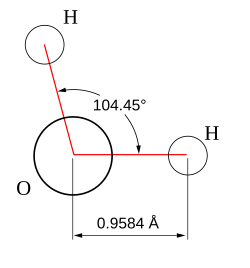 Молекуларна геометрија или молекуларна структура је три-димензионо уређење атома који сачињавају молекул. Она условљава низ особина супстанце међу којима су реактивност, поларност, фаза материје, боја, магнетизам, и биолошка активност.[1][2] Експерименталне методе Чак и најбољи електронски микроскопи нису у стању да покажу изглед молекула већ само обрисе и то само огромних молекула као што су протеини. Ипак постоје методе помоћу којих се може одредити тј. предвидети геометрија молекула само уз помоћ структурне формуле. Најједноставнија метода за предвиђање просторног облика хемијских једињења јесте она која користи правило о одбијању валентних електронских парова. По овој методи распоред електронских парова у највишем електронском нивоу око централног атома одређује просторни облик молекула. Електрони су негативно наелектрисане честице, што узрокује распоред у коме су они најудаљенији један од другог. Кад растојање буде највеће, одбијање ће бити најмање, те ће молекул бити најстабилнији. Распоред валентних електронских парова зависи од њиховог броја. Нпр. код метана (CH4) четири електронска пара најмање ће се одбијати ако се налазе на ивицама правилног тетраедра. Код једињења са 3 електронска пара (нпр. BF3) молекул је најстабилнији када се парови налазе под угловима од 120°; распоред је у једној равни. Ако је централни атом окружен великим бројем валентних електронских парова молекул може да има веома различите облике. Разматрање просторног распореда атома у молекулу је веома комплексан део хемије и њиме се бави засебна дисциплина - стереохемија. Динамичка стереохемија податке добијене о просторном распореду користи за предвиђање понашања тих молекула у хемијским реакцијама, што је од посебног значаја за органске реакције у органзму које су веома стереоспецифичне. Молекуларна геометрија може бити одређена разним спектроскопским и дифракционим методима. IR, микроталасна и Раманова спектроскопија могу да произведу информације о молекулској геометрији из детаља детектованих вибрационих и ротационих апсорбанци. Кристалографија, неутронска дифракција и електронска дифракција могу да произведу молекуларну структуру кристала на бази растојања између језгра и концентрације електронске густине. Гасна електронска дифракција се може користити за мале молекуле у гасној фази. НМР и FRET методи се могу користити за одређивање комплементарних информација као што су релативна растојања,[3][4][5] диедрални углови,[6][7] углови веза, и повезаност. Ниже температуре су подесније за одређивање молекуларне геометрије, јер су вишим температурама оне средње вредности доступних геометрија. Већи молекули се често јављају у више стабилних геометрија (конформациони изомеризам) са сличним енергетским нивоима на површини потенцијалне енергије. Геометрије се исто тако могу израчунати користећи ab initio квантум хемијски методе до високе прецизности. Молекуларна геометрија може да се буде различита у чврстој, течној, и гасовитој фази. ИзомериИзомери су типови молекула који имају исту хемијску структуру али различите геометрије, последица чега су веома различите особине:
Типови молекулске структуреПостоји шест основних типова молекула
VSEPR табелаУглови веза у следећој табели су идеални углови из једноставне VSEPR теорије. Њима следе стварни углови за дате примере, уколико се они разликују. У многим случајевима, као што је тригонални пирамидални и повијени, стварни угао примера се разликује од идеалног угла. Угао у H2S (92°) се разликује од тетраедралног угла много више, него што је то случај за H2O (104.5°) угао.
3D Репрезентације
Референце
Литература
Спољашње везе |
Portal di Ensiklopedia Dunia