Рак грлића материце
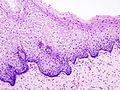
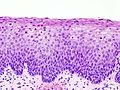
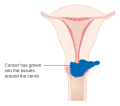
Рак грлића материце, карцином грлића материце, цервикални карцином је експанзивни (злоћудни) туморски процес ћелија грлића лоциран у доњем делу материце, који ако се правовремено не дијагностикује и лечи може бити смртоносан. Најчешћи облик овог тумора је карцином. Са преко 1300 новооболелих и приближно 500 умрлих жена годишње, рак грлића материце је други водећи узрок оболевања и четврти узрок умирања од рака међу женском популацијом Србије. Болест је проузрокована одређеним типовима гениталног хуманог папиломавируса (ХПВ), који се углавном преноси сексуалним контактом. ХПВ је доста распрострањен и лако се шири. Док већина заражених жена ХПВ-ом оздрави у периоду од 6 до 24 месеци, а најчешће није знала за инфекцију, код других жена (због имунодефицијенције њиховог имунског систем) повећан је ризик да ХПВ доведе до појаве рака грлића материце. АнатомијаВрат материце (лат. cervix uteri) је њен доњи, цилиндрични део који се наставља на труп материце (лат. corpus uteri). Спољна страна цервикса (лат. exocervix), која штрчи у лумен вагине, као и сама материца обложена је вишеслојним плочастим епителом, док је унутрашња страна цервикса (лат. endocervix) обложена једнослојним цилиндричним епителом.[1] Место, у којем вишеслојни плочасти епител егзоцервикса прелази у једнослојни цилиндрични епител ендоцервикса, носи назива сквамоколумнарна граница (СКГ). У зависности од тренутног хормонског статуса и животне доби, положај сквамоколумнарне границе се мења.[2] У хормонски неактивним периодима (детињство и постменопауза) СКГ налази се дубље у цервикалном каналу, док је у хормонски активним периодима (новорођеначки период живота, пубертет, генеративни период живота, трудноћа и код жена које узимају оралне хормонске контрацептиве) СКГ померена ниже, ван цервикалног канала.[2] Када је сквамоколумнарна граница померена ниже, једнослојни цилиндрични епител који је осетљивији, на утицај ниског пХ у вагини замењује се отпорнијим, метапластичне плочастим епителом. Зато се на егзоцервиксу могу уочити две сквамоколумнарне границе и зона преображаја:
Како је незрели метапластичне плочасти епител осетљив на деловање разних онкогених фактора цервикална интраепителна неоплазија (CIN) у највећем броју случајева почиње као жариште у зони преображаја.  Епидемиологија
Рак грлића материце трећи је по учесталости малигни тумор у свету и са више од пола милиона нових случајева годишње, чини 8,8% свих случајева рака у жена. Већина случајева (око 80%) открива се у мање развијеним регионима света, где је просечна стандардизована стопа инциденције 17.7 на 100,000 жена, што је скоро двоструко више него у развијенијим регионима где она износи 9.1 на 100 000 жена.[4][5] У складу са бројем оболелих жена највећи број смртних случајева од рака грлића материце дешава се у мање развијеним регионима, у којима је према узрасним-стандардизованим стопе смртности 2,8 пута виша (9,7 на 100.000) него у развијеним деловима света (2.7 на 100,000).[6]
Србија је 2002. године имала највећу инциденцију рака грлића материце (27,3 на 100.000) у Европи, у којој је инциденца 10,6 на 100.000 жена. Према последњим подацима Globocan-a, Србија је у првим деценијама 21. века на петом месту по инциденцији са 24,1 случаја на 100.000 жена), одмах иза Румуније, Македоније, Бугарске и Литваније. После карцинома дојке, рак грлића материце је у Србији на другом месту свих новооткривених случајева канцера у жена. У Војводини он је заступљен у 7,2% а у централној Србији у 8,7% свих новооткривених случајева канцера у жена.
Бројни истраживањима утврђено је да су лимфни чворовии једини значајан независтан фактор општег преживљавања.[7]
Ризичне групе женаЖене које имају повишен ризик за настанак рака грлића материце су:[10]
С обзиром да је ХПВ вирус толико распрострањен веома је тешко спречити ХПВ инфекцију, са бројним сексуалним партнерима јер су готово све одрасле особе имале ХПВ инфекцију некада у свом животу, осим уколико никада нису имале сексуалне односе или су имале сексуалне односе само са једном особом која такође није имала друге партнере у свом животу.
Код већине жена које су заражене ХПВ вирусом од сексуалних партнера, имуни систем ће у току 6-24 месеца створити антитела и савладати вирусну инфекцију. Међутим мали број жена ипак не успе да победи инфекцију и ове жене имају повећан ризик да касније у току живота оболе од рака на грлићу материце. Употреба кондома веома је ефикасна заштита од других полних инфекција, али није толико сигурна заштита од ХПВ вируса. Објашњење за то је да се ХПВ може наћи и на кожи гениталија која није покривена кондомом, па се тако вирус може пренети сваким додиром коже са кожом.
Велики број студија је испитивао утицај пушења на настанак абнормалности у ћелијама грлића материце и њихово погоршавање до рака. Показано је да пушачи имају нешто више од два пута већи ризик за настанак рака грлића материце у поређењу са женама које никада нису пушиле.
Рак грлића материце неће се развити уколико нема дуготрајне ХПВ инфекције, јер се имуни систем већине особа, избори против ХПВ инфекције у року од 24 месеца. Било шта што слаби имуни систем, као што је хемиотерапија или ХИВ инфекција, трансплантација жене које су имале трансплантацију органа или које су из различитих разлога примале имуносупресиве, може одложити или спречити елиминацију ХПВ и повећати ризик за настанак рака грлића материце.
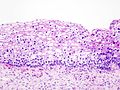
ЕтиопатогеназаЦервикална интраепителна неоплазија (CIN)Рак грлића материце у свом развојном процесу пролази кроз низ промена цервикалног епитела које носе назив цервикалне интраепителне неоплазије (CIN). У прошлости за ове промене коришћен је назив дисплазија/карцином ин ситу. После увођења Бетезда (Bethesda) цитолошке класификације, CIN промене се сврставају у једну од група сквамозних интраепителних лезија (SIL). У складу са хистолошким изменама у епителу и дебљине захваћеног епитела, цервикална интраепителна неоплазија разврстана је у градуса 1, 2 и 3 (CIN 1, CIN 2 и CIN3 ). Упоредни систем класификације премалигних промена грлића материце
У малобројним популационим епидемиолошким студијама о цервикалним интраепителним неоплазијама (CIN 1—3), наводи се да су, за све степене дисплазије, стандардизоване стопе инциденције 195 на 100.000 жена а 38 на 100.000 за жене са најтежим обликом, CIN 3 (карциномом in situ).  Хистопатолошка класификација малигних тумора грлића материцеСветска здравствена организација дефинисала је три категорије епителијалних тумора грлића материце: сквамозне, гландуларне (аденокарцином) и остале епителијалне туморе укључујући неуроендокрине туморе и недиферентован карцином. Хистопатолошка класификација СЗО 2004 која се примењује за одређивање хистолошког типа малигних тумора грлића материце.[11]
ЕтиологијаИнфекција хуманим папилома вирусом (ХПВ) сматра се доминантним фактором ризика и неопходним условом за настанак и развој рака грлића материце. Делови овог вируса (из фамилије паповавирида), откривен је у 99,7% случајева рака грлића материце. До данас, идентификовано је више од 120 типова хуманих папилома вируса, од којих се око 40 типова преноси сексуалним путем и доводе до инфекције полних органа и аногениталне регије мушкараца и жена. До сада је истражено да инфекција различитим типовима ХПВ не носи исти ризик за настанак малигне трансформације. Због тога су аногенитални типови ХПВ на основу своје специфичне удружености са појединим типовима лезија подељени у две групе тзв. „онкогеног ризика”:
У ову групу спадају ХПВ типови 6, 11, 42, 43, 44. Они су најчешће повезани са бенигним променама као што су кондиломи који ретко малигно алтерирају.[12][13]
У ову групу спадају ХПВ типови 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59. Најчешће присутни типови високог ризика ХПВ16 и/или ХПВ18 присутни су у 52% цитолошки детектованих CIN II лезија, 61% CIN III и 71—76% инвазивних карцинома. Како ХПВ тип 16 није специфичан он се може наћи у жена са CIN I и у жена са уредним Папаниколау тестом.[14] Период инкубације вируса креће се од неколико недеља до више месеци. Улазећи у слузокожу или кожу кроз микроабразије настале током полног односа, вирус највероватније прво инфицира или базалне ћелије или примитивне ћелије незрелог плочасто-слојевитог епитела, које личе на базалне ћелије. Код већине жена инфицираних хуманим папилома вирусом, имуни систем ће у току 6-24 месеца створити антитела и савладати вирусну инфекцију. До спонтаног нестанка инфекције долази у око 85-90% случајева, што потврђује и ниска преваленца латентне инфекције ХПВ у жена старијих од 30 година (преваленца типова високог ризика у жена 30‒65 година креће се од 1,7% у Шпанији до 12,5% у Белгији). Код малог броја жена инфекција перзистира (10‒15%) и то се углавном дешава када је она изазвана типовима ХПВ високог ризика. У 8% жена са позитивним налазом ХПВ високог ризика током четири године праћења појави CIN, док се код оних код којих нема инфекције ХПВ типовима високог ризика CIN јавља само у 0,05% случајева. Ризик за прогресију ХПВ 16/18 инфекције до хистолошки јасног CIN 1, током године дана је 9,3%. Ризик за прогресију током истог периода у CIN2 је 5,8%, а у CIN3 3,5%. Стадијуми у развоју рака грлића материцеСтадијума у развоју малигних тумора и њихово одређивање помаже у планирању терапијских поступака, омогућава поређење резултата лечења и указује на могућу прогнозу. Стадијум болести може се одредити клинички, хируршки и патолошки. Према препорукама Интернационалног удружења гинеколога и опстетричара (FIGO) одређивање стадијума карцинома грлића материце, заснива се на клиничкој евалуацији болести, пре отпочињања лечења. „Стадијум болести који се одреди на основу клиничког прегледа касније не подлеже променама, нити због додатних дијагностичких процедура, нити као последица лечења или прогресије болести.” У циљу постављања дијагнозе карцинома грлића и одређивања стадијума користе се: клиничке, цитолошке, хистопатолошке, радиолошке, лабораторијске и друге дијагностичке методе.
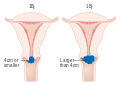
FIGO систем стадирања карцинома грлића материце, 2009Са налазима свих потребних прегледа, рак грлића материце се сврстава у један од стадијума болести одређених FIGO класификацијом, на следећи начин:
Карцином је стриктно ограничен на грлић (ширење на корпус не треба да буде узето у обзир)
Карцином грлића који врши инвазију изван утеруса, али не на пелвични зид, нити на доњу трећину вагине.
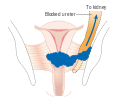
Тумор се шири до пелвичног зида и/или захвата доњу трећину вагине и/или доводи до хидронефрозе или нефункционалног бубрега.
Карцином се проширио изван мале карлице и захватио је (доказано биопсијом) мукозу бешике или ректума. Булозни едем, сам по себи, не дозвољава да се случај означи стадијумом IV
Клиничка сликаРак грлића материце развија се веома споро и у већини случајева потребно је 8 до 10 година да из фазе премалигне промене болест пређе у инвазивни карцином. Током тог времена, ни премалигне промене ни почетни карцином не дају никакве симптоме. Када се рак грлића материце прошири, обично даје следеће симптоме:[15]
Вагинално крвављење је најчешћи симптом који се јавља код жена са узнапредовалим инвазивним карциномом грлића. Најчешће је то посткоитално крвављење, али се може појавити и као ирегуларно интерменструално или постменопаузно крвављење. Крвављења, која настају из туморских крвних судова могу некада бити тако јака и изненадна да су неопходне трансфузије како би се побољшало опште стање болеснице. Оваква крвављења настају после повреде новостворених туморских крвних судова, током односа, приликом прегледа, узимања узорка ткива за хистопатолошки преглед или спонтаним одвајањем некротичних туморских маса. Уколико је присутно дуготрајно крварење слабијег интензитета, болесница се може жалити на слабост, малаксалост, поспаност или друге симптоме који су последица постхеморагијске анемије.
Овај секрет је изразито појачан и непријатног је мириса.
Бол у малој карлици или хипогастријуму обично је последица некрозе тумора или удружене пелвичне инфламаторне болести. Неке болеснице могу се жалити на бол у лумбосакралној (леђној) или глутеалној (седалној) регији због захваћености илијачних или парааортних лимфних чворова са ширењем рака на лумбосакралне корене спиналних нерава или појаве бубрежне хидронефрозе. Понекад епигастрични бол или бол у леђима могу бити последица метастаза рака у парааортне лимфне чворове.
Хематурија и ректално крварење могу се појавити у каснијим стадијумима болести, као последица инвазије тумора у бешику или ректум.
Ако је болест узнапредовала, присутне су и остале одлике малигне болести:
Дијагноза
ТерапијаОсновне методе које се примењују у лечењу рака грлића материце су хирургија, радиотерапија и хемиотерапија. Могуће су различите комбинације ових метода, као и различити временски распоред њихове примене. Која же се врсти лечења применити у конкретном случају одлучује се на основу стадијума болести, хистолошких особина тумора, година старости болеснице и њеног општег здравственог стања. Коначну одлуку о врсти терапије доноси конзилијум (мултидисциплинарни тим) лекара у који треба да буду укључени: гинеколог-онколог, патолог, радиотерапеут, медикални онколог и радиодијагностичар. РадиотерапијаРадиотерапија рака грлића материце је примарна радикална зрачна терапија која се изводи применом спољашњег зрачења (које може бити транскутано и брахитерапије). Досадашња сазнања о усавршеним техникама зрачења, посебно оних заснованих на чешћој примени брахитерапије, говоре о побољшању у локалној контроли раста тумора односно смањењу стопе рецидива и продуженом преживљавању болесница.[16][17] ХемиотерапијаХемиотерапија (хемотерапија) рака грлића материце је метода лечења која се заснива на употреби системских лекова који се преносе путем крвотока кроз цело тело, са циљем да се убију малигне ћелије. Иако се карцином грлића материце традиционално сматрао хемиорезистентном болешћу, нова сазнања указују да он испољава и хемиосензитивности. У том смислу примене хемиотерапије у узнапредовалим или рекурентним облицима карцинома грлића материце још увек се испитује у све већем броју клиничких студија. Хируршка терапија
ПревенцијаРак грлића материце је болест која се може спречити, и нема оправдања за то што свакога дана у свету велики број жена умре од рака грлића материце. Са обзиром да су принципи превенције, поступци раног дијагностиковања и начин лечења рака грлића материце добро познати, велика смртност је пре свега последица, недовољно јасна систематизација ових принципа, недовољно успостављене контроле квалитета свих поступака неопходних у дијагностици и лечењу, због чега постоје јасне разлике у квалитету помоћи коју пружају поједини тимови и поједини центри. У том смислу да би била обезбеђена добра контрола болести, сви делови система укључених у тај процес морају функционисати истовремено и паралелно. Види јошРеференце
Литература
Спољашње везе
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia