இரும்பு(III) ஆக்சைடு
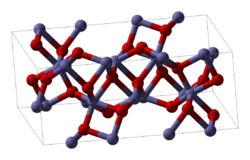
இரும்பு(III) ஆக்சைடு (Iron(III) oxide) என்பது Fe2O3 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். பெர்ரிக் ஆக்சைடு என்ற பெயராலும் இது அழைக்கப்படுகிறது. இரும்பினுடைய மூன்று முக்கியமான ஆக்சைடுகளில் இதுவும் ஒன்றாகும். இரும்பு(II) ஆக்சைடு (FeO) மற்றும் இரும்பு(II,III) ஆக்சைடு (Fe3O4) என்பவை ஏனைய இரண்டு ஆக்சைடுகளாகும். மேக்னடைட்டு என்ற கனிமமாக இவையும் இயற்கையில் கிடைக்கின்றன. ஏமடைட்டு (Fe2O3) என்று அறியப்படும் கனிமம் இரும்புத் தொழிற்சாலைகளில் இரும்பைத் தயாரிக்க உதவும் முக்கியமான மூலமாகும். ஏமடைட்டு எளிதில் அமிலங்களால் தாக்கப்படுகிறது. இரும்பு(III) ஆக்சைடு பெரும்பாலும் துரு என்று அழைக்கப்படும். சில நிகழ்வுகளில் துரு மிகுந்த பயனளிப்பதாக உள்ளது. ஏனெனில் இதன் இயைபு பல பண்புகளை பகிர்ந்து கொள்ள பயன்படுகிறது. கட்டமைப்புFe2O3 சேர்மத்தை பல்வேறு பல்லுருக்களில் பெறமுடியும். α மற்றும் γ நிலைகள் இவற்றில் முக்கியமானவையாகும். இங்கு இரும்பு எண்முக ஒருங்கிணைவு வடிவத்தை ஏற்கிறது, அதாவது இதன் கட்டமைப்பில் ஒவ்வொரு இரும்பு அணு மையமும் ஆறு ஆக்சிசன் ஈந்தனைவிகளால் சூழப்பட்டிருக்கும். ஆல்பா நிலைமிகப் பொதுவான வடிவமான ஆல்பா- Fe2O3 சாய்சதுர குருந்தம் (α-Al2O3) கட்டமைப்பில் இருக்கும். இயற்கையில் ஏமடைட்டு என்ற கனிமமாகத் தோன்றும் ஆல்பா நிலை இரும்பு (III) ஆக்சைடே இரும்பினுடைய முக்கியமான கனிமமாகக் கருதப்படுகிறது. ~260 கெல்வின் என்ற மோரின் நிலைமாற்ற வெப்பநிலைக்குக் கீழ் எதிர்பெர்ரோகாந்தப் பண்பையும், மோரின் நிலைமாற்ற வெப்பநிலை 260 கெல்வின் மற்றும் நீல் நிலைமாற்ற வெப்பநிலையான 950 கெல்வின் இரண்டுக்குமிடையில் பலவீனமான பெர்ரோகாந்தப்பண்பையும் இந்நிலை வெளிப்படுத்துகிறது. நீர்ம நிலையில் வெப்பச் சிதைவு மற்றும் வீழ்படிவாக்கல் என்ற இரண்டு முறைகளைப் பயன்படுத்தியும் இதை தயாரிப்பது எளிதாகும். அழுத்தம், துகள் அளவு மற்றும் காந்தப்புல தீவிரம் போன்ற காரணிகளைப் பொறுத்து இதன் காந்தப்பண்புகள் அமைகின்றன.[9] காமா-இரும்பு (III) ஆக்சைடுகாமா-இரும்பு (III) ஆக்சைடு கனசதுரப் படிகக் கட்டமைப்பில் இருக்கும். சிற்றுறுதியை கொண்டுள்ள இந்நிலை இரும்பு (III) ஆக்சைடை உயர் வெப்பநிலைகளில் ஆல்பா நிலையிலிருந்து மாற்றுவதன் மூலம் பெறமுடியும். இயற்கையில் மேகெமைட்டு என்ற கனிமமாக இது தோன்றுகிறது. பெர்ரோகாந்தப் பண்பை கொண்டிருப்பதால் பதிவு நாடாக்களில் காமா-இரும்பு (III) ஆக்சைடு பயன்படுகிறது [10]. மீச்சிறிய 10 நானோமீட்டருக்கும் குறைவான அளவுள்ள துகள்கள் சிறப்புபாராகாந்தப் பண்பை வெளிப்படுத்துகின்றன. காமா-இரும்பு (III) ஆக்சைடு-ஐதராக்சைடை நீர் நீக்க வினைக்கு உட்படுத்தி காமா நிலை இரும்பு (III) ஆக்சைடை தயாரித்துக் கொள்ளலாம். இரும்பு (II,III) ஆக்சைடை (Fe3O4) கவனமாக ஆக்சிசனேற்றம் செய்தும் மற்றொரு முறையில் இதைத் தயாரிக்கலாம்.[10] இரும்பு (III) ஆக்சலேட்டு சேர்மத்தை வெப்பச் சிதைவுக்கு உட்படுத்தினால் மீநுண் துகள்கள் கிடைக்கும். பிற நிலைகள்ஆல்பா, காமா நிலைகளை தவிற வேறு பல இரும்பு(III) ஆக்சைடு கட்டங்களும் அடையாளம் காணப்பட்டுள்ளன அல்லது உரிமை கோரப்பட்டுள்ளன. பீட்டா நிலை கனசதுர உடல் மைய இடக்குழு Ia3 உடன் சிற்றுறுதியுடன் காணப்படுகிறது. 500 ° செல்சியசு வெப்பநிலைக்கும் (930 ° பாரன்கைட்டு) அதிகமான வெப்பநிலையில் இது ஆல்பா நிலைக்கு மாறுகிறது. ஏமடைட்டு கனிமத்தை கார்பன் உபயோகித்து ஒடுக்குதல் மூலமும், இரும்பு(III) குளோரைடு கரைசலை வெப்பச் சிதைவுக்கு உட்படுத்தியும், இரும்பு(III) சல்பேட்டை வெப்பம் சார்ந்த சிதைவுக்கு உட்படுத்தியும் இதை தயாரிக்கலாம். எப்சிலான் நிலை ஒரு சாய்சதுரமாகும். ஆல்பா மற்றும் காமா நிலைகளுக்கு இடையேயான இடைநிலைப் பண்புகளை இது காட்டுகிறது, பயனுள்ள காந்த பண்புகளைக் கொண்டிருக்கிறது. ஆல்பா மற்றும் காமா நிலைகளுடன் சேர்ந்து மாசுபட்டிருப்பதால் தூய எப்சிலான் நிலையைத் தயாரிப்பது மிகவும் சவாலானது என்று நிருபிக்கப்பட்டுள்ளது. காமா கட்டத்தின் வெப்ப நிலைமாற்ற வினையால் எப்சிலன் நிலை அதிக விகிதத்துடன் கூடிய பொருளை தயாரிக்க முடியும். எப்சிலான் நிலையும் சிற்றுறுதி நிலையாகும். இது ஆல்பா நிலைக்கு 500 முதல் 750 ° செல்சியசு வரையிலான (930 மற்றும் 1,380 ° பாரன்கைட்டு) வெப்பநிலையில் மாறுகிறது. கூடுதலாக உயர் அழுத்தத்தில் படிக உருவமற்ற நிலை ஒன்றும் கிடைக்கிறது[5]. சமீபத்திய ஆராய்ச்சிகள் பண்டைய சீன யியான் பீங்கான் மெருகூட்டுகளில் எப்சிலான் இரும்பு(III) ஆக்சைடு இருப்பதை வெளிப்படுத்துகின்றன. இது ஆய்வகத்தில் அந்த வடிவத்தை உருவாக்குவதற்கான வழிகளைப் பற்றிய நுண்ணறிவை வழங்கக்கூடும்[11] நீரேறிய இரும்பு(III) ஆக்சைடுகள்இரும்பு(III) ஆக்சைடு பல நீரேற்று வடிவங்களில் காணப்படுகிறது. கரையக்கூடிய Fe(III) உப்புகளின் கரைசல்களில் காரம் சேர்க்கப்படும் போது செம்-பழுப்பு நிற பசைத்தன்மை வீழ்படிவு உருவாகிறது. இது Fe(OH)3 ஐதராக்சைடு வடிவம் அல்ல. Fe2O3•H2O நீரேற்று ஆகும். இதை Fe(O)OH) என்றும் எழுதலாம். Fe(III) ஆக்சைடின் பல நீரேற்று வடிவங்களும் அறியப்படுகின்றன. சிவப்பு லெபிடோகுரோசைட்டு γ-Fe(O)OH துருவுக்கு வெளிப்புறத்தில் தோன்றுகிறது. ஆரஞ்சு கோயிதைட்டு துருவுக்கு உட்புறத்தில் தோன்றுகிறது. Fe2O3•H2O நீரேற்றை சூடாக்கும்போது இது நீரை இழக்கிறது. மேலும் 1670 கெல்வின் வெப்பநிலைக்கு சூடாக்கினால் கருப்பு நிற மேக்னடைட்டு (Fe3O4 (FeIIFeIII2O4)) கனிமமாக மாற்றப்படுகிறது. Fe(O)OH அமிலங்களில் கரைந்து [Fe(H2O)6]3+ அயனியையும், காரங்களில் கரைந்து [Fe(OH)6]3− அயனியையும் கொடுக்கிறது[10]. வினைகள்கார்போ வெப்ப ஒடுக்க வினை இரும்பு(III) ஆக்சைடின் முக்கியமான வினையாகும். இதனால் உருவாகும் இரும்பு எஃகு தயாரித்தலுக்குப் பயன்படுகிறது.
அலுமினியத்துடன் இரும்பு(III) ஆக்சைடு ஈடுபடும் வெப்ப உமிழ்வு அனல் வினை மற்றொரு முக்கியமான ஏற்ற ஒடுக்க வினையாகும்.[12]
இந்த செயல்முறை இரயில் தடங்களின் தண்டவாளங்கள் போன்ற தடிமனான உலோகத்திற்கு இடையில் உருகிய இரும்பை பீங்கான் கொள்கலனைப் பயன்படுத்தி இரண்டு கம்பிகளுக்கு இடையில் வைக்கப் பயன்படுத்தப்படுகிறது. மேலும் ஆயுதங்கள் மற்றும் சிறிய அளவிலான வார்ப்பிரும்பு சிற்பங்கள் மற்றும் கருவிகளை உருவாக்க இத்தயாரிப்பு பயனாகிறது. ஐதரசனுடன் சேர்ந்து 400 பாகை செல்சியசு வெப்பநிலையில் பகுதியாக ஒடுங்கும்போது கருப்பு நிறமான மேக்னடைட்டு கனிமம் உருவாகிறது. இக்கனிமத்தில் Fe(III) மற்றும் Fe(II) இரண்டு வகைகளும் காணப்படுகின்றன.:[13]
இரும்பு(III) ஆக்சைடு நீரில் கரையாது. ஆனால் வலிமையான அமிலங்களில் உடனடியாக கரையும். ஆக்சாலிக் அமிலம் போன்ற இடுக்கி இணைப்பிற்குள்ளாகும் அமிலக் கரைசல்களிலும் கரையும். கார்பனேட்டுகள் அல்லது பிற உலோக ஆக்சைடுகளுடன் இரும்பு(III) ஆக்சைடு வினை புரிகையில் பெர்ரேட்டுகள் உருவாகின்றன.:[13]
தயாரிப்புஇரும்பு ஆக்சிசனேற்றம் அடைவதால் இரும்பு(III) ஆக்சைடு உருவாகிறது. இரும்பு நேர்மின் முனையுடன் சோடியம் பைகார்பனேட்டு உபயோகித்து மின்னாற்பகுப்பு செய்து இரும்பு(III) ஆக்சைடு உருவாகிறது.
விளைபொருளாக உருவாகும் நீரேறிய இரும்பு(III) ஆக்சைடு FeO(OH) என்று எழுதப்படுகிறது.[13][14]
பயன்கள்இரும்புத் தொழிற்சாலைகளில்இரும்பு(III) ஆக்சைட்டின் அதிகப்படியான பயன்பாடு எஃகு மற்றும் இரும்புத் தொழில்களின் மூலப்பொருளாக இருப்பதாகும். எ.கா. இரும்பு, எஃகு மற்றும் பல உலோகக் கலவைகள் இதிலிருந்து உற்பத்தியாகின்றன[14]. மெருகூட்டல்பெர்ரிக் ஆக்சைட்டின் மிக நுண்ணிய தூள் ஆபரண மெருகூட்டலுக்குப் உலோக நகைகள் மற்றும் வில்லைகள் மீது இறுதி மெருகூட்டல் மற்றும் வரலாற்று ரீதியாக ஒரு அழகுசாதனப் பொருளாக பயன்படுகிறது. தூள், பசை, திண்ம பட்டை வடிவங்களில் இது விற்பனைக்குக் கிடைக்கிறது. நிறமிகள்பழுப்பு நிறமி 6. பழுப்பு நிறமி 7, பழுப்பு நிறமி 101 என்ற பெயர்களில் இரும்பு(III) ஆக்சைடு ஒரு நிறமியாகப் பயன்படுத்தப்படுகிறது [15]. பழுப்பு நிறமி 6, பழுப்பு நிறமி 101 இரண்டையும் அழகியல் பொருளாகப் பயன்படுத்த அமெரிக்க உணவு மற்றும் மருந்து நிர்வாக அமைப்பு அங்கீகாரம் கொடுத்துள்ளது. தைட்டானியம் ஆக்சைடுகளுடன் சேர்ந்து இரும்பு ஆக்சைடுகளும் பற்கள் தொழிலில் நிறமியாகப் பயன்படுகிறது [16]. சுவீடிய சாயமான பாலு சிவப்பில் ஏமடைட்டு ஒரு அடையாளக் கூறாகும். காந்தப் பயன்பாடுஇரும்பு (III) ஆக்சைடு என்பது ஒரு பொதுவான காந்தத் துகள் ஆகும். தரவுகள் சேமிப்பு, ஒளி, ஒலி பதிவு உள்ளிட்ட அனைத்து வகையான காந்த சேமிப்பு மற்றும் பதிவு ஊடகங்களில் இது காந்த வட்டுகள், காந்த நாடாக்கள் போன்றவற்றில் இது பயன்படுத்தப்படுகிறது. கணினி வட்டுகளில் அதன் பயன்பாடு கோபால்ட் கலப்புலோகம் மூலம் முறியடிக்கப்பட்டது. ஏனெனில் அது அதிக சேமிப்பு அடர்த்தி கொண்ட மெல்லிய காந்தப் படங்களை செயல்படுத்துகிறது[17]. ஒளிவினையூக்கிα-Fe2O3 ஓர் ஒளிநேர்மின்முனையாக சூரிய நீர் ஆக்சிசனேற்றத்தில் ஆராயப்படுகிறது. மருந்துலேசான நமைச்சலுக்கு சிகிச்சையளிக்கப் துத்தநாக ஆக்சைடுடன் சேர்த்து காலமைன் பயன்படுத்தப்படுகிறது. மேற்கோள்கள்
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia