பாதரச(II) ஆக்சைடு
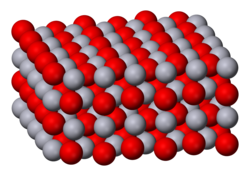
பாதரச(II) ஆக்சைடு (Mercury(II) oxide) என்பது HgO என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். மெர்க்குரிக் ஆக்சைடு அல்லது மெர்க்குரி ஆக்சைடு என்ற பெயர்களாலும் இது அழைக்கப்படுகிறது. சிவப்பு அல்லது ஆரஞ்சு நிறத்தில் இது காணப்படுகிறது. அறை வெப்ப நிலை மற்றும் அழுத்தத்தில் பாதரச(II) ஆக்சைடு ஒரு திண்மமாகும். மண்ட்ராய்டைட்டு கனிமமாக இது மிகவும் அரிதாக பூமியில் கிடைக்கும். வரலாறு1774 ஆம் ஆண்டில் யோசப் பிரீசுட்லி மெர்குரிக் ஆக்சைடை வெப்பப்படுத்துவதன் மூலம் ஆக்சிஜன் வெளியிடப்பட்டதைக் கண்டுபிடித்தார், இருப்பினும் அவர் அந்த வாயுவை ஆக்சினாக அடையாளம் காணவில்லை. மாறாக, பிரீசுட்லி இவ்வாயுவை காற்றேறிய எரிபொருள் என்று அழைத்தார், அதுவே அவர் பணிபுரிந்த அந்த நேரத்தில் கிடைத்த முன்னுதாரணம் ஆகும் [4]. தயாரிப்பு  பாதரசத்தை தோராயமாக 350 பாகை செல்சியசு வெப்பநிலையில் ஆக்சிசனுடன் சேர்த்து எரித்து சிவப்பு நிற பாதரச(II) ஆக்சைடு தயாரிக்கப்படுகிறது. அல்லது பாதரச(II) நைட்ரேட்டை வெப்பச் சிதைவுக்கு உட்படுத்தியும் இதை தயாரிக்கலாம் [5]. நீரிய Hg2+ அயனியை காரத்துடன் சேர்த்து வீழ்படிவாக்கினால் மஞ்சள் நிற பாதரச(II) ஆக்சைடு கிடைக்கிறது [5]. துகள்களின் அளவைப் பொறுத்துதான் இந்த நிற வேறுபாடு நிகழ்கிறது. இரு வண்ண பாதரச(II) ஆக்சைடுகளும் நேர்க்கோட்டு O-Hg-O என்ற ஒரே கட்டமைப்பில் கோணல் மாணலான சங்கிலியுடன் இணைக்கப்பட்டுள்ளன. Hg-O-Hg பிணைப்புகளுக்கு இடையேயான கோண அளவு 108°.ஆகும்ref name = "Greenwood"/>. கட்டமைப்புவளிமண்டல அழுத்தத்தில் பாதரச(II) ஆக்சைடு இரண்டு படிக வடிவங்களில் காணப்படுகிறது, இதில் மண்டிராய்டைட்டு செஞ்சாய்சதுர 2/m 2/m 2/m, Pnma கட்டமைப்பில் காணப்படுகிறது. அறுகோண , hP6, P3221 கட்டமைப்பில் காணப்படும் சல்பைடு கனிமத்தை ஒத்த சின்னபார் இரண்டாவது வகையாகும். இரண்டுமே Hg-O சங்கிலியால் அடையாளப்படுத்தப்படுகின்றன [6] 10 கிகாபைட்டுக்கு மேலான அழுத்தத்தில் இவ்விரண்டு கட்டமைப்புகளும் நாற்கோண வடிவத்திற்கு மாற்றமடைகின்றன[1].. பயன்கள்HgO சில நேரங்களில் பாதரச உற்பத்தியில் பயன்படுத்தப்படுகிறது, ஏனெனில் அது மிக எளிதாக சிதைகிறது. அது சிதைவடையும் போது, ஆக்சிஜன் வாயு உருவாகிறது. பாதரச மின்கலன்களுக்காக எதிர்மின் முனையாகவும் பாதரச(II) ஆக்சைடு பயன்படுத்தப்படுகிறது[7]. உடல்நலம் மெர்குரி ஆக்சைடு மிகவும் நச்சுத்தன்மையுள்ள ஒரு பொருளாகும். அதன் தூசுப் படலத்தை உள்ளிழுப்பதன் மூலமும் தோல் வழியாகவும், உட்கொள்வதன் மூலமும் உடலிலும் உறிஞ்சப்படுகிறது. இந்த வேதிப்பொருள் கண்கள், தோல் மற்றும் சுவாசக்குழாய் போன்ற உறுப்புகளை எரிச்சலூட்டுகிறது. இது சிறுநீரகங்களில் பாதிப்புகளை ஏற்படுத்தவும் கூடும். இதன் விளைவாக சிறுநீரகக் கோளாறு ஏற்படுகிறது. மனிதர்களுக்கு முக்கியமான உணவுச் சங்கிலியில், குறிப்பாக நீர்வாழ் உயிரினங்களில், உயிரியற் சேர்க்கை நடைபெறுகிறது. இந்த வேதிப்பொருளை ஐரோப்பிய ஒன்றியம் ஒரு பூச்சிக்கொல்லியாக தடைசெய்துள்ளது [8]. 20 °C வெப்பநிலையில் மெர்க்குரி ஆக்சைடின் ஆவியாதல் மிகக் குறைவு. ஒளியின் வெளிப்பாடு அல்லது 500 செல்சியசு வெப்பநிலைக்கு மேல் வெப்ப்ப்படுத்தினால் HgO சிதைக்கிறது. இந்த வெப்பத்தால் அதிக நச்சுத்தன்மை கொண்ட பாதரச புகை மற்றும் ஆக்சிசன் வாயுக்கள் உருவாகின்றன. இதனால் தீ பிடிக்கும் ஆபத்தும் அதிகரிக்கிறது. பாதரச(II) ஆக்சைடு ஒடுக்கும் முகவர்களான குளோரின், ஐதரசன் பெராக்சைடு, சுடுபடுத்தும்பொது மக்னீசியம், டைகந்தக டைகுளோரைடு மற்றும் ஐதரசன் டிரைசல்பைடு போன்றவற்ருடன் தீவிரமாக வினைபுரிகிறது. கந்தகம், பாசுபரசு போன்ற தனிமங்களுடன் வினைபுரியும்போது அதிர்ச்சி உணரும் சேர்மங்கள் உருவாகின்றன[9] . மேற்கோள்கள்
புற இணைப்புகள் விக்கிமீடியா பொதுவகத்தில்,
பாதரச(II) ஆக்சைடு என்பதில் ஊடகங்கள் உள்ளன. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia