Глікопептидні антибіотики
Глікопептидні антибіотики — клас антибіотиків що містить глікозильований циклічний або поліциклічний нерибосомальний пептид. Крім глікозидної та пептидної частин, глікопептиди можуть містити ацильні залишки різної довжини. Такі глікопептиди деколи позначають як ліпоглікопептиди (наприклад, тейкопланін). Особливістю усіх глікопептидів є те, що вони пригнічують біосинтез пептидоглікану — основного складника клітинної стінки бактерій, що є життєво важливим для їхнього виживання. До важливих глікопептидних антибіотиків належать протиінфекційні антибіотики ванкоміцин, тейкопланін, телаванцин, рамопланін[1], авопарцин, декапланін, корбоміцин, комплестатин і блеоміцин.   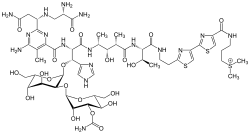 Механізм діїБільшість глікопептидних антибіотиків пригнічують синтез клітинних стінок у чутливих до них бактерій шляхом інгібування синтезу пептидоглікану. Основний клас (включаючи ванкоміцин) зв'язується з ацил-D-аланіл-D-аланіном у ліпіді II, запобігаючи додаванню нових одиниць до пептидоглікану[2] Такий механіз дії притаманний ванкоміцину і тейкопланіну, а також напівсинтетичним ліпоглікопептидам таким як телаванцин, орітаванцин і далбаванцин. Додаткова ліпофільність не тільки посилює зв'язування з ліпідом II, але й створює другий механізм дії, коли антибіотик розчиняється в мембрані і робить її більш проникною.[3] Корбоміцин і комплестатин структурно і генетично пов'язані з ванкоміцином, але вони діють шляхом інгібування аутолізинів (ензимів що руйнують пептидоглікан) через зв'язування з пептидогліканом, таким чином запобігаючи поділу бактеріальної клітини[4]. Жоден з них не є схваленим до медичного використання препаратом. Рамопланін, хоча і є глікопептидом у буквальному розумінні, має зовсім іншу структурну основу. Він не тільки зв'язується з ліпідом II, але й атакує MurG і трансглікозилази (глікозилтрансферази), які полімеризують амінокислоти/цукри в пептидоглікан.[3] Він був описаний гліколіподепсипептидний антибіотик.[5] Механізм дії блеоміцину не пов'язаний з клітинною стінкою, — цей препарат спричиняє пошкодження ДНК у клітинах пухлин.[6] Деякі дослідники зараховують блеоміцин та його аналоги до глікопептидів. Хоча це виправдано з хімічної точки зору, біосинтез блеоміцинів (включає нерибосомний та полікетидний синтези) та характер його біологічної дії (сильна протипухлинна активність) відмінний від решти глікопептидів. Примітки
|
Portal di Ensiklopedia Dunia













