–°–µ—Ä–æ—Ç–æ–Ω—ñ–Ω–æ–≤–∏–π —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç–µ—Ä –°–µ—Ä–æ—Ç–æ–Ω—ñ–Ω–æ–≤–∏–π —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç–µ—Ä (SERT –∞–±–æ 5-HTT), —Ç–∞–∫–æ–∂ –≤—ñ–¥–æ–º–∏–π —è–∫ –Ω–∞—Ç—Ä—ñ–π-–∑–∞–ª–µ–∂–Ω–∏–π –ø–µ—Ä–µ–Ω–æ—Å–Ω–∏–∫ —Å–µ—Ä–æ—Ç–æ–Ω—ñ–Ω—É, –∞–±–æ SLC6A4 (–∞–Ω–≥–ª. solute carrier family 6 member 4), —â–æ –∫–æ–¥—É—î—Ç—å—Å—è –æ–¥–Ω–æ–π–º–µ–Ω–Ω–∏–º –≥–µ–Ω–æ–º. SERT —î –æ–¥–Ω–∏–º —ñ–∑ –≤–∏–¥—ñ–≤ –±—ñ–ª–∫—ñ–≤-–ø–µ—Ä–µ–Ω–æ—Å–Ω–∏–∫—ñ–≤ –º–æ–Ω–æ–∞–º—ñ–Ω—ñ–≤, —â–æ —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç—É—î —Å–µ—Ä–æ—Ç–æ–Ω—ñ–Ω –∑ —Å–∏–Ω–∞–ø—Ç–∏—á–Ω–æ—ó —â—ñ–ª–∏–Ω–∏ –≤ –ø—Ä–µ—Å–∏–Ω–∞–ø—Ç–∏—á–Ω–∏–π –Ω–µ–π—Ä–æ–Ω. –¶–µ –∑–≤–æ—Ä–æ—Ç–Ω—î –∑–∞—Ö–æ–ø–ª–µ–Ω–Ω—è —Å–µ—Ä–æ—Ç–æ–Ω—ñ–Ω—É SERT–æ–º —î –º–µ—Ö–∞–Ω—ñ–∑–º–æ–º –π–æ–≥–æ –¥–µ–∑–∞–∫—Ç–∏–≤–∞—Ü—ñ—ó —Ç–∞ –¥–æ–∑–≤–æ–ª—è—î –ø–æ–≤—Ç–æ—Ä–Ω–æ –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É–≤–∞—Ç–∏ –π–æ–≥–æ –≤ –Ω–∞—Å—Ç—É–ø–Ω—ñ–π —Å–∏–Ω–∞–ø—Ç–∏—á–Ω—ñ–π –ø–µ—Ä–µ–¥–∞—á—ñ –π –∑–¥—ñ–π—Å–Ω—é—î—Ç—å—Å—è –Ω–∞—Ç—Ä—ñ–π-–∑–∞–ª–µ–∂–Ω–∏–º —Å–ø–æ—Å–æ–±–æ–º. –¶–µ–π –±—ñ–ª–æ–∫ —î –º—ñ—à–µ–Ω–Ω—é –¥–ª—è –±–∞–≥–∞—Ç—å–æ—Ö –∞–Ω—Ç–∏–¥–µ–ø—Ä–µ—Å–∞–Ω—Ç—ñ–≤, —Ç–∞–∫–∏—Ö —è–∫ SSRI (–∞–Ω–≥–ª. selective serotonin reuptake inhibitor) —Ç–∞ —Ç—Ä–∏—Ü–∏–∫–ª—ñ—á–Ω–∏—Ö –∞–Ω—Ç–∏–¥–µ–ø—Ä–µ—Å–∞–Ω—Ç—ñ–≤[1]. –í—ñ–Ω –Ω–∞–ª–µ–∂–∏—Ç—å –¥–æ —Ä–æ–¥–∏–Ω–∏ –Ω–∞—Ç—Ä—ñ–π-–Ω–µ–π—Ä–æ–º–µ–¥—ñ–∞—Ç–æ—Ä–Ω–∏—Ö —Å–∏–º–ø–æ—Ä—Ç–µ—Ä—ñ–≤ (–∞–Ω–≥–ª. sodium:neurotransmitter symporter family). –ü–æ–ª—ñ–º–æ—Ä—Ñ–Ω–∏–π –≤–∞—Ä—ñ–∞–Ω—Ç –≥–µ–Ω—É, —â–æ –∫–æ–¥—É—î —Ü–µ–π –±—ñ–ª–æ–∫, –º–∞—î –¥–æ–≤—à—É –ø–æ—Å–ª—ñ–¥–æ–≤–Ω—ñ—Å—Ç—å –Ω—É–∫–ª–µ–æ—Ç–∏–¥—ñ–≤ (–∑–∞ —Ä–∞—Ö—É–Ω–æ–∫ –ø–æ–≤—Ç–æ—Ä—ñ–≤) –∑—ñ —Å—Ç–æ—Ä–æ–Ω–∏ –ø—Ä–æ–º–æ—Ç–æ—Ä–Ω–æ—ó –¥—ñ–ª—è–Ω–∫–∏ —ñ —Ç–∞–∫–∏–º —á–∏–Ω–æ–º –∑–±—ñ–ª—å—à—É—î —à–≤–∏–¥–∫—ñ—Å—Ç—å –∑–≤–æ—Ä–æ—Ç–Ω—å–æ–≥–æ –∑–∞—Ö–æ–ø–ª–µ–Ω–Ω—è —Å–µ—Ä–æ—Ç–æ–Ω—ñ–Ω—É, —â–æ –º–æ–∂–µ –≤—ñ–¥—ñ–≥—Ä–∞–≤–∞—Ç–∏ —Ä–æ–ª—å –≤ —Å–∏–Ω–¥—Ä–æ–º—ñ —Ä–∞–ø—Ç–æ–≤–æ—ó –¥–∏—Ç—è—á–æ—ó —Å–º–µ—Ä—Ç—ñ, –∞–≥—Ä–µ—Å–∏–≤–Ω—ñ–π –ø–æ–≤–µ–¥—ñ–Ω—Ü—ñ –≤ –ø–∞—Ü—ñ—î–Ω—Ç—ñ–≤ –∑ —Ö–≤–æ—Ä–æ–±–æ—é –ê–ª—å—Ü–≥–µ–π–º–µ—Ä–∞, –ø–æ—Å—Ç—Ç—Ä–∞–≤–º–∞—Ç–∏—á–Ω–æ–º—É —Å—Ç—Ä–µ—Å–æ–≤–æ–º—É —Ä–æ–∑–ª–∞–¥—ñ –π —á—É—Ç–ª–∏–≤–æ—Å—Ç—ñ –¥–æ –¥–µ–ø—Ä–µ—Å—ñ—ó —É –ª—é–¥–µ–π, —â–æ –ø–µ—Ä–µ–∂–∏–≤–∞—é—Ç—å –µ–º–æ—Ü—ñ–π–Ω—É —Ç—Ä–∞–≤–º—É[2]. –§—É–Ω–∫—Ü—ñ—ó–ú–µ–¥–∏—á–Ω—ñ –¥–æ—Å–ª—ñ–¥–∂–µ–Ω–Ω—è –ø–æ–∫–∞–∑–∞–ª–∏, —â–æ –∑–º—ñ–Ω–∏ –≤ –∞–∫—Ç–∏–≤–Ω–æ—Å—Ç—ñ SERT, –æ—á–µ–≤–∏–¥–Ω–æ, –ø–æ–≤'—è–∑–∞–Ω—ñ –∑ –±–∞–≥–∞—Ç—å–º–∞ —Ä—ñ–∑–Ω–∏–º–∏ —è–≤–∏—â–∞–º–∏, –∞ —Å–∞–º–µ –∞–ª–∫–æ–≥–æ–ª—ñ–∑–º–æ–º[3], –∫–ª—ñ–Ω—ñ—á–Ω–æ—é –¥–µ–ø—Ä–µ—Å—ñ—î—é, –æ–±—Å–µ—Å–∏–≤–Ω–æ-–∫–æ–º–ø—É–ª—å—Å–∏–≤–Ω–∏–º —Ä–æ–∑–ª–∞–¥–æ–º (–û–ö–Ý), —Ä–æ–º–∞–Ω—Ç–∏—á–Ω–∏–º –∫–æ—Ö–∞–Ω–Ω—è–º, –≥—ñ–ø–µ—Ä—Ç–æ–Ω—ñ—î—é —ñ —Å–æ—Ü—ñ–æ—Ñ–æ–±—ñ—î—é[4]. SERT —Ç–∞–∫–æ–∂ –ø—Ä–∏—Å—É—Ç–Ω—ñ–π –≤ —Ç—Ä–æ–º–±–æ—Ü–∏—Ç–∞—Ö; —Ç–∞–º, —Å–µ—Ä–æ—Ç–æ–Ω—ñ–Ω —î —Ä–µ—á–æ–≤–∏–Ω–æ—é, —â–æ –≤–∏–∫–æ–Ω—É—î —Å—É–¥–∏–Ω–æ–∑–≤—É–∂—É–≤–∞–ª—å–Ω—É —Ñ—É–Ω–∫—Ü—ñ—é. –¶—è —Ä–µ—á–æ–≤–∏–Ω–∞ —Ç–∞–∫–æ–∂ —Å–ª—É–∂–∏—Ç—å —è–∫ —Å–∏–≥–Ω–∞–ª—å–Ω–∞ –º–æ–ª–µ–∫—É–ª–∞ –¥–ª—è —ñ–Ω–¥—É–∫—É–≤–∞–Ω–Ω—è –∞–≥—Ä–µ–≥–∞—Ü—ñ—ó —Ç—Ä–æ–º–±–æ—Ü–∏—Ç—ñ–≤. –ì–µ–Ω–µ—Ç–∏–∫–∞ 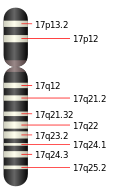 –ì–µ–Ω, —è–∫–∏–π –∫–æ–¥—É—î —Å–µ—Ä–æ—Ç–æ–Ω—ñ–Ω–æ–≤–∏–π —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç–µ—Ä –Ω–∞–∑–∏–≤–∞—î—Ç—å—Å—è SLC6A4. –£ –ª—é–¥–∏–Ω–∏ —Ü–µ–π –≥–µ–Ω —Ä–æ–∑—Ç–∞—à–æ–≤–∞–Ω–∏–π –Ω–∞ –¥–æ–≤–≥–æ–º—É –ø–ª–µ—á—ñ 17-—ó —Ö—Ä–æ–º–æ—Å–æ–º–∏ —É –ø–æ–∑–∏—Ü—ñ—ó 17q11.1‚Äìq12[6]. –ú—É—Ç–∞—Ü—ñ—ó, –ø–æ–≤'—è–∑–∞–Ω—ñ –∑ —Ü–∏–º –≥–µ–Ω–æ–º, –º–æ–∂—É—Ç—å –≤–∏–∫–ª–∏–∫–∞—Ç–∏ –∑–º—ñ–Ω–∏ –≤ —Ñ—É–Ω–∫—Ü—ñ–æ–Ω—É–≤–∞–Ω–Ω—ñ —Å–µ—Ä–æ—Ç–æ–Ω—ñ–Ω–æ–≤–æ–≥–æ —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç–µ—Ä—É, –∞ –µ–∫—Å–ø–µ—Ä–∏–º–µ–Ω—Ç–∏ –∑ –º–∏—à–∞–º–∏ –≤–∏—è–≤–∏–ª–∏ –ø–æ–Ω–∞–¥ 50 —Ä—ñ–∑–Ω–∏—Ö –∑–º—ñ–Ω –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç—ñ –≥–µ–Ω–µ—Ç–∏—á–Ω–æ—ó –º—ñ–Ω–ª–∏–≤–æ—Å—Ç—ñ. –¶–∏–º–∏ —Ñ–µ–Ω–æ—Ç–∏–ø—ñ—á–Ω–∏–º–∏ –∑–º—ñ–Ω–∞–º–∏ –º–æ–∂—É—Ç—å, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥, –±—É—Ç–∏ –ø—ñ–¥–≤–∏—â–µ–Ω–∞ —Ç—Ä–∏–≤–æ–∂–Ω—ñ—Å—Ç—å —ñ –¥–∏—Å—Ñ—É–Ω–∫—Ü—ñ—ó –∫–∏—à–µ—á–Ω–∏–∫–∞[7]. –î–µ—è–∫—ñ –∑ –≥–µ–Ω–µ—Ç–∏—á–Ω–∏—Ö –≤–∞—Ä—ñ–∞—Ü—ñ–π –ª—é–¥–∏–Ω–∏, –ø–æ–≤'—è–∑–∞–Ω–∏—Ö –∑ —Ü–∏–º –≥–µ–Ω–æ–º —î[7]:
–í–∞—Ä—ñ—é–≤–∞–Ω–Ω—è –¥–æ–≤–∂–∏–Ω–∏ 5-HTTLPR
rs25532rs25532 —î –æ–¥–Ω–æ–Ω—É–∫–ª–µ–æ—Ç–∏–¥–Ω–∏–º –ø–æ–ª—ñ–º–æ—Ä—Ñ—ñ–∑–º–æ–º (C>T), —â–æ —Ä–æ–∑—Ç–∞—à–æ–≤–∞–Ω–∏–π –ø–æ—Ä—É—á –∑ 5-HTTLPR. –í—ñ–Ω —Ä–æ–∑–≥–ª—è–¥–∞—î—Ç—å—Å—è, —è–∫ –∞—Å–æ—Ü—ñ–π–æ–≤–∞–Ω–∏–π –∑ –æ–±—Å–µ—Å–∏–≤–Ω–æ-–∫–æ–º–ø—É–ª—å—Å–∏–≤–Ω–∏–º–∏ —Ä–æ–∑–ª–∞–¥–∞–º–∏[8]. I425VI425V —Ä—ñ–¥–∫—ñ—Å–Ω–∞ –º—É—Ç–∞—Ü—ñ—è –Ω–∞ –¥–µ–≤'—è—Ç–æ–º—É –µ–∫–∑–æ–Ω—ñ. –î–æ—Å–ª—ñ–¥–Ω–∏–∫–∏ –≤–∏—è–≤–∏–ª–∏ —Ü–µ–π –≥–µ–Ω–µ—Ç–∏—á–Ω–∏–π –≤–∞—Ä—ñ–∞–Ω—Ç –≤ –Ω–µ—Å–ø–æ—Ä—ñ–¥–Ω–µ–Ω–∏—Ö —Å—ñ–º–µ–π –∑ –æ–±—Å–µ—Å–∏–≤–Ω–æ-–∫–æ–º–ø—É–ª—å—Å–∏–≤–Ω–∏–º–∏ —Ä–æ–∑–ª–∞–¥–∞–º–∏, —ñ —â–æ –≤—ñ–Ω –∑—É–º–æ–≤–ª—é—î –Ω–µ–ø—Ä–∞–≤–∏–ª—å–Ω–µ —Ñ—É–Ω–∫—Ü—ñ–æ–Ω—É–≤–∞–Ω–Ω—è —ñ —Ä–µ–≥—É–ª—é–≤–∞–Ω–Ω—è —Å–µ—Ä–æ—Ç–æ–Ω—ñ–Ω–æ–≤–æ–≥–æ —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç–µ—Ä–∞. –î—Ä—É–≥–∏–π –≤–∞—Ä—ñ–∞–Ω—Ç –≤ —Ç–æ–º—É –∂ –≥–µ–Ω—ñ –¥–µ—è–∫–∏—Ö –ø–∞—Ü—ñ—î–Ω—Ç—ñ–≤ –∑ —Ü—ñ—î—é –º—É—Ç–∞—Ü—ñ—î—é –ø–µ—Ä–µ–¥–±–∞—á–∞—î –≥–µ–Ω–µ—Ç–∏—á–Ω–∏–π ¬´–ø–æ–¥–≤—ñ–π–Ω–∏–π —É–¥–∞—Ĭª, —â–æ –ø—Ä–∏–∑–≤–æ–¥–∏—Ç—å –¥–æ –ø—ñ–¥–≤–∏—â–µ–Ω–Ω—è –±—ñ–æ—Ö—ñ–º—ñ—á–Ω–∏—Ö –µ—Ñ–µ–∫—Ç—ñ–≤ —ñ –±—ñ–ª—å—à –≤–∞–∂–∫–∏—Ö —Å–∏–º–ø—Ç–æ–º—ñ–≤[9][10][11]. –í–∞—Ä—ñ—é–≤–∞–Ω–Ω—è –∫—ñ–ª—å–∫–æ—Å—Ç—ñ —Ç–∞–Ω–¥–µ–º–Ω–∏—Ö –ø–æ–≤—Ç–æ—Ä—ñ–≤ –≤ STin2–Ü–Ω—à–∏–º –Ω–µ–∫–æ–¥—É—é—á–∏–º –ø–æ–ª—ñ–º–æ—Ä—Ñ—ñ–∑–º–æ–º —î –≤–∞—Ä—ñ—é–≤–∞–Ω–Ω—è –∫—ñ–ª—å–∫–æ—Å—Ç—ñ —Ç–∞–Ω–¥–µ–º–Ω–∏—Ö –ø–æ–≤—Ç–æ—Ä—ñ–≤ –≤ –¥—Ä—É–≥–æ–º—É —ñ–Ω—Ç—Ä–æ–Ω—ñ (STin2). –í–µ—è–≤–ª–µ–Ω–æ —Ç—Ä–∏ –∞–ª–µ–ª—ñ –∑ 9, 10 —ñ 12 –ø–æ–≤—Ç–æ—Ä–∞–º–∏. –ú–µ—Ç–∞-–∞–Ω–∞–ª—ñ–∑ –≤–∏—è–≤–∏–≤, —â–æ –∞–ª–µ–ª—å –∑ 12 —Ç–∞–Ω–¥–µ–º–Ω–∏–º–∏ –ø–æ–≤—Ç–æ—Ä–∞–º–∏ –º–∞—î –¥–µ—è–∫—ñ –Ω–µ–∑–Ω–∞—á–Ω—ñ (–∑ —Å–ø—ñ–≤–≤—ñ–¥–Ω–æ—à–µ–Ω–Ω—è–º –π–º–æ–≤—ñ—Ä–Ω–æ—Å—Ç–µ–π 1,24), –∞–ª–µ —Å—Ç–∞—Ç–∏—Å—Ç–∏—á–Ω–æ –∑–Ω–∞—á—É—â—ñ –∫–æ—Ä–µ–ª—è—Ü—ñ—ó –∑ —à–∏–∑–æ—Ñ—Ä–µ–Ω—ñ—î—é[12]. –£ 2008 —Ä–æ—Ü—ñ –º–µ—Ç–∞-–∞–Ω–∞–ª—ñ–∑ –Ω–µ –≤–∏—è–≤–∏–≤ —ñ—Å—Ç–æ—Ç–Ω–æ—ó –∫–æ—Ä–µ–ª—è—Ü—ñ—ó –º—ñ–∂ –≤–∞—Ä—ñ—é–≤–∞–Ω–Ω—è–º –∫—ñ–ª—å–∫–æ—Å—Ç—ñ —Ç–∞–Ω–¥–µ–º–Ω–∏—Ö –ø–æ–≤—Ç–æ—Ä—ñ–≤ –≤ –¥—Ä—É–≥–æ–º—É —ñ–Ω—Ç—Ä–æ–Ω—ñ –≥–µ–Ω—É SLC6A4 —ñ –∞—É—Ç–∏–∑–º–æ–º[13]. –ö—Ä—ñ–º —Ç–æ–≥–æ, –≤ 2003 –º–µ—Ç–∞-–∞–Ω–∞–ª—ñ–∑ –∞—Ñ–µ–∫—Ç–∏–≤–Ω–∏—Ö —Ä–æ–∑–ª–∞–¥—ñ–≤, –∫–ª—ñ–Ω—ñ—á–Ω–∏—Ö –¥–µ–ø—Ä–µ—Å—ñ–π —Ç–∞ –±—ñ–ø–æ–ª—è—Ä–Ω–∏—Ö —Ä–∑–ª–∞–¥—ñ–≤ –≤–∏—è–≤–∏–≤ –Ω–µ–≤–µ–ª–∏–∫—ñ –∫–æ—Ä–µ–ª—è—Ü—ñ—ó –∑ –≤–∞—Ä—ñ—é–≤–∞–Ω–Ω—è–º –∫—ñ–ª—å–∫–æ—Å—Ç—ñ —Ç–∞–Ω–¥–µ–º–Ω–∏—Ö –ø–æ–≤—Ç–æ—Ä—ñ–≤ –≤ STin2, –∞–ª–µ –Ω–∞ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–∏ –º–µ—Ç–∞-–∞–Ω–∞–ª—ñ–∑—É –º–æ–∂—É—Ç—å –º–∞—Ç–∏ –∑–Ω–∞—á–Ω–∏–π –≤–ø–ª–∏–≤ –¥–∞–Ω—ñ –≤—ñ–¥ –æ–¥–Ω–æ–≥–æ –æ–∫—Ä–µ–º–æ–≥–æ –¥–æ—Å–ª—ñ–¥–∂–µ–Ω–Ω—è[14]. –ó–≥—ñ–¥–Ω–æ –∑ –¥–æ—Å–ª—ñ–¥–∂–µ–Ω–Ω—è–º–∏ —Ä–æ—Å—ñ–π—Å—å–∫–∏—Ö –Ω–∞—É–∫–æ–≤—Ü—ñ–≤ –ø—Ä–æ–≤–µ–¥–µ–Ω–∏–º–∏ –≤ 2008 —Ä., —Ü–µ–π –ø–æ–ª—ñ–º–æ—Ä—Ñ—ñ–∑–º –≤–∏—è–≤–ª—è—î –∫–æ—Ä–µ–ª—è—Ü—ñ—ó –∑ –¥–µ—è–∫–∏–º–∏ —Ä–∏—Å–∞–º–∏ –æ—Å–æ–±–∏—Å—Ç–æ—Å—Ç—ñ. –ù–æ—Å—ñ—ó –∞–ª–µ–ª—é –∑ 10 —Ç–∞–Ω–¥–µ–º–Ω–∏–º–∏ –ø–æ–≤—Ç–æ—Ä–∞–º–∏, –ø—Ä–æ—Ö–æ–¥—è—á–∏ —Ç–µ—Å—Ç—É–≤–Ω–Ω—è –∑–∞ –æ—Å–æ–±–∏—Å—Ç—ñ—Å–Ω–∏–º –æ–ø–∏—Ç—É–≤–∞–ª—å–Ω–∏–∫–æ–º –ê–π–∑–µ–Ω–∫–∞, –æ—Ç—Ä–∏–º—É—é—Ç—å –Ω–∏–∑—å–∫–∏–π –±–∞–ª –Ω–µ–π—Ä–æ—Ç–∏–∑–º—É[15]. –ù–µ–π—Ä–æ–≤—ñ–∑—É–∞–ª—ñ–∑–∞—Ü—ñ—è–ü–æ—à–∏—Ä–µ–Ω–Ω—è —Å–µ—Ä–æ—Ç–æ–Ω—ñ–Ω–æ–≤–æ–≥–æ —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç–µ—Ä–∞ –≤ –≥–æ–ª–æ–≤–Ω–æ–º—É –º–æ–∑–∫—É –º–æ–∂–µ –±—É—Ç–∏ –≤—ñ–∑—É–∞–ª—ñ–∑–æ–≤–∞–Ω–∞ –∑–∞ –¥–æ–ø–æ–º–æ–≥–æ—é –∑–∞ –¥–æ–ø–æ–º–æ–≥–æ—é –ø–æ–∑–∏—Ç—Ä–æ–Ω-–µ–º—ñ—Å—ñ–π–Ω–æ—ó —Ç–æ–º–æ–≥—Ä–∞—Ñ—ñ—ó –∑ –≤–∏–∫–æ—Ä–∏—Å—Ç–∞–Ω–Ω—è–º —Ä–∞–¥—ñ–æ–ª—ñ–≥–∞–Ω–¥—ñ–≤, —â–æ –∑–≤—É—Ç—å—Å—è DASB —ñ DAPP, –∞ –ø–µ—Ä—à—ñ –¥–æ—Å–ª—ñ–¥–∂–µ–Ω–Ω—è –ª—é–¥—Å—å–∫–æ–≥–æ –º–æ–∑–∫—É –±—É–ª–æ –∑–∞—Ä–µ—î—Å—Ç—Ä–æ–≤–∞–Ω–æ –≤ 2000 —Ä–æ—Ü—ñ[16]. DASB —ñ DAPP –Ω–µ —î —î–¥–∏–Ω–∏–º–∏ —Ä–∞–¥—ñ–æ–ª—ñ–≥–∞–Ω–¥–∞–º–∏ –¥–ª—è SERT. –Ñ –±–µ–∑–ª—ñ—á —ñ–Ω—à–∏—Ö, –Ω–∞–π–±—ñ–ª—å—à –ø–æ–ø—É–ª—è—Ä–Ω–∏–º–∏ –∑ —è–∫–∏—Ö, –π–º–æ–≤—ñ—Ä–Ω–æ, —î —Ä–∞–¥—ñ–æ–ª—ñ–≥–∞–Ω–¥ Œ≤-CIT –∑ —ñ–∑–æ—Ç–æ–ø–æ–º –π–æ–¥—É-123, —è–∫–∏–π –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—î—Ç—å—Å—è –¥–ª—è —Å–∫–∞–Ω—É–≤–∞–Ω–Ω—è –º–æ–∑–∫—É –∑ –≤–∏–∫–æ—Ä–∏—Å—Ç–∞–Ω–Ω—è–º –æ–¥–Ω–æ—Ñ–æ—Ç–æ–Ω–Ω–æ—ó –µ–º—ñ—Å—ñ–π–Ω–æ—ó –∫–æ–º–ø'—é—Ç–µ—Ä–Ω–æ—ó —Ç–æ–º–æ–≥—Ä–∞—Ñ—ñ—ó (SPECT)[17]. –Ý–∞–¥—ñ–æ–ª—ñ–≥–∞–Ω–¥–∏ –±—É–ª–∏ –≤–∏–∫–æ—Ä–∏—Å—Ç–∞–Ω—ñ –¥–ª—è –¥–æ—Å–ª—ñ–¥–∂–µ–Ω–Ω—è –ø–∏—Ç–∞–Ω–Ω—è, —á–∏ —î —Ç–∞–∫—ñ –∑–º—ñ–Ω–Ω—ñ, —è–∫ –≤—ñ–∫, —Å—Ç–∞—Ç—å –∞–±–æ –≥–µ–Ω–æ—Ç–∏–ø –∞—Å–æ—Ü—ñ–π–æ–≤–∞–Ω—ñ –∑ –∑–≤'—è–∑—É–≤–∞–Ω–Ω—è–º –¥–∏—Ñ–µ—Ä–µ–Ω—Ü—ñ–π–æ–≤–∞–Ω–æ–≥–æ —Å–µ—Ä–æ—Ç–æ–Ω—ñ–Ω–æ–≤–æ–≥–æ —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç–µ—Ä–∞[18] . –ó–¥–æ—Ä–æ–≤—ñ —Å—É–±'—î–∫—Ç–∏, —è–∫—ñ –º–∞–ª–∏ –≤–∏—Å–æ–∫–∏–π –±–∞–ª –Ω–µ–≤—Ä–æ—Ç–∏–∑–º—É ‚Äî —Ä–∏—Å–∞ –æ—Å–æ–±–∏—Å—Ç–æ—Å—Ç—ñ –≤ Revised NEO Personality Inventory ‚Äî –≤–∏—è–≤–ª—è–ª–∏ –±—ñ–ª—å—à–µ –∑–≤'—è–∑—É–≤–∞–Ω–Ω—è SERT –≤ —Ç–∞–ª–∞–º—É—Å—ñ[19]. –ù–µ–π—Ä–æ–≤—ñ–∑—É–∞–ª—ñ–∑–∞—Ü—ñ—è —Ç–∞ –≥–µ–Ω–µ—Ç–∏–∫–∞–î–æ—Å–ª—ñ–¥–∂–µ–Ω–Ω—è —Å–µ—Ä–æ—Ç–æ–Ω—ñ–Ω–æ–≤–æ–≥–æ —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç–µ—Ä—É –ø–æ—î–¥–Ω–∞–ª–∏ –º–µ—Ç–æ–¥–∏ –Ω–µ–π—Ä–æ–≤—ñ–∑—É–∞–ª—ñ–∑–∞—Ü—ñ—ó —ñ –≥–µ–Ω–µ—Ç–∏–∫–∏, –Ω–∞–ø—Ä–∏–∫–ª–∞–¥, –¥–æ—Å–ª—ñ–¥–∂–µ–Ω–Ω—è –∑ –∑–∞—Å—Ç–æ—Å—É–≤–∞–Ω–Ω—è–º –≤–æ–∫—Å–µ–ª—å–Ω–æ—ó –º–æ—Ä—Ñ–æ–º–µ—Ç—Ä—ñ—ó –≤–∏—è–≤–∏–ª–∏ –º–µ–Ω—à–µ —Å—ñ—Ä–æ—ó —Ä–µ—á–æ–≤–∏–Ω–∏ –≤ –Ω–∞–≤–∫–æ–ª–æ–∫–æ–ª—ñ–Ω–Ω—ñ–π –ø–µ—Ä–µ–¥–Ω—ñ–π –ø–æ—è—Å–Ω—ñ–π –∫–æ—Ä—ñ —ñ –º–∏–≥–¥–∞–ª–∏–Ω—ñ –¥–ª—è –Ω–æ—Å—ñ—ó–≤ –∫–æ—Ä–æ—Ç–∫–∏—Ö –∞–ª–ª–µ–ª—ñ–≤ –∑ 5-HTTLPR –ø–æ–ª—ñ–º–æ—Ä—Ñ—ñ–∑–º–æ–º –≤ –ø–æ—Ä—ñ–≤–Ω—è–Ω–Ω—ñ –∑ –Ω–æ—Å—ñ—è–º–∏ ¬´long/long¬ª –≥–µ–Ω–æ—Ç–∏–ø—É[20]. –ü–æ—Å–∏–ª–∞–Ω–Ω—è
|
Portal di Ensiklopedia Dunia













