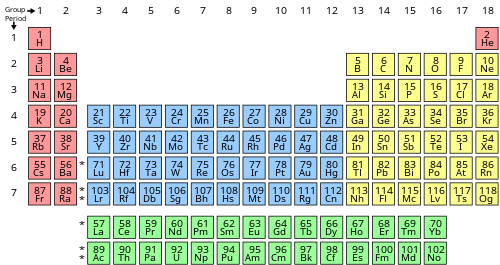
 一張標示元素分區的元素週期表:
一張標示元素分區的元素週期表:
s區元素
p區元素
d區元素
f區元素
元素周期表分区(blocks of the periodic table),是根据元素外层价电子构型的不同,将元素周期表分成几个区(blocks);同一区里的元素,其新增的電子所填入的亞殼層軌域类型是相同的,並以該轨道的名稱作为该区的名称。
s、p、d和f區的名稱來自於其代表性軌域的光譜符號,分別代表:sharp, principal, diffuse, 以及fundamental。至於後續軌域的光譜符號則按字母順序排列,如g、h等,但目前尚未發現屬於此區塊的元素。
 元素周期表的s、f、d、p区
元素周期表的s、f、d、p区
總覽
下表列出了元素周期表上的元素,並且標示了其所屬的元素分区:
| 族→
|
1 |
2
|
3 |
4
|
5 |
6
|
7 |
8
|
9 |
10
|
11 |
12
|
13 |
14
|
15 |
16
|
17 |
18
|
電子層
|
0族電子數
|
|
| 週期↓
|
I A
|
|
VIII A
(0)
|
| 1
|
1
H
氫
1.008
|
II A
|
|
III A
|
IV A
|
V A
|
VI A
|
VII A
|
2
He
氦
4.003
|
K
|
2
|
| 2
|
3
Li
鋰
6.941
|
4
Be
鈹
9.012
|
|
5
B
硼
10.81
|
6
C
碳
12.01
|
7
N
氮
14.01
|
8
O
氧
16.00
|
9
F
氟
19.00
|
10
Ne
氖
20.18
|
L
K
|
8
2
|
| 3
|
11
Na
鈉
22.99
|
12
Mg
鎂
24.30
|
III B
|
IV B
|
V B
|
VI B
|
VII B
|
VIII B
(VIII)

|
I B
|
II B
|
13
Al
鋁
26.98
|
14
Si
矽
28.09
|
15
P
磷
30.97
|
16
S
硫
32.04
|
17
Cl
氯
35.45
|
18
Ar
氬
39.95
|
M
L
K
|
8
8
2
|
| 4
|
19
K
鉀
39.10
|
20
Ca
鈣
40.08
|
21
Sc
鈧
44.96
|
22
Ti
鈦
47.87
|
23
V
釩
50.94
|
24
Cr
鉻
52.00
|
25
Mn
錳
54.94
|
26
Fe
鐵
55.84
|
27
Co
鈷
58.93
|
28
Ni
鎳
58.69
|
29
Cu
銅
63.55
|
30
Zn
鋅
65.38
|
31
Ga
鎵
69.72
|
32
Ge
鍺
72.63
|
33
As
砷
74.92
|
34
Se
硒
78.97
|
35
Br
溴
79.90
|
36
Kr
氪
83.80
|
N
M
L
K
|
8
18
8
2
|
| 5
|
37
Rb
銣
85.47
|
38
Sr
鍶
87.62
|
39
Y
釔
88.91
|
40
Zr
鋯
91.22
|
41
Nb
鈮
92.91
|
42
Mo
鉬
95.95
|
43
Tc
鎝
[97]
|
44
Ru
釕
101.1
|
45
Rh
銠
102.9
|
46
Pd
鈀
106.4
|
47
Ag
銀
107.9
|
48
Cd
鎘
112.4
|
49
In
銦
114.8
|
50
Sn
錫
118.7
|
51
Sb
銻
121.8
|
52
Te
碲
127.6
|
53
I
碘
126.9
|
54
Xe
氙
131.3
|
O
N
M
L
K
|
8
18
18
8
2
|
| 6
|
55
Cs
銫
132.9
|
56
Ba
鋇
137.3
|
57-71
鑭系
元素
*
|
72
Hf
鉿
178.5
|
73
Ta
鉭
180.9
|
74
W
鎢
183.8
|
75
Re
錸
186.2
|
76
Os
鋨
190.2
|
77
Ir
銥
192.2
|
78
Pt
鉑
195.1
|
79
Au
金
197.0
|
80
Hg
汞
200.6
|
81
Tl
鉈
204.4
|
82
Pb
鉛
207.2
|
83
Bi
鉍
209.0
|
84
Po
釙
[209]
|
85
At
砈
[210]
|
86
Rn
氡
[222]
|
P
O
N
M
L
K
|
8
18
32
18
8
2
|
| 7
|
87
Fr
鍅
[223]
|
88
Ra
鐳
[226]
|
89-103
錒系
元素
**
|
104
Rf
鑪
[267]
|
105
Db
𨧀
[268]
|
106
Sg
𨭎
[267]
|
107
Bh
𨨏
[270]
|
108
Hs
𨭆
[271]
|
109
Mt
䥑
[278]
|
110
Ds
鐽
[281]
|
111
Rg
錀
[282]
|
112
Cn
鎶
[285]
|
113
Nh
鉨
[286]
|
114
Fl
鈇
[289]
|
115
Mc
鏌
[290]
|
116
Lv
鉝
[293]
|
117
Ts
鿬
[294]
|
118
Og
鿫
[294]
|
Q
P
O
N
M
L
K
|
8
18
32
32
18
8
2
|
|
|
| 6
|
*
|
鑭系
元素
|
57
La
鑭
138.9
|
58
Ce
鈰
140.1
|
59
Pr
鐠
140.9
|
60
Nd
釹
144.2
|
61
Pm
鉕
[145]
|
62
Sm
釤
150.4
|
63
Eu
銪
152.0
|
64
Gd
釓
157.2
|
65
Tb
鋱
158.9
|
66
Dy
鏑
162.5
|
67
Ho
鈥
164.9
|
68
Er
鉺
167.3
|
69
Tm
銩
168.9
|
70
Yb
鐿
173.0
|
71
Lu
鎦
175.0
|
| 7
|
**
|
錒系
元素
|
89
Ac
錒
[227]
|
90
Th
釷
232.0
|
91
Pa
鏷
231.0
|
92
U
鈾
238.0
|
93
Np
錼
[237]
|
94
Pu
鈽
[244]
|
95
Am
鋂
[243]
|
96
Cm
鋦
[247]
|
97
Bk
鉳
[247]
|
98
Cf
鉲
[251]
|
99
Es
鑀
[252]
|
100
Fm
鐨
[257]
|
101
Md
鍆
[258]
|
102
No
鍩
[259]
|
103
Lr
鐒
[266]
|
圖解:
預測為s區元素
預測為p區元素
預測為d區元素
預測為f區元素
預測為g區元素
待確認化學特性
在標準狀況下,序號綠色者為氣體;序號藍色者為液體;序號黑色者為固體;序號灰色者為未知相態。
s区元素
s区元素包括元素週期表中屬於1族和2族的元素,以及氦,皆為主族元素。本區的元素其新增加的電子皆填入s軌域,故稱此區塊為s區,s來自英文的sharp,為「銳系光譜」之意。週期表的每個週期都各有2個s區元素。
1族元素包括氢、锂、钠、钾、铷、铯、钫七种元素,由於除氫外的本族元素之氫氧化物都是典型的鹼,因此除氢外的这八种元素又称碱金属。
2族元素包括铍、镁、钙、锶、钡、镭六种元素,由於鈣、鍶、鋇、鐳的氧化物為鹼性且不溶於水,因此又称碱土金属。
由於氦的電子排布為1s2,故被分為s区元素。
p区元素
p区元素包括元素周期表中13族至18族的元素(氦除外),皆為主族元素。本區的元素其新增加的電子皆填入p軌域,故稱此區塊為p區,p來自英文的principal,為「主系光譜」之意。週期表中從第2週期開始的每個週期都各有6個p區元素。
13族元素又称为硼族元素,包括硼、铝、镓、铟、铊、鉨等元素;
14族元素又称为碳族元素,包括碳、硅、锗、锡、铅、鈇等元素;
15族元素又称为氮族元素,包括氮、磷、砷、锑、铋、镆等元素;
16族元素又称为氧族元素,包括氧、硫、硒、碲、钋、鉝等元素;
17族元素又称为卤素,包括氟、氯、溴、碘、砹、鿬等元素;
18族元素又称为稀有气体或惰性气体,包括氖、氩、氪、氙、氡、鿫等元素。(氦为s区元素)
d区元素
d区元素包括元素周期表中3族至12族的元素,皆為副族元素,且都是金屬。本區的元素其新增加的電子皆填入d軌域,故稱此區塊為d區,d來自英文的diffuse,為「漫系光譜」之意。週期表中從第4週期開始的每個週期都各有10個d區元素。
本區的元素又稱為過渡金屬,因為它們在週期表中處於強電正性的第1、2族金屬與弱電正性的第13至16族金屬之間的過渡地帶。
f区元素
f区元素包括元素周期表中的镧系元素和锕系元素(鎦和鐒除外),皆為副族元素,且都是金屬。本區的元素其新增加的電子大多填入f軌域,故稱此區塊為f區,f來自英文的fundamental,為「基系光譜」之意。週期表中從第6週期開始的每個週期都各有14個f區元素。本區的元素通常不被歸於任何一族,也有些學者將它們歸入3族。
本區的元素又稱為內過渡金屬,因為它們在週期表中處於s區金屬與d區過渡金屬之間的過渡地帶。
g区元素
g區元素包括扩展元素周期表中第8週期的第121-138号元素以及第9週期的第171-188号元素,本區的所有元素目前均尚未被發現。本區的元素預計其新增加的電子將填入g軌域,故稱此區塊為g區。預測週期表中從第8週期開始的每個週期都將各有18個g區元素,然而根據計算不具电荷的原子之原子序最大可达到173,而其后的元素必须以离子的形态才能存在,所以根据电子组态分区将变得毫无意义,故第9周期的173号元素(Ust)以后的h区元素可能只在理论上成立。
h区元素
h区元素指的是該元素具有最高能量的电子是排布在h轨道上。但由於第8周期之後元素之排列仍有爭議,尤其现在对172号内的元素的电子排布有若干种彼此竞争的理论,且跟元素週期律與馬德隆規則根據構造原理週期表之結果都有所分歧,例如所有这些理论都预测下一个稀有气体元素并不是168号,而是172号,此外,不少模型把元素週期律與馬德隆規則根據構造原理週期表應放置於第八周期的元素擺放到了第9週期,造成不分元素的週期歸屬有爭議,因此不一定能依照元素週期律與馬德隆規則將h區元素準確地列出來,況且多还只是推测,目前还没有对123号后的元素的详尽计算[1]。若只參考元素週期律與馬德隆規則,則h区元素在第九周期的分布原子序落在221到241;在第十周期的分布原子序落在294到314之間。
照元素周期表的排列,若有發現或合成原子序大於或等於221(Bbu)以上的元素,它將會屬於h區元素,但是不具電荷的原子的原子序最大可達到173[2],而其後的元素必須以離子的形態存在,甚至當Z=245時,2s軌域也將崩潰[3],因此,此時根據電子組態分區將變得毫無意義,故h区元素可能只在理論上成立,故更不可能有i区元素(具有最高能量的电子是排布在i轨道上)。
ds区元素
ds區元素是指元素週期表中的IB、IIB兩族元素,包括銅、銀、金、鋅、鎘、汞6種天然存在的金屬元素以及錀、鎶2種人工合成元素。ds區的名稱是因為它們的電子構型都是d10s1(ⅠB)或d10s2(ⅡB)。ds區是d區元素的一部分,ds區元素都是過渡金屬。
參考文獻
- ^ Pyykkö, Pekka. A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions. Phys. Chem. Chem. Phys. 2011, 13 (1): 161–168. Bibcode:2011PCCP...13..161P. ISSN 1463-9076. PMID 20967377. doi:10.1039/C0CP01575J (英语).
- ^ Greiner, Walter; Schramm, Stefan. Resource Letter QEDV-1: The QED vacuum. American Journal of Physics. 2008-06-01, 76 (6): 509 [2025-03-06]. ISSN 0002-9505. doi:10.1119/1.2820395. (原始内容存档于2024-09-13).
- ^ Reinhardt, Joachim; Greiner, Walter, Greiner, Walter , 编, Probing Supercritical Fields with Real and with Artificial Nuclei, Springer International Publishing: 195–210, 2015 [2025-03-06], ISBN 978-3-319-10198-9, doi:10.1007/978-3-319-10199-6_19 (英语)
参见
















