极性转换 (英語:Umpolung ),也称极性翻转 、极性反转 、极性颠倒 ,指有机化学 中官能团 极性 的改变,是有机合成 重要概念之一。[ 1] 迪特·澤巴赫 与美国化学家艾里亚斯·詹姆斯·科里 提出,极性转换的英文名称Umpolung 也由德语的Umpolung 得来,意为极性倒转。[ 2] [ 3]
这里的极性,指的是官能团不同原子的亲电 /亲核 反应性 ;从逆合成分析 来看,是指不同原子的供电子/受电子反应性。杂原子 (如金属原子、氧、硫、硅等)的引入会改变化学键 的极性,从而使某一基团的极性发生翻转,这也是极性转换的常用技巧。这样,这个基团既可作为正离子,也可作为负离子;既可作为供电子基团,也可作为受电子基团,很多看似无法获得的合成子 都可以得到,官能团可以作为不同的“身份”来参与化学反应,有机合成反应的范围因此大大扩展。[ 4]
合成子的命名和分类,X代表杂原子 由科里提出的逆合成分析 是有机合成的常用方法之一,它通过拆开目标分子的结构,获得相应的合成前体碎片(合成子 ),来推导出有机合成的可能路线。这些合成子大多是带有供电子性或受电子性的(亲核/亲电,或不准确地讲,负电/正电),可能是稳定存在的微粒,如氰离子 (
C
N
−
{\displaystyle CN^{-}\,}
碳正离子 和碳负离子 。后一种情况中,可以借助相应的“合成子等价物”来作为合成子。
合成子具有一套特殊的分类方法。以右图为例,用
X
{\displaystyle X\,}
杂原子 ,比如O、N、S,该位置被定义为0号;沿着碳链,周围的碳原子分别定为1号、2号、3号、4号等,记为
C
1
,
C
2
,
C
3
,
C
4
{\displaystyle C^{1},C^{2},C^{3},C^{4}\,}
d
{\displaystyle d\,}
a
{\displaystyle a\,}
C
1
{\displaystyle C^{1}\,}
a
1
{\displaystyle a^{1}\,}
d
0
{\displaystyle d^{0}\,}
在杂原子
X
{\displaystyle X\,}
X
{\displaystyle X\,}
C
1
{\displaystyle C^{1}\,}
C
2
{\displaystyle C^{2}\,}
C
3
{\displaystyle C^{3}\,}
羰基化合物 中的羰基中,受电负性 影响,通常碳原子为正电性(亲电性 ),氧原子为负电性(亲核性 ),常规的合成子即酰基 正离子合成子。极性转换可以使碳原子变为
d
1
{\displaystyle d^{1}\,}
二噻烷 (缩硫醛 )与安息香缩合反应 。
醛 (如乙醛 )可以和1,3-丙二硫醇 形成二噻烷。由于硫对碳负离子 具有特殊的稳定性,故邻位的碳有酸性,用正丁基锂 在低温四氢呋喃 中处理,得到相应的亲核性碳负离子(
d
1
{\displaystyle d^{1}\,}
卤代烃 (溴化苄 )、其他羰基化合物(环己酮 )以及环氧乙烷 衍生物(苯基环氧乙烷 )等
a
{\displaystyle a\,}
亲核取代 ,生成的产物水解,又得回羰基,因此产物是另一个羰基化合物。常用的水解试剂有氯化汞 、氧化汞 /水、双(三氟乙酰氧基)碘苯 、硝酸铈铵 和三丁基锡烷 ,它们的水解机理各有不同。此法可以由甲醛 合成高级醛,由醛合成酮 。如果以
X
(
C
H
2
)
n
X
{\displaystyle X(CH_{2})_{n}X\,}
二噻烷 安息香缩合 是羰基极性转换另一类方法的代表,也是人们最早知道的极性转换的例子。反应物苯甲醛 中的羰基碳原子是亲电性的。首先发生氰离子 对羰基碳的亲核加成 ,然后质子由碳转移到氧上,形成一个碳负离子,其中的碳发生了极性转换,是亲核性的。然后该碳原子亲核进攻另一分子的苯甲醛的亲电性羰基碳,质子转移,氰离子离去,得到产物安息香 。整个反应的示意图如下。
安息香缩合反应 腈 类,结果发现形成α-氰醚与α-氰胺的反应对脂肪 醛适用,是相应的酰基负离子等价物,可以有效弥补安息香缩合反应无法应用于脂肪醛的缺点。反应中的羟基 常采用三甲基硅基 或1-乙氧基乙基进行保护 。下面的β-乙酰基 环己酮 就是用这种方法合成的。
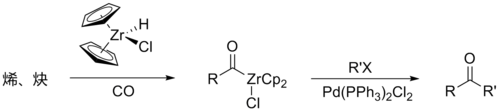
一些酰基负离子等价物 氰醚 极性转换例子 有机金属试剂 也可以达到使羰基碳发生极性转换的目的,例如下图中的五羰基铁 和酰基氯化二茂锆 。
极性转换例子 五羰基铁 极性转换例子 酰基氯化二茂锆 α-氰醚 中的氰基和烷氧基都被氯替换,或氰基为氢,烷氧基为硝基 时形成的化合物,以及酰基锂 、烯醚 、α-烷硫基亚砜 类化合物,都具有掩蔽羰基,使羰基碳带有亲核性的作用。下面仅举烯醚(乙烯基甲醚 )的例子来说明。烯醚等类型的烯基化合物,其α-氢 具有酸性,可以与叔丁基锂 在低温作用生成相应的锂盐,即对应酰基负离子的等价物。烯醚可以是烯醇醚 、烯硫醇醚或烯基硅醚 ,烃基锂也可以先与碘化亚铜 反应,做成二烷基铜锂 的形式与亲电体反应。反应最终得到乙酰化的产物。
极性转换例子 烯醚 羰基化合物发生卤代 (生成卤代酮 )后,其
C
2
{\displaystyle C^{2}\,}
d
2
{\displaystyle d^{2}\,}
a
2
{\displaystyle a^{2}\,}
缩醛 的形式进行保护。
α,β-不饱和羰基化合物 的
C
3
{\displaystyle C^{3}\,}
S
R
,
N
R
2
,
S
i
R
3
{\displaystyle SR,NR_{2},SiR_{3}\,}
C
1
{\displaystyle C^{1}\,}
C
3
{\displaystyle C^{3}\,}
a
3
{\displaystyle a^{3}\,}
d
3
{\displaystyle d^{3}\,}
C
1
{\displaystyle C^{1}\,}
C
1
{\displaystyle C^{1}\,}
C
3
{\displaystyle C^{3}\,}
烯丙基 负离子,则也会发生
C
3
{\displaystyle C^{3}\,}
下图中的反应也是α,β-不饱和羰基化合物 的
C
3
{\displaystyle C^{3}\,}
Heck反应 ,但反应不是用钯催化,而是使用了一个三唑 衍生出的氮杂环卡宾 。它与不饱和酯的β-碳发生加成,生成一个烯醇负离子,经互变异构 得到羰基,同时β-碳发生极性转换变为亲核性。然后与溴发生亲核取代 ,溴离子离去,磷酸根离子处理使卡宾 离去,以92%的产率得到产物(4)。[ 5]
极性转换例子
烷烃的极性转换 :以卤代烃 为原料,制取有机金属化合物 的反应便是烷烃极性转换的例子。反应前的
C
1
{\displaystyle C^{1}\,}
a
{\displaystyle a\,}
d
{\displaystyle d\,}
格氏试剂 为例,反应前后烷基分别是正离子和负离子,如下。
再如,卤代烷C-X异裂得到的碳正离子是亲电性的,但均裂得到的自由基 是亲核性的;连有吸电子基的碳负离子是亲核性的,但连有吸电子基的自由基是亲电性的。
格氏试剂 极性转换 烯烃的极性转换 :通常,烯烃具有供电子性,是
d
{\displaystyle d\,}
吸电子基 的烯烃会使电子密度减少,使其转变为
a
{\displaystyle a\,}
配合物 的生成也可以使烯键发生极性转换。
芳烃的极性转换 :芳香环 一般为供电子性,容易发生亲电芳香取代反应 。但与金属原子配位后,其电子密度减少,转换为
a
{\displaystyle a\,}
碘 )处理后金属配体脱去,又可得到芳环。
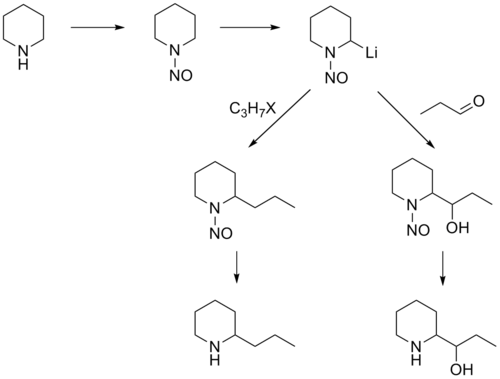
芳烃 极性转换 胺的极性转换 :胺的极性转换可通过形成亚胺 离子(曼尼希反应 )或形成亚硝胺 (见下)来完成。
极性转换 胺
^ IUPAC 金色书 对“极性转换”的定义:[1] (页面存档备份 ,存于互联网档案馆 )。^ Seebach D. Methods of Reactivity Umpolung. Angewandte Chemie International Edition in English. 1979, 18 (4): 239–258. doi:10.1002/anie.197902393 ^ Gröbel B. T., Seebach D. Reactivity of Carbonyl-Compounds Through Sulfur-Containing Reagents. Synthesis-Stuttgart. 1977, 6 : 357–402. doi:10.1055/s-1977-24412 ^ Seebach D., Corey E. J. Generation and synthetic applications of 2-lithio-1,3-dithianes (PDF) . Journal of Organic Chemistry . 1975, 40 (2): 231–237. doi:10.1021/jo00890a018 存档 (PDF) 于2007-09-29). ^ Fischer C., Smith S. W., Powell D. A., Fu G. C. Umpolung of Michael Acceptors Catalyzed by N-Heterocyclic Carbenes. Journal of the American Chemical Society . 2006, 128 (5): 1472–1473. doi:10.1021/ja058222q