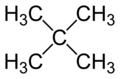
ネオペンタン
ネオペンタン(英: Neopentane)は、2本の側鎖を持つ炭素数5の分岐鎖を有したアルカンである。IUPAC系統名は 2,2-ジメチルプロパン (2,2-dimethylpropane)だが、ネオペンタンはIUPAC許容慣用名として使用される。第4級炭素を有する化合物の中では、最も単純な構造の化合物であり、n-ペンタン、イソペンタンの構造異性体でもある。 物理的性質常圧でのネオペンタンの沸点は9.5 °Cであり、常温常圧では引火性の高い気体として存在するものの、寒い日や高圧下では揮発性の液体として存在する。 構造異性体との沸点の比較ネオペンタンの沸点は、他の構造異性体に比べて著しく低い。常圧でのイソペンタン(27.7 °C)およびn-ペンタン(36.0 °C)と比べて、ネオペンタン(9.5 °C)である。したがって、ネオペンタンは室温、大気圧下で気体だが、イソペンタンおよびn-ペンタンは辛うじてながら液体である。これについては、分岐鎖が増えたために分子の形状が球形に近付くため、直鎖の場合によりも分子の表面積が減少し、結果として分子間力が弱くしか作用しないからだと説明される[3]。 構造異性体との融点の比較一方で、常圧でのネオペンタンの融点(−16.6 °C)は、イソペンタン(−159.9 °C)よりも140 °C高く、n-ペンタン(−129.8 °C)よりも110 °C高い。この異常に高い融点の原因は、正四面体型のネオペンタン分子が固相において、より良く密接しているために、固体の状態であれば、分子間力が強力に作用しているためだと説明されてきた。しかし、この説明は、ネオペンタンが他の2つの異性体よりも低い密度を有するという理由で疑われてきた。その上に、ネオペンタンの固体の融解エントロピーは、n-ペンタンおよびイソペンタンの融解エントロピーよりも低い。これは、ネオペンタンの高い融点が、より高い分子の対称性から生じるエントロピー効果による結果である事を示している。実際、ネオペンタンの融解エントロピーは、n-ペンタンおよびイソペンタンよりも約4倍低い[4]。 NMRスペクトルネオペンタンの分子は正4面体状に炭素が連なり、分子内の水素は全て、正4面体の中心の第4級炭素以外に結合した構造をしている。この分子の対称性のため、全てのプロトンは化学的に等価であり、四塩化炭素に溶解して1H NMRで、これらの水素の化学シフトを計測すると、単一のδ = 0.902という値を与える[5]。この点においてネオペンタンは、1H NMRで基準として用いられるテトラメチルシランと似ている。 ネオペンタン分子の対称性は、一部の水素原子が重水素原子によって置き換えられると壊れる。特に、もしそれぞれのメチル基が、異なる数の重水素原子(0、1、2、3)と結合した場合には、キラルな分子が得られる。 ネオペンチル基 ネオペンチル基(Neopentyl substituent)とは、ネオペンタンから水素が1つ脱離した構造の部分を指し、しばしばNpと表記される。その構造は Me3C-CH2 と略記される場合もあり、例えば、ネオペンチルアルコールは Me3CCH2OH さらには NpOH と略記される場合もある。 出典
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia