過酸化水素
別称
Oxidanyl
識別情報
ChEBI
ChEMBL
ChemSpider
ECHA InfoCard 100.028.878
EC番号
KEGG
RTECS number
MX0900000 (>90% soln.)
UNII
国連/北米番号
2015 (>60% soln.)
InChI=1S/H2O2/c1-2/h1-2H
Key: MHAJPDPJQMAIIY-UHFFFAOYSA-N
InChI=1/H2O2/c1-2/h1-2H
Key: MHAJPDPJQMAIIY-UHFFFAOYAL
特性
化学式
H2 O2
モル質量
34.01 g mol−1
外観
非常に明るい青色の液体
匂い
無臭またはオゾン臭
密度
1.11 g/cm3 (20 °C, 30% (w/w) 溶液)[ 1] 3 (20 °C, 純粋)
融点
-0.43 °C , 273 K, 31 °F
沸点
150.2 °C , 423 K, 302 °F (分解)
水 への溶解度
混和
溶解度
エーテル、エタノールに溶ける
log POW
−0.43[ 2]
蒸気圧
5 mmHg (30 °C)[ 3]
酸解離定数 pK a
11.75
磁化率
−17.7·10−6 cm3 /mol
屈折率 (n D )
1.4061
粘度
1.245 cP (20 °C)
2.26 D
熱化学
標準生成熱 Δf H o −187.80 kJ/mol
標準定圧モル比熱 , C p o 1.267 J/(g·K) (気体)
危険性
GHS 表示
Danger
H271 , H302 , H314 , H332 , H335 , H412
P280 , P305+P351+P338 , P310
NFPA 704
引火点
不燃性
致死量または濃度 (LD, LC)
1518 mg/kg[要出典 [ 4]
1418 ppm (ラット, 4時間)[ 4]
LCLo (最低致死濃度)
227 ppm (マウス)[ 4]
NIOSH
TWA 1 ppm (1.4 mg/m3 )[ 3]
TWA 1 ppm (1.4 mg/m3 )[ 3]
75 ppm[ 3]
安全データシート (SDS)
ICSC 0164 (>60% soln.)
関連する物質
関連物質
水 オゾン ヒドラジン 二硫化水素 二フッ化二酸素
特記なき場合、データは常温 (25 °C )・常圧 (100 kPa) におけるものである。
過酸化水素 (かさんかすいそ、英 : hydrogen peroxide )は、化学式 H2 O2 で表される化合物 。しばしば過水 (かすい)と略称される。二酸化水素 と呼ばれたこともある[ 5] 水溶液 で扱われる。対象により強力な酸化剤 にも還元剤 にもなり、殺菌剤 、漂白剤 として利用される。発見者はフランス のルイ・テナール 。
35 %水溶液は、常温 では無色 の、水 よりわずかに粘度 の高い弱酸 性の液体 [ 6] エタノール 、エーテル 、水 に可溶。わずかにオゾン に似た臭いがする[ 7]
過酸化水素は不安定で酸素 を放出しやすく、非常に強力な酸化力 を持つヒドロキシラジカル を生成しやすい。過酸化水素は活性酸素 の一種ではあるが、フリーラジカル ではない。
強い腐食性 を持ち、高濃度のものが皮膚 に付着すると痛みをともなう白斑が生じる。また、可燃物 と混合すると過酸化物を生成し、発火させることがある。水に溶けると、分解されるまでは水生生物に対して若干の毒性を持つ[ 6]
実験室では、酸素 を得る際に使われる。この反応式は以下の通りである。
2
H
2
O
2
⟶
2
H
2
O
+
O
2
{\displaystyle {\ce {2H2O2\ -> 2H2O\ + O2}}}
反応で98.05 kJ/mol発熱する。[ 8] 反応速度 を大きくするため触媒 として二酸化マンガン や酵素 の一種カタラーゼ を使用する。傷口の消毒 時に生じる泡は体内にあるカタラーゼが触媒 として働いて生じる酸素である。
なお、過酸化水素は消防法 第2条第7項および別表第一第6類2号により危険物第6類 (酸化性液体)に指定されている。また、重量%で6 %を超える濃度の水溶液などの製剤は毒物及び劇物取締法 により劇物 に指定されている。
過酸化水素水ペルキシール 1920年
過酸化水素全体の使用量では、製紙 の際のパルプ 漂白 や廃水処理、半導体 の洗浄など、工業的な利用が大部分を占める。塩素系の漂白剤などが多量の廃棄物を生じるのに対し、過酸化水素は最終的には無害な水と酸素に分解するため、工業利用するには環境 にやさしい物質であると言われ、近年工業的な過酸化水素の利用は拡大してきている。
試薬用としては、濃度30w/v%(約10mol/ℓ[ 9] [ 10] シクロヘキサノンオキシム 合成[ 11]
閉鎖系エンジン(非大気依存推進 )の酸素源としても利用が検討された。1930年 頃からドイツ のヘルムート・ヴァルター によって、高濃度過酸化水素 の分解により酸素を発生させ、内燃機関 を作動させるアイディアが研究され、ヴァルター機関 が開発された。各国で開発が進められ、第二次世界大戦中にはドイツでUボートXVIIB型 が建造された。
第二次世界大戦 後、戦勝国がその成果を持ち帰り、イギリス ではエクスプローラー級潜水艦 、ソビエト連邦 ではS-99 が建造されて試験に供されたが、いずれも成果は芳しくなかったこと、高濃度過酸化水素の取扱いが難しく事故を起こしたことに加え、アメリカ海軍 において艦船に搭載可能な原子力機関の開発が成功したこともあって、ヴァルター機関はそれ以上省みられることなく、潜水艦の水中動力源としては実用化には至らなかった。日本でも第二次世界大戦中にドイツから技術提供を受けてヴァルター機関が研究されたが、実用化される前に終戦を迎えた。
一方で魚雷 の動力源としては、海上自衛隊 の72式魚雷 やイギリス海軍 の21インチ マーク12魚雷 、ソビエトの65型魚雷 で使用され、一定の成果を収めている。しかし、マーク12魚雷はHMS Sidon 、65型魚雷はクルスク で、それぞれ推進剤の高濃度過酸化水素に起因すると見られる事故を起こして、搭載艦が沈没している。
その他にもロケット飛行機 であるメッサーシュミット Me163 のエンジンHWK 109-509 や秋水 の特呂二号原動機 、Hs 293誘導弾 、ロケットベルト の推進剤として使用され、磁気浮上式鉄道 のKOMET (Komponentenmeßtrager) で1975年に401.3 km/hの速度記録を樹立するときにも使用された。他にV2ロケット ではターボポンプの駆動ガスの発生にも使用され、イギリスのアームストロング・シドレー ステンター 、アームストロング・シドレー ベータ 、ブリストル・シドレー ガンマ 、ブリストル・シドレー BS.605 、デ・ハビランド スペクター 等のロケットエンジンでも酸化剤として使用された。
軍用機以外では、水上速度記録 更新を狙ったロケット推進型パワーボート 「ディスカバリーII」[ 12] 2014年 11月9日 に333 km/hを記録したフランソワ・ギッシー (Francois Gissy) 操縦のロケット推進自転車 “Kamikaze V”[ 13]
過酸化水素は衣料用漂白剤としても利用される。液体の衣料用酸素系漂白剤は希薄過酸化水素の溶液である。一方、過酸化水素と炭酸ナトリウム の錯体 である過炭酸ナトリウム は、粉末で安定のため粉末の酸素系漂白剤として利用される。過炭酸ナトリウムは水に溶解すると炭酸ナトリウム (洗剤としても知られている)と過酸化水素とに解離する。また、髪 の脱色に使用されることもあり、過酸化水素によって脱色した「偽の」ブロンド は、英語で peroxide blonde または bottle blonde と呼ばれる。
食品分野ではうどん、かまぼこ等の漂白目的の食品添加物として認可されているが、日本では1948年(昭和23年)に食品添加物として初めて指定され、1969年(昭和44年)に「うどん、かまぼこ、ちくわにあっては0.1g/kg以上、その他の食品にあっては0.03g/kg以上残存してはならない」とする使用基準が設けられた。その後、弱い動物発がん性が認められたとの報告があったことを踏まえて、過酸化水素が分解しやすいという特性から、1980年(昭和55年)2月に使用基準が「最終食品の完成前に過酸化水素を分解し、または除去しなければならない。」と改められた。2016年(平成28年)2月には使用基準が「釜揚げしらす及びしらす干しにあってはその1kgにつき0.005g以上残存しないように使用しなければならない。その他の食品にあっては、最終食品の完成前に過酸化水素を分解し、又は除去しなければならない。」と改められた[ 14]
2015年現在の基準でカズノコの殺菌・漂白に使用されていながら表示がないのは、カタラーゼで分解処理を施し残存させないため加工助剤 となり法律上表示が必要な食品添加物には該当しないためである[ 15] [ 16]
落花生、ほたて貝、しらす干しなど製造工程に関係なく、細胞内酸化反応および脂質の酸化等により天然由来の過酸化水素が数µg/g検出される食品が存在するため、殺菌・漂白の工程を示すものとは限らない[ 17]
審美歯科 において歯 のホワイトニング に利用されている[ 18]
2.5〜3.5 w/v%の過酸化水素は医療用の外用消毒剤として利用され、オキシドール (oxydol) という日本薬局方名、またはオキシフル (oxyfull) という商品名でも呼ばれる。北米やイギリスで販売されている洗濯用洗剤のブランド「オキシドール」(Oxydol )とは無関係である。
飲料生産の充填工程で、飲料を充填する前に低濃度の過酸化水素水を紙パック内に噴霧して内部を殺菌する飲料充填機も存在する。この際、パック内に噴霧された過酸化水素水はパック内に送風を行うことで分解・乾燥し無害化する。ただし、噴霧量が多すぎるなどして飲料に過酸化水素水が混入するというトラブルが起こるリスクもある。
多くの生物種は過酸化水素分解酵素のカタラーゼを持つため、生体内での過酸化水素の寿命は極めて短い。つまり、傷の内面を含む体内に過酸化水素が侵入すると速やかに酸素に分解される。実際にオキシドールを傷口に塗布した際に発泡するのは、過酸化水素が分解して酸素が発生するためである。これは微生物分析に応用されており、一般的に通性嫌気性細菌 はカタラーゼを持つが、偏性嫌気性細菌 は持たないことから、細菌の種類を判別するのに用いられる。また、カタラーゼは熱により変性 することから、食品に混入した生物系の異物 (毛髪や昆虫など)が加熱殺菌工程の前後どちらで混入したかを判別する苦情 対応にも用いられる。この場合、殺菌前に混入した物ではカタラーゼが失活するため泡が生じないことで判別する[ 19]
また、洗浄・すすぎ・消毒・保存が1液で可能なコンタクトレンズの洗浄剤としても使用されている。中和剤として白金を使用するものが主流である。
過酸化水素を生成するアントラキノン法の触媒サイクル : アントラキノン (右) は水素を使用して還元され、対応するアントラヒドロキノン (左) が生成される。これを酸素を使って酸化して過酸化水素を生成し、アントラキノンを回収する。 過酸化水素(100 %相当)の2016年度日本国内生産量は 17万5673 t、工業消費量は 1万5747 t である[ 20] アントラキノン法 とよばれるアントラセン 誘導体 の自動酸化 を利用して生産が行われている[ 21] エチルアントラヒドロキノン もしくは2-アミルアントラヒドロキノン を溶媒 に溶解し、空気中の酸素 と混合するとアントラヒドロキノン が酸化 されてアントラキノン と過酸化水素が生じる。ここからイオン交換水 を用いて抽出 し、アントラキノンと過酸化水素を分離する。分離後、わずかに混入している有機溶媒を除去し、さらに減圧蒸留 することにより高濃度(30〜60 %)のものを得る。副生成物であるアントラキノンをニッケル またはパラジウム 触媒を用いてアントラヒドロキノンに還元 して再利用する。アントラヒドロキノンの酸化の際に側鎖 が酸化 されたり、還元の際に芳香環 が還元 されてしまうことがあり、それぞれ適切な再生処理が必要である。本法ではアントラキノンをいかに効率よく循環・再生使用できるかが重要となる。
硫酸 または硫酸水素アンモニウム の水溶液を電気分解 して生じるペルオキソ二硫酸 (H2 (SO4 )2 )2− を加水分解 することによる生産法も行われていたが、電力消費などの理由から現在ではあまり行われていない。
2005年現在、工業的な利用量が増え続けており、アントラキノン法に代わる安価な製造法、精製法の研究開発が各所で進められている。実験室レベルの研究については、合成研究の項で述べる。
工業的にはアントラキノン法がよく用いられる。しかし、アントラキノン法は、多段プロセスであること、有機溶媒を必要とすること、副反応を起こしたアントラキノンの再生が必要であること、など多数の問題があり、過酸化水素が高価になる原因となっている。そのため、新しい過酸化水素合成法の開発が切望されている。
他の合成法にパラジウム 触媒を用いた合成法と燃料電池反応法がある。
Pd(-Au)/CまたはPd(-Au)/SiO2 触媒を用いてハロゲン化物イオン存在下、酸性条件で酸素と水素を直接反応させる。古くは、徳山曹達(現・トクヤマ )がPd/SiO2 触媒を用いて、高圧の酸素と水素を反応させると過酸化水素が高濃度で蓄積できることを特許取得している[ 22] [ 23] %の選択性で過酸化水素が生成することを報告している[ 24] %の過酸化水素水が生成したとしている。本触媒系一般の問題点として、酸素と水素を直接混合するため爆発の危険性があること、過酸化水素を高濃度で蓄積するためには加圧が必要であること (1気圧では最高で1 %〜2 %)、生成する過酸化水素水には酸や塩が含まれることが挙げられる。
特に爆発の危険性の問題は重大であり、この危険性を回避するため、反応速度を犠牲にして水素と酸素の混合比を爆発範囲から外す方法のほかに、酸素と水素をパラジウム薄膜で隔てた合成法がChoudharyらにより提案されているが、パラジウムが水素透過能を示すのは通常遥かに高温であり、単に膜に穴が開いていることが疑われることに加え、過酸化水素生成速度が極めて遅いなどの難点がある[ 25]
酸素-水素燃料電池では通常は発電を目的とし、酸素を水にまで還元させるが、適切な触媒を選択することにより酸素を過酸化水素に選択的に還元する方法が提案されている[ 26] [ 27] [ 28] [ 29] [ 30] %と非常に高い。本反応系の問題点として、効率が約40 %(残りは水)と十分ではないことが挙げられる。
光触媒 を使用した光電気化学法 による過酸化水素の合成法が研究されている[ 31] [ 32]
1980年3月18日にソビエト連邦のプレセツク宇宙基地 で、ターボポンプ 駆動用の過酸化水素を充填中のボストーク-2M ロケットが爆発事故を起こし、48人が死亡した。原因はステンレス製フィルターをはんだ付け する際に純粋な錫 ではなく鉛 を含有する電子部品用のはんだ を使用した事だった。鉛自体には過酸化水素を分解する触媒能はないが、鉛の酸化物は強力な触媒として作用する[ 33]
1999年10月29日には首都高速2号目黒線 を走行中のタンクローリー が爆発し、積み荷の過酸化水素水溶液が飛散した。飛散した過酸化水素水溶液により、一般道路の歩行者が目の痛みと皮膚のただれを訴えるなどした[ 34] 塩化銅 を含む廃液の運搬に使用されており、残留していた金属成分により過酸化水素の分解が進み爆発した[ 35]
2000年8月12日にバレンツ海 で原子力潜水艦クルスク に搭載されていた魚雷に溶接不備があり、ここから推進剤である過酸化水素が漏れて爆発した。不運にもこの爆発で魚雷の弾頭が誘爆し、魚雷発射管室から浸水してクルスクは沈没した[ 36] [ 37] [ 38]
2008年(平成20年)3月3日時点で日本海沿岸地域に漂着が確認された、約4万個に及ぶポリタンクの多くから塩酸、過酸化水素水、酢酸、硝酸などが検出された[ 39] [ 39] ハングル が見られたため、外務省は発生源の可能性がある韓国政府および韓国の担当行政機関に対し、外交ルートを通し公式に情報提供を行い、実態把握と原因究明、及び漂着ごみ 削減のための更なる努力を要請した[ 39]
グルタチオン-アスコルビン酸回路 、NADPH 、NADP+ 、GR:グルタチオンレダクターゼ 、GSH:グルタチオン 、GSSG:グルタチオンジスルフィド 、DHAR:デヒドロアスコルビン酸レダクターゼ 、DHA:デヒドロアスコルビン酸 、MDAR:モノデヒドロアスコルビン酸レダクターゼ (NADH) 、MDA:モノデヒドロアスコルビン酸 、ASC:アスコルビン酸 、APX:アスコルビン酸ペルオキシダーゼ 、H2O2、H2O 生体ではエネルギー代謝の際、細胞内に過酸化水素が発生する。過酸化水素は活性酸素 の一種であり、脂肪酸、生体膜、DNA等を酸化損傷するため有害で、生体防御のため速やかに除去しなければならない。
カタラーゼ (catalase) は、代謝 の過程で発生する過酸化水素を不均化して酸素と水に変える反応を触媒する酵素である。毎秒当たりの代謝回転数 は全酵素のなかでも最も高く、4000万に達する[ 40] ヒト の場合、カタラーゼは4つのサブユニットで構成されており、各サブユニットは526のアミノ酸 から成る[ 41] 分子量 は約24万で、ヘム とマンガン を補因子 として用いる。
グルタチオン-アスコルビン酸回路 は、過酸化水素を解毒化する代謝経路である。グルタチオン-アスコルビン酸回路には、アスコルビン酸 、グルタチオン 、NADPH および代謝に関連する酵素等の抗酸化物質 が含まれている[ 42]
この経路の最初のステップでは、過酸化水素はアスコルビン酸を電子供与体 として利用してアスコルビン酸ペルオキシダーゼ (APX) によって水 に還元 される。酸化 されたアスコルビン酸(モノデヒドロアスコルビン酸〈MDA〉)は、モノデヒドロアスコルビン酸レダクターゼ (NADH) (MDAR)によってアスコルビン酸 (ASC) に再生される[ 43] 不均化 する。デヒドロアスコルビン酸は、還元型グルタチオン (GSH) を消費してデヒドロアスコルビン酸レダクターゼによってアスコルビン酸に還元され、酸化型グルタチオン (GSSG)(グルタチオンジスルフィド )を生成する。最後に、酸化型グルタチオンは、NADPHを電子供与体として利用してグルタチオンレダクターゼ (GR) によって還元される。こうしてアスコルビン酸とグルタチオンが消費されることはない。電子 は実質的にNADPHからH2 O2 に流れることとなる。デヒドロアスコルビン酸の還元は、非酵素的または例えばグルタチオンS -トランスフェラーゼオメガ1やグルタレドキシンなどのようにデヒドロアスコルビン酸還元酵素 (DHAR) 活性を有したタンパク質 によって触媒される[ 44] [ 45]
植物では、グルタチオン-アスコルビン酸回路は、細胞質 、ミトコンドリア 、色素体 およびペルオキシソーム で機能する[ 46] [ 47] チオレドキシン またはグルタレドキシンを還元基質として利用したペルオキシレドキシン やグルタチオンペルオキシダーゼ を含む他の酵素(ペルオキシダーゼ )もまた、植物での過酸化水素の解毒に貢献している[ 48]
ミトコンドリア の電子伝達系 では、スーパーオキシドアニオン (O2 - ) などの活性酸素 種が常に発生している。活性酸素は生体分子を破壊し有害であるため、防御機構が存在する。スーパーオキシドアニオンは、まずスーパーオキシドディスムターゼ (SOD) によって過酸化水素に変換され、ペルオキシダーゼ によって無害な水に分解される[ 49] [ 50] [信頼性要検証 。
グルタチオンペルオキシダーゼはセレノシステイン を含む酵素である。グルタチオンを電子供与体として用い、過酸化水素だけでなく有機過酸化物にも作用し、酸化ストレスから生体を守っている[ 51] [ 52]
白血球 (好中球 )は、体内に細菌 が侵入してくると捕獲(貪食)し、白血球はNAD(P)Hオキシダーゼ を使ってNADH (NADPH )とH+と酸素を反応させて、過酸化水素を生成し、貪食されてもまだ増殖しようとする細菌を殺菌し感染から守る生体防御メカニズムを有する[ 53] [信頼性要検証 。
2 O2 捕捉剤生体内で過酸化水素を捕捉 する抗酸化物質 の一覧[ 54]
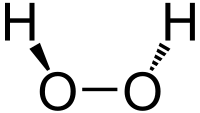
過酸化水素(H2O2)は、ねじれたC2対称性を持つ非平面分子であることが、1950年にPaul-Antoine Giguèreによって赤外線分光法を用いて初めて示された。O-O結合は単結合であるが、386 cm-1 (4.62 kJ/mol) という比較的高い回転障壁(エタンの回転障壁は1040 cm-1 (12.4 kJ/mol))を持っており、回転を抑制している。 この障壁は、隣接する酸素原子のローンペア間の反発と、2つのO-H結合の間の双極子効果によるものであると提唱されている。
2つのO-H結合の間に約100°の二面角があるため、分子はキラルである。これは、掌性を示す最も小さく、最も単純な分子である。片方ではなく、もう片方のエナンチオ特異的な相互作用によって、リボ核酸の一方のエナンチオマー形態が増幅され、RNAの世界でホモキラリティの起源となった可能性が提唱されている。
H2O2の構造は、気体と結晶とで大きく異なる。この違いは、気体状態では存在しない水素結合の効果に起因する。H2O2結晶は正方晶の空間群P4121をとる。
^ “The behaviour of mixtures of hydrogen peroxide and water. Part 1.—Determination of the densities of mixtures of hydrogen peroxide and water”. Transactions of the Faraday Society 48 : 796–801. (1952). doi :10.1039/TF9524800796 . ^ “Hydrogen peroxide ”. www.chemsrc.com . 2020年3月17日時点のオリジナルよりアーカイブ 。2018年5月3日閲覧。 ^ a b c d NIOSH Pocket Guide to Chemical Hazards 0335
^ a b c “Hydrogen peroxide ”. 生活や健康に直接的な危険性がある . アメリカ国立労働安全衛生研究所 (英語版 )
^ 西沢勇志智『参考用補習用統合化学解義』目黒書店、1912年、378頁。 ^ a b 過酸化水素35 %水溶液 MSDS (PDF )
^ 曾根興三、「過酸化水素」、世界大百科事典、第二版CD-ROM版、平凡社、1998年
^ “安全データシート ”. 2020年4月16日閲覧。 ^ 液体モル濃度の求め方-富士フイルム和光純薬株式会社 ^ 佐藤一彦「過酸化水素水を用いる環境調和型酸化反応」『有機合成化学協会誌』第60巻第10号、有機合成化学協会、2002年、974-982頁、doi :10.5059/yukigoseikyokaishi.60.974 。 ^ 住友化学の新しいε-カプロラクタム製造技術 (PDF ) 住友化学^ 1980年 11月13日 にタホ湖 で試験走行中にフロートが波の衝撃に耐えられず破損して水面に叩きつけられ、ドライバーのリー・テイラーは死亡したGoing For Broke At 300 MPH - ウェイバックマシン 。^ フランス人: ロケット自転車を使って時速333キロの速度世界記録を樹立 [リンク切れ 、businessnewsline 、2014年11月11日 、同年11月12日 閲覧^ 厚生労働省 「過酸化水素の規格基準改正について」(平成28年10月27日付生食発1027第1号)
^ 国民生活センター「物質名が表示されない食品添加物がある? 」
^ 厚生労働省「食品添加物の表示について 」
^ 国立医薬品食品衛生研究所「食品添加物含有量データベース 」
^ “ポリリン酸を用いたホワイトニングの特徴 : Q&A 歯科一般 : Dental Diamond[デンタルダイヤモンド] ”. www.dental-diamond.jp . 2021年1月17日閲覧。 ^ 河岸宏和 (2008), 図解入門ビジネス 最新 食品工場の衛生と危機管理がよ〜くわかる本 , 秀和システム, p. 58, ISBN 978-4-7980-2007-5 ^ 経済産業省生産動態統計年報 化学工業統計編 ^ 浜口高嘉、『過酸化水素の製造と関連製品』 月刊ファインケミカル , 2006年3月 NAID 40007161259
^ Y. Izumi, JP Patent 昭51-4097.
^ L. W. Gosser, M. A. Paoli, US5135731, 1992 .
^ Y. Nomura, T. Ishihara, Y. Hata, K. Kitawaki, H. Matsumoto, ChemSusChem , 2008, 1 , 619-621.
^ V. R. Choudhary, A. G. Galward, S. D. Sansare, Angew. Chem. Int. Ed. , 2001, 40 , 1776-1777.
^ K. Otsuka and I. Yamanaka, "One step synthesis of hydrogen peroxide through fuel cell reaction." Electrochim. Acta , 1990, 35 , 319-322. doi :10.1016/0013-4686(90)87004-L
^ I. Yamanaka, T. Onizawa, H. Suzuki, N. Hanaizumi, Chem. Lett. , 2006, 35 , 1330-1331.
^ E. Brillas, F. Alcaida, P. L. Cabot, Electrochim. Acta , 2002, 48 , 331-340.
^ I. Yamanaka, T. Onizawa, S. Takenaka, K. Otsuka, Angew. Chem. Int. Ed. , 2003, 42 , 3653-3654.
^ I. Yamanaka, S. Tazawa, T. Murayama, R. Ichihashi, N. Hanaizumi, ChemSusChem , 2008, 1 , 988-990.
^ 太陽光により水と酸素から過酸化水素を合成する革新的光触媒の開発 ^ 光電極を用いた酸化剤と水素の効率的な製造方法を開発 ^ Boris Yevseyevich Chertok (2006-06-01). Rockets and People: Creating a rocket industry ASIN B019NDFEHI . ISBN 9780160766725 . http://www.nasa.gov/pdf/635963main_RocketsPeopleVolume2-ebook.pdf . ^ 首都高速2号線におけるタンクローリー爆発事故概要 - 消防庁危険物規制課 平成11年(1999年)11月1日、2020年4月16日閲覧^ TOPIC No.2-51 タンクローリー爆発(首都高) ^ Debra Rosenberg et al . "A Mystery In The Deep." Newsweek 136.9 (2000): 34. Academic Search Premier. Web. 7 December 2011.
^ Sviatov, George. "The Kursk's Loss Offers Lessons." U.S. Naval Institute Proceedings , 129.6 (2003): 71. Academic Search Premier. Web. 7 December 2011.
^ Marshall, Geoff (July 2008), “The Loss of the HMS Sidon” , In Depth (Submarines Association Australia) 28 (4), オリジナル の2011-02-16時点におけるアーカイブ。, https://web.archive.org/web/20110216055128/http://submarinesaustralia.com/indepth_archive/in_depth__jul_08.html 2010年9月2日閲覧。 ^ a b c
“日本海沿岸地域等への廃ポリタンクの大量漂着について(第3報) ”. 環境省 (2008年3月5日). 2020年5月21日閲覧。
^ カラー図解 アメリカ版 大学生物学の教科書 第1巻 細胞生物学、David Sadavaほか、講談社、2010年、p.18.
^ A Hirono et al."A Novel Human Catalase Mutation (358 T6del) Causing Japanese-type Acatalasemia, " Blood Cells, Molecules, and Diseases (1995) 21(23) Dec 15: 232-234, PMID 8673475
^ Noctor G, Foyer CH (Jun 1998). “ASCORBATE AND GLUTATHIONE: Keeping Active Oxygen Under Control”. Annu Rev Plant Physiol Plant Mol Biol 49 : 249–279. doi :10.1146/annurev.arplant.49.1.249 . PMID 15012235 . ^ Wells WW, Xu DP (August 1994). “Dehydroascorbate reduction”. J. Bioenerg. Biomembr. 26 (4): 369–77. doi :10.1007/BF00762777 . PMID 7844111 . ^ Whitbread AK, Masoumi A, Tetlow N, Schmuck E, Coggan M, Board PG (2005). “Characterization of the omega class of glutathione transferases”. Meth. Enzymol. 401 : 78–99. doi :10.1016/S0076-6879(05)01005-0 . PMID 16399380 . ^ Rouhier N, Gelhaye E, Jacquot JP (2002). “Exploring the active site of plant glutaredoxin by site-directed mutagenesis”. FEBS Lett 511 (1-3): 145–9. doi :10.1016/S0076-6879(05)01005-0 . PMID 16399380 . ^ Meyer A (Sep 2009). “The integration of glutathione homeostasis and redox signaling”. J Plant Physiol 165 (13): 1390–403. doi :10.1016/j.jplph.2007.10.015 . PMID 18171593 . ^ Jimenez A, Hernandez JA, Pastori G, del Rio LA, Sevilla F (Dec 1998). “Role of the ascorbate-glutathione cycle of mitochondria and peroxisomes in the senescence of pea leaves” . Plant Physiol 118 (4): 1327–35. doi :10.1104/pp.118.4.1327 . PMC 34748 . PMID 9847106 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC34748/ . ^ Rouhier N, Lemaire SD, Jacquot JP (2008). “The role of glutathione in photosynthetic organisms: emerging functions for glutaredoxins and glutathionylation”. Annu Rev Plant Biol 59 : 143–66. doi :10.1146/annurev.arplant.59.032607.092811 . PMID 18444899 . ^ 市川祐介、中島洋、渡辺芳人「高度好熱菌由来シトクロム c552 を利用した ペルオキシダーゼ不安定中間体の観測 (PDF ) 」 第33回 生体分子科学討論会 2006年7月14日9:20〜9:40 のプログラム案内 [1]
^ Ichikawa, Yusuke; Nakajima, Hiroshi; Watanabe, Yoshihito (2006-10-06). “Characterization of Peroxide-Bound Heme Species Generated in the Reaction of Thermally Tolerant Cytochrome c552 with Hydrogen Peroxide” . ChemBioChem 7 (10): 1582–1589. doi :10.1002/cbic.200600135 . ISSN 1439-4227 . https://chemistry-europe.onlinelibrary.wiley.com/doi/abs/10.1002/cbic.200600135 . ^ 老化のメカニズム 2006/09/25^ 玉利祐三 5. 必須微量元素の栄養と欠乏症 - ウェイバックマシン (2015年9月20日アーカイブ分)
^ 理大の栞16:活性酸素 -解説 役立つ情報をあなたのポケットに! ^ 大阪武雄、日本化学会『活性酸素』丸善、1999年、p.27頁。ISBN 4-621-04634-9 。 ^ 白金はロケット戦闘機「秋水」製造用に(昭和20年10月20日 朝日新聞)『昭和ニュース辞典第8巻 昭和17年/昭和20年』毎日コミュニケーションズ刊 1994年 148頁