アジ化水素
別称
Hydrogen azide
識別情報
ChEBI
ChEMBL
ChemSpider
ECHA InfoCard 100.029.059
EC番号
Gmelin参照
773
UNII
InChI=1S/HN3/c1-3-2/h1H
Key: JUINSXZKUKVTMD-UHFFFAOYSA-N
InChI=1/HN3/c1-3-2/h1H
Key: JUINSXZKUKVTMD-UHFFFAOYAO
特性
化学式
HN3
モル質量
43.03 g mol−1
外観
無色、揮発性の高い液体
密度
1.09 g/cm3
融点
-80 °C , 193 K, -112 °F
沸点
37 °C , 310 K, 99 °F
水 への溶解度
溶けやすい
溶解度
アルカリ、エタノール、ジエチルエーテルに溶ける
酸解離定数 pK a
4.6 [ 1]
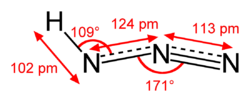
構造
ほぼ直線
危険性
労働安全衛生
主な危険性
猛毒性、爆発性、反応性
GHS 表示
Danger
H200 , H319 , H335 , H370
P201 , P202 , P260 , P261 , P264 , P270 , P271 , P280 , P281 , P304+P340 , P305+P351+P338 , P307+P311 , P312 , P321 , P337+P313 , P372 , P373 , P380 , P401 , P403+P233 , P405 , P501
NFPA 704
関連する物質
その他の陽イオン
アジ化ナトリウム アジ化リチウム アジ化カリウム
関連する水素化窒素
アンモニア ヒドラジン
特記なき場合、データは常温 (25 °C )・常圧 (100 kPa) におけるものである。
アジ化水素 (—かすいそ、英語 : hydrogen azide )は、化学式 が HN3 で表される無機 酸の一種[ 2] アジ化水素酸 (英語 : hydrazoic acid )、アゾイミド (英語 : azoimide )[ 3] CAS登録番号 は [7782-79-8]。
シアン化水素(青酸 )並みの猛毒で、皮膚、粘膜などを刺激する。取り扱いには適切な設備と厳重な管理を要する。
アジ化水素は1890年、テオドール・クルチウスにより最初に単離された[ 4]
アジ化水素は弱酸性を持つ (pKa 4.6–4.7)。水 に溶けやすく、水溶液は多くの金属(亜鉛 、鉄 など)を、水素 を放出しながら溶かす。そのとき、金属のアジ化物 を生成する。
多くの金属アジ化物には爆発性が知られる。また、無水物の結晶は加熱により分解し、金属の純品を与える。鉛 や銀 、水銀 のアジ化物は水に難溶であり、そのことはハロゲン化水素 とアジ化水素との類似点である。アジ化物はまた、ヨウ化アルキル と容易に反応する。
カルボン酸ハロゲン化物 やアルデヒド 、ケトン などに作用させると、シュミット反応 を引き起こす。
アジ化水素はアジ化ナトリウム などの塩に酸を作用させて得る。
毒性は青酸に匹敵し、後遺症の報告もある[ 5]
アジ化ナトリウムが胃酸 と反応し、アジ化水素を発生させ、治療者に二次被害を与える危険性がある[ 6] [ 6]
^ Pradyot Patnaik. Handbook of Inorganic Chemicals . McGraw-Hill, 2002, ISBN 0-07-049439-8
^ Dictionary of Inorganic and Organometallic Compounds . Chapman & Hall ^ Chisholm, Hugh , ed. (1911). “Azoimide” Encyclopædia Britannica 82– 83.^ Curtius, Th. Berichte 1890 , 23 , 3023.
^ 宮川定吉「アジ化水素による中毒の後遺症と判断される1例について」『産業医学』第20巻第5号、社団法人日本産業衛生学会、1978年、267-277頁、doi :10.1539/joh1959.20.276 。 ^ a b 広瀬保夫,畑耕治郎,本多拓,山崎芳彦,堀寧,大関暢「アジ化ナトリウム集団中毒症例の検討」『日本救急医学会雑誌』第12巻第3号、日本救急医学会、2001年、125-129頁、doi :10.3893/jjaam.12.125 。