ņĀ¼ņŗ£ĒāĆļ╣ł
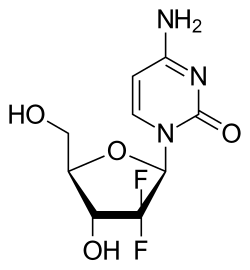
ņĀ¼ņŗ£ĒāĆļ╣ł(Gemcitabine)ņØĆ ĒÖöĒĢÖņÜöļ▓Ģ ņĢĮļ¼╝ņØ┤ļŗż. ņĀ¼ņ×É(Gemzar) ļō▒ņØś ņāüĒÆłļ¬ģņ£╝ļĪ£ ĒīÉļ¦żļÉ£ļŗż.[1] Ļ│ĀĒÖśņĢö,[2] ņ£Āļ░®ņĢö, ļé£ņåīņĢö, ļ╣äņåīņäĖĒżĒÅÉņĢö, ņĘīņןņĢö, ļ░®Ļ┤æņĢö ļō▒ņØś ņĢö ņ╣śļŻīņŚÉ ņé¼ņÜ®ĒĢ£ļŗż.[3][4] ņĀĢļ¦ź ņŻ╝ņé¼ļĪ£ Ēł¼ņŚ¼ĒĢ£ļŗż.[3] ņØĖĒä░ĒÄśļĪĀ ņŗĀĒśĖ ņĀäļŗ¼ņØś ņāüĒ¢ź ņĪ░ņĀłņØä ĒåĄĒĢ┤ ņóģņ¢æ ņä▒ņןņØä ņ¢ĄņĀ£ĒĢśĻ│Ā EĒśĢ Ļ░äņŚ╝ņØś ņøÉņØĖ ļ░öņØ┤ļ¤¼ņŖżņØĖ ņśżļź┤ĒåĀĒŚżĒÄśļ░öņØ┤ļ¤¼ņŖż AņØś ļ│ĄņĀ£ļź╝ ņ¢ĄņĀ£ĒĢ£ļŗż.[5] ļ╣äĻĄÉņĀü ĒØöĒĢ£ ļČĆņ×æņÜ®ņ£╝ļĪ£ļŖö Ļ│©ņłś ņ¢ĄņĀ£, Ļ░ä ļ░Å ņŗĀņן ļ¼ĖņĀ£, ļ®öņŖżĻ║╝ņøĆ, ļ░£ņŚ┤, ļ░£ņ¦ä, ĒśĖĒØĪĻ│żļ×Ć, ĻĄ¼Ļ░Ģ ĻČżņ¢æ, ņäżņé¼, ņŗĀĻ▓Įļ│æņ”Ø, Ēāłļ¬© ļō▒ņØ┤ ņ׳ļŗż.[3] ņ×äņŗĀ ņżæņŚÉ ņé¼ņÜ®ĒĢśļ®┤ Ēā£ņĢäņŚÉ ĒĢ┤ļź╝ ļü╝ņ╣Ā ņłś ņ׳ļŗż.[3] ņĀ¼ņŗ£ĒāĆļ╣łņØĆ ļē┤Ēü┤ļĀłņśżņé¼ņØ┤ļō£ ņ£Āņé¼ņ▓┤ ņĢĮļ¼╝ Ļ│äņŚ┤ņŚÉ ņåŹĒĢ£ļŗż.[3] ņāłļĪ£ņÜ┤ DNAņØś ņāØņä▒ņØä ņ░©ļŗ©ĒĢśņŚ¼ ņäĖĒż ņé¼ļ®ĖņØä ņØ╝ņ£╝ĒéżļŖö ļ░®ņŗØņ£╝ļĪ£ ņ×æļÅÖĒĢ£ļŗż.[3] ņĀ¼ņŗ£ĒāĆļ╣łņØĆ 1983ļģäņŚÉ ĒŖ╣ĒŚłļź╝ ļ░øņĢśĻ│Ā 1995ļģäņŚÉ ņØśļŻīņÜ®ņ£╝ļĪ£ ņŖ╣ņØĖļÉśņŚłļŗż.[6] ļ│ĄņĀ£ņĢĮņØĆ 2009ļģäņŚÉļŖö ņ£Āļ¤ĮņŚÉ, 2010ļģäņŚÉļŖö ļ»ĖĻĄŁņŚÉņä£ ļÅäņ×ģļÉśņŚłļŗż.[7][8] WHO ĒĢäņłś ņØśņĢĮĒÆł ļ¬®ļĪØņŚÉ ĒżĒĢ©ļÉśņ¢┤ ņ׳ļŗż.[9] ņØśĒĢÖņĀü ņé¼ņÜ®ņĀ¼ņŗ£ĒāĆļ╣łņØĆ ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ņĢöņóģņØś ņ╣śļŻīņŚÉ ņé¼ņÜ®ļÉ£ļŗż. ļŗ©ļÅģņ£╝ļĪ£ ņé¼ņÜ®ĒĢĀ ņŗ£ ņĘīņןņĢöņØś ņØ╝ņ░© ņ╣śļŻīņĀ£ļĪ£, ņŗ£ņŖżĒöīļØ╝Ēŗ┤Ļ│╝ ļ│æņÜ®ĒĢĀ ļĢīļŖö ļ¦ÉĻĖ░ļéś ņĀäņØ┤ņä▒ ļ╣äņåīņäĖĒżĒÅÉņĢöĻ│╝ ļ░®Ļ┤æņĢöņØś ņ╣śļŻīņŚÉ ņōĖ ņłś ņ׳ļŗż. ņ╣┤ļ│┤ĒöīļØ╝Ēŗ┤Ļ│╝ ļ│æņÜ®ĒĢĀ Ļ▓ĮņÜ░ ļé£ņåīņĢöņØś, ĒīīĒü┤ļ”¼ĒāüņģĆĻ│╝ ļ│æņÜ®ĒĢĀ Ļ▓ĮņÜ░ ņĀäņØ┤Ē¢łĻ▒░ļéś ņłśņłĀļĪ£ ņĀ£Ļ▒░Ļ░Ć ļČłĻ░ĆļŖźĒĢ£ ņ£Āļ░®ņĢöņØś ņ╣śļŻīņŚÉ ņé¼ņÜ®ĒĢ£ļŗż.[10][11][12] ļŗ┤Ļ┤ĆņĢö[13]Ļ│╝ ĻĖ░ĒāĆ ļŗ┤ļÅäĻ│äņØś ņĢöņŚÉņä£ ņśżĒöäļØ╝ļ▓©ļĪ£ ĒØöĒ׳ ņ╣śļŻīņŚÉ ņé¼ņÜ®ļÉ£ļŗż.[14] ĒĢŁņĢöĒÖöĒĢÖņÜöļ▓ĢņØä ņŗżņŗ£ĒĢĀ ļĢī ņĀĢļ¦ź ņŻ╝ņé¼ļĪ£ Ēł¼ņŚ¼ĒĢ£ļŗż.[3] ļČĆņ×æņÜ®ņĀ¼ņŗ£ĒāĆļ╣łņØĆ ļČäņŚ┤ ņżæņØĖ ņ¢┤ļ¢ż ņäĖĒżļōĀ ņŻĮņŚ¼ņä£ ņ×æņÜ®ĒĢśļŖö ĒĢŁņĢöņĀ£ņØ┤ļŗż.[10] ļö░ļØ╝ņä£ ļ╣Āļź┤Ļ▓ī ļČäņŚ┤ĒĢśļŖö ņĢöņäĖĒżĻ░Ć ņĀ¼ņŗ£ĒāĆļ╣łņØś Ēæ£ņĀüņØ┤ ļÉśļŖö ļ╣äņ£©ņØ┤ ļåÆņØĆ Ļ▓āņØ┤ļŗż. ĻĘĖļ¤¼ļéś Ēö╝ļČĆ, ļæÉĒö╝, ņ£äņןĻ┤Ćļ▓Į, Ļ│©ņłś ļō▒ ļ╣Āļź┤Ļ▓ī ļČäņŚ┤ĒĢśļŖö ļ¬ĖņØś ņĀĢņāü ņäĖĒżļōż ņŚŁņŗ£ ņĀ¼ņŗ£ĒāĆļ╣łņØś Ēæ£ņĀüņØ┤ ļÉśļ»ĆļĪ£ ļČĆņ×æņÜ®ņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ļŗż.[15]:265 ņĀ¼ņŗ£ĒāĆļ╣łņØś ļØ╝ļ▓©ņŚÉņä£ļŖö ņĀ¼ņŗ£ĒāĆļ╣łņØ┤ Ļ│©ņłś ĻĖ░ļŖźņØä ņ¢ĄņĀ£ĒĢśņŚ¼ ļ░▒ĒśłĻĄ¼Ļ░Éņåīņ”Ø, ĒśłņåīĒīÉĻ░Éņåīņ”Ø, ĻĘĖļ”¼Ļ│Ā ņĀüĒśłĻĄ¼ ņåÉņŗżļĪ£ ņØĖĒĢ£ ļ╣łĒśł ļō▒ņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ņ£╝ļ®░, Ļ░äņØ┤ļéś ņŗĀņן, ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖśņØ┤ ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ļŖö ņĪ░ņŗ¼ĒĢśņŚ¼ ņé¼ņÜ®ĒĢ┤ņĢ╝ ĒĢ£ļŗżļŖö Ļ▓ĮĻ│Āļź╝ ĒżĒĢ©ĒĢśĻ│Ā ņ׳ļŗż. ļśÉĒĢ£ ņĀ¼ņŗ£ĒāĆļ╣łņØä Ēł¼ņŚ¼ ļ░øĻ│Ā ņ׳ļŖö ĒÖśņ×ÉļŖö ņāØļ░▒ņŗĀņØä ņĀæņóģ ļ░øņĢäņä£ļŖö ņĢłļÉ£ļŗż. ĒĢ£ĒÄĖ Ļ▓ĮĻ│Ā ļØ╝ļ▓©ņŚÉņä£ļŖö ņĀ¼ņŗ£ĒāĆļ╣łņØ┤ Ļ░ĆņŚŁņĀü ĒøäļæÉļČĆ ļćīļ│æņ”Ø ņ”ØĒøäĻĄ░, ļ¬©ņäĖĒśłĻ┤Ć ļłäņČ£ ņ”ØĒøäĻĄ░, Ēś╣ņØĆ ĒÅÉļČĆņóģ, ĒÅÉļĀ┤, ņä▒ņØĖ ĒśĖĒØĪĻ│żļ×Ć ņ”ØĒøäĻĄ░Ļ│╝ Ļ░ÖņØĆ ņŗ¼Ļ░üĒĢ£ ĒÅÉ ņ¦łĒÖś ņøÉņØĖņØ┤ ļÉĀ ņłś ņ׳ņ£╝ļ®░ ņĀĢņ×ÉņŚÉļÅä ņ£ĀĒĢ┤ĒĢĀ ņłś ņ׳ļŗżĻ│Ā ĻĖ░ņłĀĒĢśĻ│Ā ņ׳ļŗż.[10][16] Ēł¼ņŚ¼ ļ░øņØĆ ņé¼ļ×ī ņżæ 10% ņØ┤ņāüņŚÉņä£ ĒśĖĒØĪĻ│żļ×Ć, ņĀüĒśłĻĄ¼ņÖĆ ļ░▒ĒśłĻĄ¼, ĒśłņåīĒīÉņØś Ļ░Éņåī, ĻĄ¼ņŚŁņ¦łĻ│╝ ĻĄ¼ĒåĀ, ĒŖĖļ×£ņŖżņĢäļ»ĖļäżņØ┤ņŖż ņ”ØĻ░Ć (Ļ░ä ĒÜ©ņåī ņłśņ╣ś ņ”ØĻ░Ć), ļ░£ņ¦äĻ│╝ Ļ░ĆļĀżņøĆņ”Ø, Ēāłļ¬©, Ēśłļć©ņÖĆ ļŗ©ļ░▒ļć©, ļÅģĻ░É ņ£Āņé¼ ņ”Øņāü, ļČĆņóģ ļō▒ņØ┤ ļ░£ņāØĒĢ£ļŗż.[10][17] Ēł¼ņŚ¼ ļ░øņØĆ ņé¼ļ×īņØś 1~10% ņĀĢļÅäņŚÉņä£ ļ░£ņāØĒĢśļŖö ĒØöĒĢ£ ļČĆņ×æņÜ®ņŚÉļŖö ļ░£ņŚ┤, ņŗØņÜĢļČĆņ¦ä, ņłśļ®┤ņןņĢĀ, ļæÉĒåĄ, Ēö╝ļĪ£Ļ░É, ĻĖ░ņ╣©, ņĮ¦ļ¼╝, ņäżņé¼, ņ×ģĻ│╝ ņ×ģņłĀņØś ņŚ╝ņ”Ø, ļ░£ĒĢ£, ņÜöĒåĄ, ĻĘ╝ņ£ĪĒåĄņØ┤ ņ׳ļŗż.[10] ĒśłņĀäņä▒ ĒśłņåīĒīÉĻ░Éņåīņä▒ ņ×Éļ░śņ”Ø (TTP)ļŖö ļō£ļ¼╝ņ¦Ćļ¦ī ņŗ¼Ļ░üĒĢ£ ļČĆņ×æņÜ®ņ£╝ļĪ£, ņĀ¼ņŗ£ĒāĆļ╣łĻ│╝ Ļ░ÖņØĆ ĒŖ╣ņĀĢ ĒĢŁņĢöņĀ£ļź╝ ļ│ĄņÜ®Ē¢łņØä ļĢī ļéśĒāĆļéĀ ņłś ņ׳ļŗż. TTPļŖö ĒśłņĢĪ ņ¦łĒÖśņØ┤ļ®░ ļ»ĖņäĖĒśłĻ┤Ćļ│æņÜ®Ēśłļ╣łĒśł (MAHA), ņŗĀĻ▓ĮĒĢÖņĀü ņØ┤ņāü,ļ░£ņŚ┤, ņŗĀņןļ│æ ļō▒ņ£╝ļĪ£ ņØ┤ņ¢┤ņ¦ł ņłś ņ׳ļŗż.[18] ĻĖłĻĖ░ņ”Ø ļ░Å ņāüĒśĖņ×æņÜ®ņĀ¼ņŗ£ĒāĆļ╣ł Ēł¼ņŚ¼ļŖö ļé©ņä▒Ļ│╝ ņŚ¼ņä▒ņØś ņāØņŗØ ĻĖ░ļŖź, ņä▒ņāØĒÖ£, ņāØļ”¼ ļō▒ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłś ņ׳ļŗż. ņĀ¼ņŗ£ĒāĆļ╣łņØä Ēł¼ņŚ¼ ļ░øĻ│Ā ņ׳ļŖö ņŚ¼ņä▒ņØĆ ņ×äņŗĀĒĢ┤ņä£ļŖö ņĢłļÉśļ®░, ņ×äņŗĀĒ¢łĻ▒░ļéś ņłśņ£Ā ņżæņØĖ ņŚ¼ņä▒ņØĆ ņĀ¼ņŗ£ĒāĆļ╣ł Ēł¼ņŚ¼ņØś ĻĖłĻĖ░ņ”ØņØ┤ ļÉ£ļŗż.[17] 2014ļģä ĻĖ░ņżĆņ£╝ļĪ£ ņŚ░ĻĄ¼Ļ░Ć ņØ┤ļŻ©ņ¢┤ņ¦ä ņĢĮļ¼╝ ņāüĒśĖņ×æņÜ®ņØĆ ņŚåļŗż.[11][10] ņĢĮļ”¼ĒĢÖņĀ¼ņŗ£ĒāĆļ╣łņØĆ ņ╣£ņłśņä▒ņ£╝ļĪ£, ļē┤Ēü┤ļĀłņśżņé¼ņØ┤ļō£ ņłśņåĪņ▓┤ļź╝ ĒåĄĒĢ┤ ņäĖĒż ņĢłņ£╝ļĪ£ ņłśņåĪļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż. ņĀ¼ņŗ£ĒāĆļ╣łņØ┤ ņØ┤ņÜ®ĒĢśļŖö Ļ░Ćņן ĒØöĒĢ£ ņłśņåĪņ▓┤ļŖö SLC29A1, SLC28A1, SLC28A3 ļō▒ņØ┤ ņ׳ļŗż.[19][20] ņäĖĒż ņĢłņ£╝ļĪ£ ļōżņ¢┤ņś© ņĀ¼ņŗ£ĒāĆļ╣łņØĆ ņÜ░ņäĀ ņØĖņé░ĻĖ░Ļ░Ć ļČÖņ¢┤ ņĀ¼ņŗ£ĒāĆļ╣ł ņØ╝ņØĖņé░(gemcitabine monophosphate, dFdCMP)ņØ┤ ļÉ£ļŗż.[19][20] ņØ┤ Ļ│╝ņĀĢņØĆ ļööņśźņŗ£ņé¼ņØ┤Ēŗ░ļöś ņØĖņé░ĒÖöĒÜ©ņåī(DCK)Ļ░Ć ņ┤ēļ¦żĒĢśļ®░, ņĀäņ▓┤ Ļ│╝ņĀĢņØś ņåŹļÅä Ļ▓░ņĀĢ ļŗ©Ļ│äņŚÉ ĒĢ┤ļŗ╣ĒĢ£ļŗż.[19][20] ļŗżļźĖ ĒÜ©ņåīņŚÉ ņØśĒĢ┤ dFdCMPņŚÉ ļæÉ Ļ░£ņØś ņØĖņé░ĻĖ░Ļ░Ć ļŹö ļČÖļŖöļŗż. ņäĖ Ļ░£ņØś ņØĖņé░ĻĖ░Ļ░Ć ļČÖņØĆ ņĀ¼ņŗ£ĒāĆļ╣łņØĆ ņĀ¼ņŗ£ĒāĆļ╣ł ņé╝ņØĖņé░(gemcitabine triphosphate, dFdCTP)ņØ┤ ļÉśņ¢┤ ņĢĮļ”¼ĒĢÖņĀüņ£╝ļĪ£ ĒÖ£ņä▒ņØä Ļ░Ćņ¦äļŗż.[19][21] ņäĖ ļ▓ł ņØĖņé░ĒÖöļÉ£ ņĀ¼ņŗ£ĒāĆļ╣łņØĆ ļööņśźņŗ£ņé¼ņØ┤Ēŗ░ļöś ņé╝ņØĖņé░ņØä ĒØēļé┤ļé┤ņ¢┤, ņäĖĒżĻ░Ć ļ│ĄņĀ£ļÉśļ®┤ņä£ ņāłļĪ£ņÜ┤ DNA Ļ░ĆļŗźņØä ĒĢ®ņä▒ĒĢĀ ļĢī ļīĆņŗĀ ĻĖ░ņ¦łļĪ£ ņé¼ņÜ®ļÉ£ļŗż.[3][19][20] ņĀ¼ņŗ£ĒāĆļ╣łņØ┤ DNAļĪ£ ļōżņ¢┤ņÖĆļÅä ņĀĢņāüņĀüņØĖ ļē┤Ēü┤ļĀłņśżņé¼ņØ┤ļō£Ļ░Ć ĻĘĖ ņØ┤ĒøäļĪ£ Ļ│äņåŹ ļōżņ¢┤ņś¼ ņłś ņ׳ļŗż. ņĀ¼ņŗ£ĒāĆļ╣łņØĆ Ļ░Ćņ¦£ ņŚ╝ĻĖ░ņ¦Ćļ¦ī, ņØ┤ņøāĒĢ£ ņĀĢņāü ļē┤Ēü┤ļĀłņśżņé¼ņØ┤ļō£ļĪ£ ņØĖĒĢ┤ ņäĖĒżņØś ļ│ĄĻĄ¼ Ļ│╝ņĀĢ(ņŚ╝ĻĖ░ņĀłņĀ£ņłśņäĀ)ņØä ĒÜīĒö╝ĒĢĀ ņłś ņ׳Ļ▓ī ļÉśĻ│Ā, ļ│ĄņĀ£ Ļ│╝ņĀĢņØĆ ņĀ¼ņŗ£ĒāĆļ╣łņØ┤ Ļ░ĆļĀżņ¦ä ņ▒ä ņóģĻ▓░ļÉ£ļŗż. (masked chain termination) ļö░ļØ╝ņä£ ņĀ¼ņŗ£ĒāĆļ╣łņØ┤ ņäĖĒżņØś DNAņŚÉ ļōżņ¢┤Ļ░Ćļ®┤ ļ│ĄĻĄ¼ ļČłĻ░ĆļŖźĒĢ£ ņśżļźśĻ░Ć ņāØĻĖ░Ļ│Ā ņČöĻ░ĆņĀüņØĖ DNA ĒĢ®ņä▒ņØ┤ ņ¢ĄņĀ£ļÉśņ¢┤, Ļ▓░ĻĄŁ ņäĖĒżņØś ņé¼ļ®ĖļĪ£ ņØ┤ņ¢┤ņ¦äļŗż.[3][19][20] ņĀ¼ņŗ£ĒāĆļ╣łņŚÉ ņØĖņé░ĻĖ░Ļ░Ć ļæÉ Ļ░£ļ¦ī ļČÖņØĆ ņĀ¼ņŗ£ĒāĆļ╣ł ņØ┤ņØĖņé░ (dFdCDP) ņŚŁņŗ£ ĒÖ£ņä▒ņØä Ļ░Ćņ¦ĆļŖöļŹ░, ņāłļĪ£ņÜ┤ DNA ļē┤Ēü┤ļĀłņśżĒāĆņØ┤ļō£ļź╝ ļ¦īļō£ļŖö ļŹ░ņŚÉ ĒĢäņÜöĒĢ£ ĒÜ©ņåīņØĖ ļ”¼ļ│┤ļē┤Ēü┤ļĀłņśżĒāĆņØ┤ļō£ ĒÖśņøÉĒÜ©ņåī(RNR)ņØä ņ¢ĄņĀ£ĒĢ£ļŗż. ļē┤Ēü┤ļĀłņśżĒāĆņØ┤ļō£Ļ░Ć Ļ│ĀĻ░łļÉśļ®┤ ņäĖĒżĻ░Ć ļē┤Ēü┤ļĀłņśżĒāĆņØ┤ļō£ ĒĢ®ņä▒ņŚÉ ĒĢäņÜöĒĢ£ ļ¼╝ņ¦łņØä ļŹö ļ¦ÄņØ┤ ņäĖĒż ļ░öĻ╣źņŚÉņä£ ņäŁņĘ©ĒĢ£ļŗż.[3][19][20][22] ĒÖöĒĢÖņĀ¼ņŗ£ĒāĆļ╣łņØĆ ĒĢ®ņä▒ ņĢĮļ¼╝ļĪ£, Ēö╝ļ”¼ļ»Ėļöś ļē┤Ēü┤ļĀłņśżņé¼ņØ┤ļō£ ņĀäĻĄ¼ņĢĮļ¼╝ņØ┤ļ®░ ļē┤Ēü┤ļĀłņśżņé¼ņØ┤ļō£ ņ£Āņé¼ņ▓┤ņŚÉ ņåŹĒĢ£ļŗż. ļööņśźņŗ£ņé¼ņØ┤Ēŗ░ļöśņØś 2' ĒāäņåīņŚÉ ļČÖņ¢┤ ņ׳ļŖö ņłśņåī ņøÉņ×ÉĻ░Ć ĒöīļŻ©ņśżļ”░ ņøÉņ×ÉļĪ£ ļīĆņ▓┤ļÉśņ¢┤ ņ׳ļŗż.[3][23][24] ņĢäļלņŚÉ ĻĖ░ņłĀļÉ£ ĒĢ®ņä▒ Ļ│╝ņĀĢņØĆ ņØ╝ļØ╝ņØ┤ ļ”┤ļ”¼ ņĢżļō£ ņ╗┤ĒŹ╝ļŗł ņŚ░ĻĄ¼ņŗżņŚÉņä£ ļ│Ėļל ņłśĒ¢ēĒ¢łļŹś ĒĢ®ņä▒ Ļ│╝ņĀĢņØ┤ļŗż. ĒĢ®ņä▒ Ļ│╝ņĀĢņØĆ Ļ┤æĒĢÖ ņØ┤ņä▒ņ¦łņ▓┤ ņł£ņłś(enantiopure) D-ĻĖĆļ”¼ņäĖļź┤ņĢīļŹ░ĒĢśņØ┤ļō£ (R)-2ņŚÉņä£ ņŗ£ņ×æĒĢśļ®░, ņØ┤ ļ¼╝ņ¦łņØĆ D-ļ¦īļŗłĒå©ņŚÉņä£ 2~7ļŗ©Ļ│äļź╝ Ļ▒░ņ│É ļ¦īļōż ņłś ņ׳ļŗż. ĻĘĖ Ēøä ņŚÉĒŗĖ ļĖīļĪ£ļ¬©ļŗżņØ┤ĒöīļŻ©ņśżļĪ£ņĢäņäĖĒŖĖņé░ņØä ņé¼ņÜ®ĒĢśņŚ¼ ĒöīļŻ©ņśżļ”░ņØä ļÅäņ×ģĒĢ£ļŗż. ļŗżņØīņ£╝ļĪ£ļŖö Ēæ£ņżĆ ņĪ░Ļ▒┤ ĒĢśņŚÉņä£ņØś ļĀłĒżļź┤ļ¦łņĖĀĒéż ļ░śņØæņØä ĒåĄĒĢ┤ 3:1 anti/syn ļČĆļČäņ×ģņ▓┤ ņØ┤ņä▒ņ¦łņ▓┤ Ēś╝ĒĢ®ļ¼╝ņØ┤ ļ¦īļōżņ¢┤ņ¦Ćļ®░, ņØ┤ ņżæ anti ņ¬ĮņØ┤ ņøÉĒĢśļŖö ņāØņé░ļ¼╝ņØ┤ļŗż. HPLCļź╝ ĒåĄĒĢ┤ ļČĆļČäņ×ģņ▓┤ ņØ┤ņä▒ņ¦łņ▓┤ļź╝ ļČäļ”¼ĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņØ┤ļź╝ ĒåĄĒĢ┤ ņłśņ£© 65%ļĪ£ anti-3 ņĀ¼ņŗ£ĒāĆļ╣łņØä ņ¢╗ļŖöļŗż.[23][24] ņĄ£ņåīĒĢ£ ļæÉ Ļ░Ćņ¦ĆņØś ņä£ļĪ£ ļŗżļźĖ ņÖäņĀäĒĢ£ ĒĢ®ņä▒ Ļ│╝ņĀĢņØ┤ ļŗżļźĖ Ļ││ņŚÉņä£ļÅä Ļ░£ļ░£ļÉśņŚłļŗż.[24]  ņŚŁņé¼ņĀ¼ņŗ£ĒāĆļ╣łņØĆ ņØ╝ļØ╝ņØ┤ ļ”┤ļ”¼ ņĢżļō£ ņ╗┤ĒŹ╝ļŗłņØś ļלļ”¼ ĒŚżļź┤ĒŗĖ(Larry Hertel) ņŚ░ĻĄ¼ņŗżņŚÉņä£ 1980ļģä ņ┤łļ░ś ņ▓śņØīņ£╝ļĪ£ ĒĢ®ņä▒ĒĢśņśĆļŗż. ņ▓śņØī ņØśļÅäĒĢ£ Ļ▓āņØĆ ĒĢŁļ░öņØ┤ļ¤¼ņŖżņĀ£ļĪ£ņä£ņØś ĒÜ©ļŖźņØ┤ņŚłņ£╝ļéś, ņĀäņ×äņāüņŗ£ĒŚś Ļ▓░Ļ│╝ in vitro ĒÖśĻ▓ĮņŚÉņä£ ļ░▒Ēśłļ│æ ņäĖĒżļź╝ ņŻĮņØ┤ļŖö Ļ▓āņØ┤ ļ░ØĒśĆņĪīļŗż.[25] 1990ļģäļīĆ ņ┤łļ░ś ļōżņ¢┤ ņ×äņāüņŗ£ĒŚśņØä ĒåĄĒĢ┤ ņĀ¼ņŗ£ĒāĆļ╣ł Ļ┤ĆļĀ© ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ēļÉśņŚłļŗż. ņĘīņןņĢö ņ×äņāüņŗ£ĒŚśņŚÉņä£ ņĀ¼ņŗ£ĒāĆļ╣łņØĆ 1ļģä ņāØņĪ┤ļźĀņØä Ēü¼Ļ▓ī ļŖśļĀżņŻ╝ļŖö Ļ▓āņØ┤ ļ░ØĒśĆņĪīļŗż. ĻĘĖ Ļ▓░Ļ│╝ 1995ļģä ņśüĻĄŁņŚÉņä£ ņĘīņןņĢöņŚÉ ļīĆĒĢ£ ņé¼ņÜ® ņŖ╣ņØĖņØä ļ░øņĢśĻ│Ā[10] FDAļŖö 1996ļģä ņĘīņןņĢöņŚÉ ļīĆĒĢ£ ņé¼ņÜ® ĒŚłĻ░Ćļź╝ ļāłļŗż.[4] 1998ļģä, FDAņŚÉņä£ļŖö ņĀ¼ņŗ£ĒāĆļ╣łņØä ļ╣äņåīņäĖĒżĒÅÉņĢö ņ╣śļŻīņŚÉ ļīĆĒĢśņŚ¼ ņé¼ņÜ®ņØä ĒŚłĻ░ĆĒ¢łļŗż. 2004ļģäņŚÉļŖö ņĀäņØ┤ņä▒ ņ£Āļ░®ņĢö ņ╣śļŻīņŚÉ FDAņŚÉņä£ ņé¼ņÜ®ņØä ĒŚłĻ░ĆĒĢśņśĆļŗż.[4] ņ£Āļ¤ĮņØś ļØ╝ļ▓©ņØĆ 2008ļģä EMAņÖĆ ĒåĄņØ╝ļÉśņŚłļŗż.[26] 2008ļģä ĻĖ░ņżĆ ļ”┤ļ”¼ņŚÉņä£ ņĀ¼ņŗ£ĒāĆļ╣łņ£╝ļĪ£ ņś¼ļ”░ ļ¦żņČ£ņØĆ 17ņ¢Ą ļŗ¼ļ¤¼ņŚÉ ņØ┤ļź┤ļĀĆļŗż. ļŗ╣ņŗ£ ņĀ¼ņŗ£ĒāĆļ╣łņØś ļ»ĖĻĄŁņŚÉņä£ņØś ĒŖ╣ĒŚłĻČīņØĆ 2013ļģäņŚÉ, ņ£Āļ¤ĮņŚÉņä£ņØś ĒŖ╣ĒŚłĻČīņØĆ 2009ļģäņŚÉ ļ¦īļŻīļÉĀ ņśłņĀĢņØ┤ņŚłļŗż.[27] ņ▓½ ļ▓łņ¦Ė ļ│ĄņĀ£ņĢĮņØĆ 2009ļģä ņ£Āļ¤ĮņŚÉņä£ ļ¦īļōżņ¢┤ņĪīņ£╝ļ®░,[7] ļ»ĖĻĄŁņŚÉņä£ļŖö ĒŖ╣ĒŚłĻČīņŚÉ ļīĆĒĢ£ ņØ┤ņØśĻ░Ć ņĀ£ĻĖ░ļÉśņ¢┤ ņĢĮļ¼╝ ņĀ£ņĪ░ļ▓ĢņŚÉ ļīĆĒĢ£ ļ”┤ļ”¼ņØś ĒŖ╣ĒŚłĻČīņØ┤ ļ¼┤ĒÜ©ĒÖöļÉśņŚłļŗż.[28][29] ļ│ĄņĀ£ņĢĮ ĒÜīņé¼ļōżņØĆ ļ»ĖĻĄŁņŚÉņä£ ĒÖöĒĢÖ ļ¼╝ņ¦ł ĻĘĖ ņ×Éņ▓┤ņŚÉ ļīĆĒĢ£ ĒŖ╣ĒŚłĻ░Ć ļ¦īļŻīļÉśņ×É 2010ļģäļČĆĒä░ ļ│ĄņĀ£ņĢĮņØä ļ¦īļōżņ¢┤ ĒīöĻĖ░ ņŗ£ņ×æĒĢśņśĆļŗż.[29][8] ņżæĻĄŁņŚÉņä£ ļ▓īņ¢┤ņ¦ä ĒŖ╣ĒŚłĻČī ņåīņåĪņØĆ ĒŚżļō£ļØ╝ņØĖņŚÉ ņśżļź┤ĻĖ░ļÅä ĒĢśļ®┤ņä£ 2010ļģäņØ┤ ļÉśņ¢┤ņä£ ĒĢ┤Ļ▓░ļÉśņŚłļŗż.[30] Ļ░üņŻ╝
ņÖĖļČĆ ļ¦üĒü¼
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia