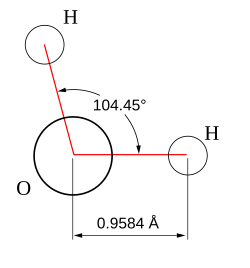
Geometry of the water molecule Ó┤żÓ┤©ÓĄŹÓ┤«Ó┤ŠÓ┤żÓĄŹÓ┤░Ó┤ĢÓ┤│Ó┤┐ÓĄĮ Ó┤åÓ┤▒ÓĄŹÓ┤▒Ó┤ÖÓĄŹÓ┤ÖÓĄŠ Ó┤ĄÓ┤┐Ó┤©ÓĄŹÓ┤»Ó┤ĖÓ┤┐Ó┤ÜÓĄŹÓ┤ÜÓ┤┐Ó┤░Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤©Ó┤żÓ┤┐Ó┤©ÓĄŹÓ┤▒ÓĄå Ó┤żÓĄŹÓ┤░Ó┤┐Ó┤«Ó┤ŠÓ┤©Ó┤░ÓĄĆÓ┤żÓ┤┐Ó┤»ÓĄåÓ┤»Ó┤ŠÓ┤ŻÓĄŹ Ó┤żÓ┤©ÓĄŹÓ┤«Ó┤ŠÓ┤żÓĄŹÓ┤░Ó┤Š Ó┤£ÓĄŹÓ┤»ÓĄŗÓ┤«ÓĄåÓ┤¤ÓĄŹÓ┤░Ó┤┐ ('Molecular geometry) Ó┤ÄÓ┤©ÓĄŹÓ┤©Ó┤żÓĄüÓ┤ĢÓĄŖÓ┤ŻÓĄŹÓ┤¤ÓĄŹ Ó┤ĄÓ┤┐Ó┤ĄÓ┤ĢÓĄŹÓ┤ĘÓ┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤©Ó┤żÓĄŹ. Ó┤ćÓ┤żÓ┤┐ÓĄĮ Ó┤żÓ┤©ÓĄŹÓ┤«Ó┤ŠÓ┤żÓĄŹÓ┤░Ó┤»ÓĄüÓ┤¤ÓĄå Ó┤░ÓĄéÓ┤¬Ó┤żÓĄŹÓ┤żÓ┤┐Ó┤©ÓĄüÓ┤¬ÓĄüÓ┤▒Ó┤«ÓĄć Ó┤åÓ┤▒ÓĄŹÓ┤▒Ó┤ÖÓĄŹÓ┤ÖÓĄŠ Ó┤żÓ┤«ÓĄŹÓ┤«Ó┤┐Ó┤▓ÓĄüÓ┤│ÓĄŹÓ┤│ Ó┤¼Ó┤©ÓĄŹÓ┤¦Ó┤żÓĄŹÓ┤żÓ┤┐Ó┤©ÓĄŹÓ┤▒ÓĄå Ó┤©ÓĄĆÓ┤│Ó┤é, Ó┤¼Ó┤©ÓĄŹÓ┤¦Ó┤żÓĄŹÓ┤żÓ┤┐Ó┤©ÓĄŹÓ┤▒ÓĄå Ó┤ĢÓĄŗÓ┤ŻÓ┤│Ó┤ĄÓĄŹ Ó┤żÓĄüÓ┤¤Ó┤ÖÓĄŹÓ┤ÖÓ┤┐ Ó┤ōÓ┤░ÓĄŗ Ó┤åÓ┤▒ÓĄŹÓ┤▒Ó┤żÓĄŹÓ┤żÓ┤┐Ó┤©ÓĄŹÓ┤▒ÓĄåÓ┤»ÓĄüÓ┤é Ó┤ĖÓĄŹÓ┤źÓ┤ŠÓ┤©Ó┤é Ó┤©Ó┤┐ÓĄ╝Ó┤ĄÓĄŹÓ┤ĄÓ┤ÜÓ┤┐Ó┤ĢÓĄŹÓ┤ĢÓ┤ŠÓĄ╗ Ó┤ēÓ┤żÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤© Ó┤ģÓ┤│Ó┤ĄÓĄüÓ┤ĢÓĄŠ Ó┤ēÓĄŠÓ┤¬ÓĄŹÓ┤¬ÓĄåÓ┤¤ÓĄŹÓ┤¤Ó┤┐Ó┤░Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤é.
Ó┤żÓ┤©ÓĄŹÓ┤«Ó┤ŠÓ┤żÓĄŹÓ┤░Ó┤Š Ó┤£ÓĄŹÓ┤»ÓĄŗÓ┤«ÓĄåÓ┤¤ÓĄŹÓ┤░Ó┤┐Ó┤»ÓĄüÓ┤¤ÓĄå Ó┤░ÓĄĆÓ┤żÓ┤┐ Ó┤ģÓ┤©ÓĄüÓ┤ĖÓ┤░Ó┤┐Ó┤ÜÓĄŹÓ┤ÜÓ┤ŠÓ┤ĄÓĄüÓ┤é Ó┤¬Ó┤”Ó┤ŠÓĄ╝Ó┤żÓĄŹÓ┤źÓ┤ÖÓĄŹÓ┤ÖÓ┤│ÓĄüÓ┤¤ÓĄå Ó┤¬ÓĄŹÓ┤░Ó┤żÓ┤┐Ó┤¬ÓĄŹÓ┤░Ó┤ĄÓĄ╝Ó┤żÓĄŹÓ┤żÓ┤©Ó┤░ÓĄĆÓ┤żÓ┤┐ , Ó┤¬ÓĄŖÓ┤│Ó┤ŠÓ┤░Ó┤┐Ó┤▒ÓĄŹÓ┤▒Ó┤┐ , Ó┤¬Ó┤”Ó┤ŠÓĄ╝Ó┤żÓĄŹÓ┤źÓ┤żÓĄŹÓ┤żÓ┤┐Ó┤©ÓĄŹÓ┤▒ÓĄå Ó┤ģÓ┤ĄÓ┤ĖÓĄŹÓ┤ź , Ó┤©Ó┤┐Ó┤▒Ó┤é , Ó┤ĢÓ┤ŠÓ┤©ÓĄŹÓ┤żÓ┤┐Ó┤ĢÓ┤ż , Ó┤£ÓĄĆÓ┤ĄÓ┤ČÓ┤ŠÓ┤ĖÓĄŹÓ┤żÓĄŹÓ┤░Ó┤¬Ó┤░Ó┤«Ó┤ŠÓ┤» Ó┤¬ÓĄŹÓ┤░Ó┤ĄÓĄ╝Ó┤żÓĄŹÓ┤żÓ┤©Ó┤é Ó┤ÄÓ┤©ÓĄŹÓ┤©Ó┤┐Ó┤ĄÓ┤»ÓĄåÓ┤▓ÓĄŹÓ┤▓Ó┤ŠÓ┤é Ó┤ēÓ┤ŻÓĄŹÓ┤¤Ó┤ŠÓ┤ĄÓĄüÓ┤©ÓĄŹÓ┤©Ó┤żÓĄŹ.[ 1] [ 2] [ 3] transferable properties .
Ó┤ģÓ┤¤ÓĄüÓ┤żÓĄŹÓ┤żÓĄüÓ┤│ÓĄŹÓ┤│ Ó┤░Ó┤ŻÓĄŹÓ┤¤ÓĄŹ Ó┤¼ÓĄŗÓ┤ŻÓĄŹÓ┤¤ÓĄüÓ┤ĢÓĄŠ Ó┤żÓ┤«ÓĄŹÓ┤«Ó┤┐Ó┤▓ÓĄüÓ┤│ÓĄŹÓ┤│ Ó┤£ÓĄŹÓ┤»Ó┤ŠÓ┤«Ó┤┐Ó┤żÓĄĆÓ┤» Ó┤ĢÓĄŗÓ┤ŻÓ┤┐Ó┤▓Ó┤ŠÓ┤ŻÓĄŹ Ó┤ÆÓ┤░ÓĄü Ó┤¼ÓĄŗÓ┤ŻÓĄŹÓ┤¤ÓĄŹ Ó┤åÓ┤éÓ┤ŚÓ┤┐ÓĄŠ. Ó┤▓Ó┤│Ó┤┐Ó┤żÓ┤«Ó┤ŠÓ┤» Ó┤żÓ┤©ÓĄŹÓ┤«Ó┤ŠÓ┤żÓĄŹÓ┤░Ó┤ĢÓ┤│ÓĄüÓ┤¤ÓĄå Ó┤ÜÓ┤┐Ó┤▓ Ó┤ĖÓ┤ŠÓ┤¦Ó┤ŠÓ┤░Ó┤Ż Ó┤░ÓĄéÓ┤¬Ó┤ÖÓĄŹÓ┤ÖÓĄŠ Ó┤ćÓ┤ĄÓ┤»Ó┤ŠÓ┤ŻÓĄŹ:
Linear :Ó┤©ÓĄłÓ┤¤ÓĄŹÓ┤░Ó┤┐Ó┤ĢÓĄŹ Ó┤ōÓ┤ĢÓĄŹÓ┤ĖÓĄłÓ┤ĪÓ┤┐Ó┤©ÓĄüÓ┤é Ó┤░ÓĄćÓ┤¢ÓĄĆÓ┤» Ó┤żÓ┤©ÓĄŹÓ┤«Ó┤ŠÓ┤żÓĄŹÓ┤░Ó┤Š Ó┤░ÓĄéÓ┤¬Ó┤«ÓĄüÓ┤ŻÓĄŹÓ┤¤ÓĄŹ.Trigonal planar :plane (flat) . Consequently, the bond angles are set at 120┬░. For example, boron trifluoride .Bent :2 O), which has an angle of about 105┬░. A water molecule has two pairs of bonded electrons and two unshared lone pairs.Tetrahedral :Tetra- signifies four, and -hedral relates to a face of a solid, so "tetrahedral " literally means "having four faces". This shape is found when there are four bonds all on one central atom , with no extra unshared electron pairs. In accordance with the VSEPR (valence-shell electron pair repulsion theory), the bond angles between the electron bonds are arccos (ŌłÆ1/3) = 109.47┬░. For example, methane (CH4 ) is a tetrahedral molecule.Octahedral :Octa- signifies eight, and -hedral relates to a face of a solid, so "octahedral " means "having eight faces". The bond angle is 90 degrees. For example, sulfur hexafluoride (SF6 ) is an octahedral molecule.Trigonal pyramidal :pyramid-like shape with a triangular base. Unlike the linear and trigonal planar shapes but similar to the tetrahedral orientation, pyramidal shapes require three dimensions in order to fully separate the electrons. Here, there are only three pairs of bonded electrons, leaving one unshared lone pair. Lone pair ŌĆō bond pair repulsions change the bond angle from the tetrahedral angle to a slightly lower value.[ 4] ammonia (NH3 ).
Ó┤ÜÓĄüÓ┤ĄÓ┤¤ÓĄåÓ┤»ÓĄüÓ┤│ÓĄŹÓ┤│ Ó┤¬Ó┤¤ÓĄŹÓ┤¤Ó┤┐Ó┤ĢÓ┤»Ó┤┐Ó┤▓ÓĄå Ó┤¼ÓĄŗÓ┤ŻÓĄŹÓ┤¤ÓĄŹ Ó┤ĢÓĄŗÓ┤ŻÓĄüÓ┤ĢÓĄŠ Ó┤▓Ó┤│Ó┤┐Ó┤ż Ó┤ĄÓ┤┐.Ó┤ÄÓ┤ĖÓĄŹ.Ó┤ć.Ó┤¬Ó┤┐.Ó┤åÓĄ╝ Ó┤ĖÓ┤┐Ó┤”ÓĄŹÓ┤¦Ó┤ŠÓ┤©ÓĄŹÓ┤żÓ┤é Ó┤ēÓ┤│ÓĄŹÓ┤│ Ó┤«Ó┤┐Ó┤ĢÓ┤ÜÓĄŹÓ┤Ü Ó┤ĢÓĄŗÓ┤ŻÓĄüÓ┤ĢÓĄŠ, Ó┤żÓĄüÓ┤¤ÓĄ╝Ó┤©ÓĄŹÓ┤©ÓĄŹ Ó┤ćÓ┤żÓĄŹ Ó┤ćÓ┤©Ó┤┐Ó┤¬ÓĄŹÓ┤¬Ó┤▒Ó┤»ÓĄüÓ┤©ÓĄŹÓ┤© Ó┤©Ó┤┐Ó┤░Ó┤»ÓĄŹÓ┤ĢÓĄŹÓ┤ĢÓ┤ŠÓ┤»Ó┤┐ Ó┤©ÓĄĮÓ┤ĢÓ┤┐Ó┤» Ó┤ēÓ┤”Ó┤ŠÓ┤╣Ó┤░Ó┤ŻÓ┤żÓĄŹÓ┤żÓ┤┐Ó┤©ÓĄŹ Ó┤ćÓ┤żÓĄŹ Ó┤ĄÓĄŹÓ┤»Ó┤żÓĄŹÓ┤»Ó┤ŠÓ┤ĖÓ┤¬ÓĄŹÓ┤¬ÓĄåÓ┤¤ÓĄŹÓ┤¤Ó┤┐Ó┤░Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤©ÓĄü. Ó┤¤ÓĄŹÓ┤░Ó┤┐Ó┤ŚÓ┤ŻÓĄĮ Ó┤¬Ó┤┐Ó┤░Ó┤«Ó┤┐Ó┤ĪÓĄĮ, Ó┤ĄÓ┤│Ó┤ĄÓĄŹ Ó┤żÓĄüÓ┤¤Ó┤ÖÓĄŹÓ┤ÖÓ┤┐Ó┤» Ó┤ĢÓĄćÓ┤ĖÓĄüÓ┤ĢÓĄŠÓ┤ĢÓĄŹÓ┤ĢÓĄŹ, Ó┤ēÓ┤”Ó┤ŠÓ┤╣Ó┤░Ó┤ŻÓ┤żÓĄŹÓ┤żÓ┤┐Ó┤©ÓĄüÓ┤│ÓĄŹÓ┤│ Ó┤»Ó┤źÓ┤ŠÓĄ╝Ó┤żÓĄŹÓ┤ź Ó┤åÓ┤éÓ┤ŚÓ┤┐ÓĄŠ Ó┤ģÓ┤©ÓĄüÓ┤»ÓĄŗÓ┤£ÓĄŹÓ┤»Ó┤«Ó┤ŠÓ┤» Ó┤åÓ┤éÓ┤ŚÓ┤┐Ó┤│Ó┤┐ÓĄĮ Ó┤©Ó┤┐Ó┤©ÓĄŹÓ┤©ÓĄŹ Ó┤ĄÓĄŹÓ┤»Ó┤żÓĄŹÓ┤»Ó┤ĖÓĄŹÓ┤żÓ┤«Ó┤ŠÓ┤ŻÓĄŹ, Ó┤ēÓ┤”Ó┤ŠÓ┤╣Ó┤░Ó┤ŻÓ┤ÖÓĄŹÓ┤ÖÓĄŠ Ó┤ĄÓĄŹÓ┤»Ó┤żÓĄŹÓ┤»Ó┤ĖÓĄŹÓ┤ż Ó┤ģÓ┤│Ó┤ĄÓ┤┐ÓĄĮ Ó┤ĄÓĄŹÓ┤»Ó┤żÓĄŹÓ┤»Ó┤ŠÓ┤ĖÓ┤¬ÓĄŹÓ┤¬ÓĄåÓ┤¤ÓĄŹÓ┤¤Ó┤┐Ó┤░Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤©ÓĄü. Ó┤ēÓ┤”Ó┤ŠÓ┤╣Ó┤░Ó┤ŻÓ┤żÓĄŹÓ┤żÓ┤┐Ó┤©ÓĄŹ, H2 S (92┬░) Ó┤åÓ┤éÓ┤ŚÓ┤┐ÓĄŠ Ó┤¤ÓĄåÓ┤¤ÓĄŹÓ┤░Ó┤╣ÓĄåÓ┤ĪÓĄŹÓ┤░ÓĄĮ Ó┤åÓ┤éÓ┤ŚÓ┤┐Ó┤│Ó┤┐ÓĄĮ Ó┤©Ó┤┐Ó┤©ÓĄŹÓ┤©ÓĄŹ H2 O (104.48┬░) Ó┤åÓ┤éÓ┤ŚÓ┤┐Ó┤│ÓĄćÓ┤ĢÓĄŹÓ┤ĢÓ┤ŠÓĄŠ Ó┤ĄÓ┤│Ó┤░ÓĄå Ó┤ĄÓĄŹÓ┤»Ó┤żÓĄŹÓ┤»Ó┤ĖÓĄŹÓ┤żÓ┤«Ó┤ŠÓ┤ŻÓĄŹ.
Atoms bonded to
Lone pair
Electron domains
Shape
Ideal bond angle
Ó┤ēÓ┤”Ó┤ŠÓ┤╣Ó┤░Ó┤ŻÓ┤é
Image
2
0
2
linear
180┬░
CO2
3
0
3
trigonal planar
120┬░
BF3
2
1
3
bent
120┬░ (119┬░)
SO2
4
0
4
tetrahedral
109.5┬░
CH4
3
1
4
trigonal pyramidal
109.5 (107.8┬░)
NH3
2
2
4
bent
109.5┬░ (104.48┬░)[ 5] [ 6]
H2 O
5
0
5
trigonal bipyramidal
90┬░, 120┬░, 180┬░
PCl5
4
1
5
seesaw
axŌĆōax 180┬░ (173.1┬░),
SF4
3
2
5
T-shaped
90┬░ (87.5┬░), 180┬░ (175┬░)
ClF3
2
3
5
linear
180┬░
XeF2
6
0
6
octahedral
90┬░, 180┬░
SF6
5
1
6
square pyramidal
90┬░ (84.8┬░)
BrF5
4
2
6
square planar
90┬░, 180┬░
XeF4
7
0
7
pentagonal bipyramidal
90┬░, 72┬░, 180┬░
IF7
6
1
7
pentagonal pyramidal
72┬░, 90┬░, 144┬░
XeOF5 ŌłÆ
5
2
7
planar pentagonal
72┬░, 144┬░
XeF5 ŌłÆ
8
0
8
square antiprismatic
XeF8 2ŌłÆ
9
0
9
tricapped trigonal prismatic
ReH9 2ŌłÆ
Ó┤▓ÓĄłÓĄ╗ Ó┤ģÓ┤▓ÓĄŹÓ┤▓ÓĄåÓ┤ÖÓĄŹÓ┤ĢÓ┤┐ÓĄĮ Ó┤ĖÓĄŹÓ┤▒ÓĄŹÓ┤▒Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄŹ ŌĆō Ó┤åÓ┤▒ÓĄŹÓ┤▒ÓĄŗÓ┤«Ó┤┐Ó┤ĢÓĄŹ Ó┤©ÓĄŹÓ┤»ÓĄéÓ┤ĢÓĄŹÓ┤▓Ó┤┐Ó┤»ÓĄå Ó┤¬ÓĄŹÓ┤░Ó┤żÓ┤┐Ó┤©Ó┤┐Ó┤¦ÓĄĆÓ┤ĢÓ┤░Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤©Ó┤┐Ó┤▓ÓĄŹÓ┤▓, Ó┤¼ÓĄŗÓ┤ŻÓĄŹÓ┤¤ÓĄüÓ┤ĢÓĄŠ Ó┤ĖÓĄŹÓ┤▒ÓĄŹÓ┤▒Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤ĢÓ┤│ÓĄŗ Ó┤▓ÓĄłÓ┤©ÓĄüÓ┤ĢÓ┤│ÓĄŗ Ó┤åÓ┤»Ó┤┐. Ó┤ćÓ┤żÓĄŹÓ┤żÓ┤░Ó┤żÓĄŹÓ┤żÓ┤┐Ó┤▓ÓĄüÓ┤│ÓĄŹÓ┤│ Ó┤░Ó┤ŻÓĄŹÓ┤¤Ó┤ŠÓ┤«Ó┤żÓĄŹÓ┤żÓĄå Ó┤żÓ┤©ÓĄŹÓ┤«Ó┤ŠÓ┤żÓĄŹÓ┤░Ó┤Š Ó┤śÓ┤¤Ó┤©Ó┤»Ó┤┐ÓĄĮ, Ó┤åÓ┤▒ÓĄŹÓ┤▒Ó┤ÖÓĄŹÓ┤ÖÓĄŠ Ó┤ōÓ┤░ÓĄŗ Ó┤ČÓĄĆÓĄ╝Ó┤ĘÓ┤ĢÓ┤żÓĄŹÓ┤żÓ┤┐Ó┤▓ÓĄüÓ┤é Ó┤ĖÓĄéÓ┤ÜÓ┤┐Ó┤¬ÓĄŹÓ┤¬Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤©ÓĄü.Ó┤ćÓ┤▓Ó┤ĢÓĄŹÓ┤¤ÓĄŹÓ┤░ÓĄŗÓĄ║ Ó┤ĪÓĄåÓĄ╗Ó┤ĖÓ┤┐Ó┤▒ÓĄŹÓ┤▒Ó┤┐ Ó┤¬ÓĄŹÓ┤▓ÓĄŗÓ┤¤ÓĄŹÓ┤¤ÓĄŹ ŌĆō shows the electron density determined either crystallographically or using quantum mechanics rather than distinct atoms or bonds.Ó┤ĖÓĄŹÓ┤▒ÓĄŹÓ┤▒Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤é Ó┤¬Ó┤©ÓĄŹÓ┤żÓĄüÓ┤é ŌĆō Ó┤åÓ┤▒ÓĄŹÓ┤▒ÓĄŗÓ┤«Ó┤┐Ó┤ĢÓĄŹ Ó┤©ÓĄŹÓ┤»ÓĄéÓ┤ĢÓĄŹÓ┤▓Ó┤┐Ó┤ĢÓ┤│ÓĄå Ó┤ŚÓĄŗÓ┤│Ó┤ÖÓĄŹÓ┤ÖÓĄŠ (Ó┤¬Ó┤©ÓĄŹÓ┤żÓĄüÓ┤ĢÓĄŠ) Ó┤¼ÓĄŗÓ┤ŻÓĄŹÓ┤¤ÓĄüÓ┤ĢÓ┤│ÓĄüÓ┤é Ó┤ĄÓ┤┐Ó┤▒Ó┤ĢÓĄüÓ┤ĢÓ┤│Ó┤ŠÓ┤»Ó┤┐ Ó┤¬ÓĄŹÓ┤░Ó┤żÓ┤┐Ó┤©Ó┤┐Ó┤¦ÓĄĆÓ┤ĢÓ┤░Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤©ÓĄü.Spacefilling models or CPK models (also an atomic coloring scheme in representations) ŌĆō Ó┤åÓ┤▒ÓĄŹÓ┤▒Ó┤ÖÓĄŹÓ┤ÖÓ┤│ÓĄå Ó┤¬ÓĄŹÓ┤░Ó┤żÓ┤┐Ó┤©Ó┤┐Ó┤¦ÓĄĆÓ┤ĢÓ┤░Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤© Ó┤«ÓĄćÓ┤¢Ó┤▓Ó┤ĢÓ┤│ÓĄå Ó┤ōÓ┤ĄÓĄ╝Ó┤▓Ó┤ŠÓ┤¬ÓĄŹÓ┤¬ÓĄüÓ┤ÜÓĄåÓ┤»ÓĄŹÓ┤»ÓĄüÓ┤©ÓĄŹÓ┤©Ó┤żÓ┤┐Ó┤▓ÓĄéÓ┤¤ÓĄå Ó┤żÓ┤©ÓĄŹÓ┤«Ó┤ŠÓ┤żÓĄŹÓ┤░Ó┤»ÓĄå Ó┤¬ÓĄŹÓ┤░Ó┤żÓ┤┐Ó┤©Ó┤┐Ó┤¦ÓĄĆÓ┤ĢÓ┤░Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤©ÓĄü.Ó┤╣Ó┤ŠÓ┤ĖÓ┤ÜÓ┤┐Ó┤żÓ┤é ŌĆō Ó┤▓ÓĄéÓ┤¬ÓĄŹÓ┤¬ÓĄüÓ┤ĢÓĄŠ, Ó┤¼ÓĄĆÓ┤▒ÓĄŹÓ┤▒ Ó┤ĘÓĄĆÓ┤▒ÓĄŹÓ┤▒ÓĄüÓ┤ĢÓĄŠ, Ó┤åÓĄĮÓ┤½ Ó┤╣ÓĄåÓ┤▓ÓĄłÓ┤ĖÓ┤ĖÓĄŹ Ó┤ĪÓ┤»Ó┤ŚÓĄŹÓ┤░Ó┤«Ó┤żÓĄŹÓ┤ĄÓ┤żÓĄŹÓ┤żÓ┤┐ÓĄĮ Ó┤¬ÓĄŹÓ┤░Ó┤żÓ┤┐Ó┤©Ó┤┐Ó┤¦ÓĄĆÓ┤ĢÓ┤░Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤© Ó┤ÆÓ┤░ÓĄü Ó┤¬ÓĄŹÓ┤░Ó┤ŠÓ┤żÓ┤┐Ó┤©Ó┤┐Ó┤¦ÓĄŹÓ┤»Ó┤é, Ó┤åÓ┤▒ÓĄŹÓ┤▒Ó┤ÖÓĄŹÓ┤ÖÓ┤│ÓĄŗ Ó┤¼ÓĄŗÓ┤ŻÓĄŹÓ┤¤ÓĄüÓ┤ĢÓ┤│ÓĄŗ Ó┤ĄÓĄŹÓ┤»Ó┤ĢÓĄŹÓ┤żÓ┤«Ó┤ŠÓ┤»Ó┤┐ Ó┤ĖÓĄüÓ┤ŚÓ┤«Ó┤«Ó┤ŠÓ┤» Ó┤¬ÓĄłÓ┤¬ÓĄŹÓ┤¬Ó┤▓Ó┤ŠÓ┤»Ó┤┐ Ó┤¬ÓĄŹÓ┤░Ó┤żÓ┤┐Ó┤©Ó┤┐Ó┤¦ÓĄĆÓ┤ĢÓ┤░Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤©Ó┤┐Ó┤▓ÓĄŹÓ┤▓.Ó┤å Ó┤żÓ┤©ÓĄŹÓ┤«Ó┤ŠÓ┤żÓĄŹÓ┤░Ó┤»ÓĄüÓ┤¤ÓĄå Ó┤åÓ┤▒ÓĄŹÓ┤▒Ó┤ÖÓĄŹÓ┤ÖÓĄŠ Ó┤żÓ┤«ÓĄŹÓ┤«Ó┤┐Ó┤▓ÓĄüÓ┤│ÓĄŹÓ┤│ Ó┤ĢÓĄŗÓ┤ŻÓĄüÓ┤ĢÓĄŠ Ó┤ÜÓĄåÓ┤▒Ó┤┐Ó┤» Ó┤żÓ┤©ÓĄŹÓ┤«Ó┤ŠÓ┤żÓĄŹÓ┤░Ó┤»Ó┤┐ÓĄĮ Ó┤ģÓ┤¤Ó┤ÖÓĄŹÓ┤ÖÓ┤┐Ó┤»Ó┤┐Ó┤░Ó┤┐Ó┤ĢÓĄŹÓ┤ĢÓĄüÓ┤©ÓĄŹÓ┤© Ó┤ÅÓ┤Ģ Ó┤£ÓĄŗÓ┤ĪÓ┤┐Ó┤ĢÓ┤│ÓĄüÓ┤¤ÓĄå Ó┤ģÓ┤│Ó┤ĄÓĄŹ Ó┤ĢÓĄéÓ┤¤ÓĄüÓ┤żÓ┤▓Ó┤ŠÓ┤ŻÓĄŹ. Ó┤ĄÓ┤┐.Ó┤ÄÓ┤ĖÓĄŹ.Ó┤ć.Ó┤¬Ó┤┐.Ó┤åÓĄ╝ Ó┤ĖÓ┤┐Ó┤”ÓĄŹÓ┤¦Ó┤ŠÓ┤©ÓĄŹÓ┤żÓ┤é Ó┤ÄÓ┤▓ÓĄŹÓ┤▓Ó┤Š Ó┤£ÓĄŗÓ┤ĪÓ┤┐Ó┤ĢÓ┤│ÓĄüÓ┤é Ó┤¬Ó┤░Ó┤ĖÓĄŹÓ┤¬Ó┤░Ó┤é Ó┤ģÓ┤ĢÓ┤▒ÓĄŹÓ┤▒ÓĄüÓ┤Ģ, Ó┤ģÓ┤ÖÓĄŹÓ┤ÖÓ┤©ÓĄå Ó┤ĄÓĄŹÓ┤»Ó┤żÓĄŹÓ┤»Ó┤ĖÓĄŹÓ┤ż Ó┤åÓ┤▒ÓĄŹÓ┤▒Ó┤ÖÓĄŹÓ┤ÖÓ┤│ÓĄå Ó┤ģÓ┤ĄÓ┤»Ó┤┐ÓĄĮ Ó┤©Ó┤┐Ó┤©ÓĄŹÓ┤©ÓĄŹ Ó┤ģÓ┤ĢÓ┤▒ÓĄŹÓ┤▒ÓĄüÓ┤©ÓĄŹÓ┤©ÓĄü.
Ōåæ McMurry, John E. (1992), Organic Chemistry (3rd ed.), Belmont: Wadsworth, ISBN 0-534-16218-5 Ōåæ Cotton, F. Albert ; Wilkinson, Geoffrey ; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5 Ōåæ Alexandros Chremos; Jack F. Douglas (2015). "When does a branched polymer become a particle?". J. Chem. Phys . 143 : 111104. Bibcode :2015JChPh.143k1104C . doi :10.1063/1.4931483 . Ōåæ Miessler G.L. and Tarr D.A. Inorganic Chemistry (2nd ed., Prentice-Hall 1999), pp.57-58
Ōåæ Hoy, AR; Bunker, PR (1979). "A precise solution of the rotation bending Schr├Čdinger equation for a triatomic molecule with application to the water molecule". Journal of Molecular Spectroscopy . 74 : 1ŌĆō 8. Bibcode :1979JMoSp..74....1H . doi :10.1016/0022-2852(79)90019-5 . Ōåæ "Archived copy" . Archived from the original on 2014-09-03. Retrieved 2014-08-27 .{{cite web }}: CS1 maint: archived copy as title (link )