Неорганические тиосульфаты Тиосульфа́ты — соли и сложные эфиры тиосерной кислоты, H2S2O3. Тиосульфаты неустойчивы, поэтому в природе не встречаются. Наиболее широкое применение имеют тиосульфат натрия и тиосульфат аммония. История открытия и исследованияОрганические тиосульфаты были исследованы немецким химиком Гансом Бунте в 1872 году[1] в его докторской диссертации. Строение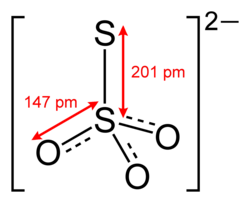 Тиосульфат-ион по строению близок к сульфат-иону. В тетраэдре [SO3S]2− связь S−S (1,97 Å) длиннее, чем связи S−O (1,48 Å). Физические свойстваРастворимость в воде (г/100 г):
Образуют кристаллогидраты, при нагревании которых происходит плавление, представляющее собой растворение тиосульфатов в кристаллизационной воде.
ПолучениеТиосульфаты получаются при взаимодействии растворов сульфитов с сероводородом: При кипячении растворов сульфитов с серой: При окислении полисульфидов кислородом воздуха: Химические свойстваТиосерная кислота H2S2O3 в присутствии воды разлагается: поэтому её выделение из водного раствора невозможно. Свободная тиосерная кислота может быть получена при взаимодействии хлорсульфоновой кислоты с сероводородом при низкой температуре: Выше 0 °C свободная тиосерная кислота необратимо разлагается по вышеприведённой реакции. Благодаря наличию серы в степени окисления −2 тиосульфат-ион обладает восстановительными свойствами. Слабыми окислителями (I2, Fe3+) тиосульфаты окисляются до тетратионатов: Более сильные окислители окисляют тиосульфаты до сульфатов: Сильные восстановители восстанавливают тиосульфат-ион до сульфида, например: Тиосульфат-ион также является сильным комплексообразователем: Так как тиосульфат-ион координируется с металлами через атом серы в степени окисления −2, в кислой среде тиосульфатные комплексы легко переходят в сульфиды: Из-за наличия атомов серы в разных степенях окисления в кислой среде тиосульфаты склонны к реакциям диспропорционирования: ПрименениеТиосульфаты используются в:
ФотографияИспользование тиосульфата натрия в фотографии в качестве фиксажа основано на способности тиосульфат-иона переводить нерастворимые в воде светочувствительные галогениды серебра в растворимые несветочувствительные комплексы: Фиксажи условно делятся на нейтральные, кислые, дубящие и быстрые. Нейтральный фиксаж представляет собой раствор тиосульфата натрия в воде (250 г/л). Для более быстрого прекращения действия проявляющих веществ, занесённых из проявителя в эмульсионном слое во избежание появления вуали на изображении фиксирование обычно проводят в слабокислой среде. В качестве подкислителей используют серную и уксусную кислоты, а также гидросульфит или метабисульфит (K2S2O5) калия. Для упрочнения эмульсионного слоя используют дубящие фиксажи. В качестве дубящих веществ в разных рецептурах могут использоваться тетраборат натрия (бура), борная кислота (одновременно как подкислитель), хромокалиевые или алюмокалиевые квасцы и формалин. Скорость реакции комплексообразования уменьшается от AgCl к AgI, поэтому при использовании бромсеребряных и иодсеребряных фотоматериалов используются быстрые фиксажи на основе тиосульфата аммония. Ускорение процесса фиксирования происходит за счёт промежуточной стадии — быстро протекающего образования аммиачного комплекса серебра: Из-за гигроскопичности тиосульфата аммония обычно применяют смесь тиосульфата натрия и хлорида аммония. ХимияВ аналитической химии тиосульфат натрия используется в качестве реагента в иодометрии. Его использование основано на реакции окисления тиосульфат-иона иодом до тетратионата: Растворы тиосульфата натрия нестабильны из-за взаимодействия с углекислым газом, содержащемся в воздухе и растворённом в воде: и вследствие окисления кислородом воздуха: и в результате контаминации растворов тионовыми бактериями, которые окисляют тиосульфаты до сульфатов, осуществляя хемосинтез. Поэтому приготовление раствора тиосульфата натрия из навески нецелесообразно. Обычно готовят раствор приблизительной концентрации и устанавливают точную концентрацию титрованием раствором бихромата калия или иода. При иодометрическом титровании применяют метод обратного титрования, то есть прибавляют избыток раствора иодида калия точной концентрации, а затем титруют образовавшийся иод раствором тиосульфата натрия.. Горнорудная промышленностьВ горнорудной промышленности тиосульфат натрия используется для извлечения серебра и золота из руд и минералов как альтернатива цианидному выщелачиванию Процесс тиосульфатного выщелачивания основан на окислении золота и серебра кислородом воздуха в присутствии тиосульфата натрия (тиосульфатное выщелачивание): в кислой среде или двухвалентной медью: в щелочной среде (тиосульфатно-аммиачное выщелачивание). Аналогичные процессы происходят и при выщелачивании серебра. Преимуществами тиосульфатно-аммиачного выщелачивания перед цианидным является отсутствие необходимости в использовании высокотоксичных реагентов, а также более полное извлечение металлов из руд, содержащих большие количества меди и марганца. При тиосульфатно-аммиачном выщелачивании в рабочий раствор добавляют серу и сульфит аммония, что позволяет обеспечить извлечение золота до 50—95 % Текстильная промышленностьПосле отбеливания тканей хлором их обрабатывают тиосульфатом натрия для удаления следов хлора и придания прочности: Пищевая промышленностьВ пищевой промышленности тиосульфат натрия применяется как пищевая добавка Е539 (регулятор кислотности). ХимчисткаПри химчистке текстильных и кожных изделий тиосульфат натрия используется для удаления пятен, вызванных галогенами и их соединениями: йод, соединения хлора, бром. МедицинаВ медицине тиосульфат натрия используется:
тиосульфат магния — лекарственное средство при некоторых сердечно-сосудистых заболеваниях, вегетативных расстройствах. Примеры
См. такжеПримечания
Литература
|
Portal di Ensiklopedia Dunia









![{\displaystyle {\ce {3 S2O3^2- + 8 Al + 14 OH^- + 9 H2O -> 6 S^2- + 8[Al(OH)4]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/38e74ac33b311e4951ea3b3958e4f0706b3db02b)
![{\displaystyle {\ce {Ag^+ + 2 S2O3^2- -> [Ag(S2O3)2]^3-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2d74f1119d7faca5900d47a80281e21a1d8a2f14)
![{\displaystyle {\ce {2 [Ag(S2O3)2]^{3-}{}+ 6 H^+ -> Ag2S v + 3 S + 3 SO2 + H2SO4 + 2 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c3b9da8452382e47e36484e5841e3b5cbde668ca)

![{\displaystyle {\ce {AgHal + 2 S2O3^2- -> [Ag(S2O3)2]^{3-}{}+ Hal^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cec05df99d7938a1332c3f9c915e99dc4579aae)
![{\displaystyle {\ce {AgHal + 2 NH4^+ + 2 OH^- -> [Ag(NH3)2]^+ + 2 H2O + Hal^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/74cc52efc1db6d47fa71d433fa6ebab3d2874bd5)



![{\displaystyle {\ce {4 Au + O2 + 8 S2O3^{2-}{}+ 4 H^+ -> 4 [Au(S2O3)2]^{3-}{}+ 2 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bab892fbc9c533425d30e23d728db68d350df667)
![{\displaystyle {\ce {Au + 5 S2O3^{2-}{}+ [Cu(NH3)4]^{2+}-> [Au(S2O3)2]^{3-}{}+ 4 NH3 + [Cu(S2O3)3]^{5-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/337f73a057d2bbffe4f8b05772eca685644cbff5)














