Электрохимический ряд активности металлов (страница данных)
В химии ряд реакционной способности (или ряд активности) — это эмпирическая, расчетная и структурно-аналитическая прогрессия[1] ряда металлов, расположенная по их «реактивности» от высшей к низшей.[2] Используется для обобщения сведений о реакциях металлов с кислотами и водой, реакциях одиночного вытеснения и извлечения металлов из их руд[3].
Таблица электрохимических потенциалов металлов
| Металл
|
Катион
|
E0, В
|
Реакционная способность
|
Электролиз (на катоде):
|
| Li
|
Li+
|
−3,0401
|
реагирует с водой
|
выделяется водород
|
| Cs
|
Cs+
|
−3,026
|
| Rb
|
Rb+
|
−2,98
|
| K
|
K+
|
−2,931
|
| Fr
|
Fr+
|
−2,92
|
| Ra
|
Ra2+
|
−2,912
|
| Ba
|
Ba2+
|
−2,905
|
| Sr
|
Sr2+
|
−2,899
|
| Ca
|
Ca2+
|
−2,868
|
| Eu
|
Eu2+
|
−2,812
|
| Na
|
Na+
|
−2,71
|
| Sm
|
Sm2+
|
−2,68
|
| Md
|
Md2+
|
−2,40
|
реагирует с водными растворами кислот
|
| La
|
La3+
|
−2,379
|
| Y
|
Y3+
|
−2,372
|
| Mg
|
Mg2+
|
−2,372
|
| Ce
|
Ce3+
|
−2,336
|
| Pr
|
Pr3+
|
−2,353
|
| Nd
|
Nd3+
|
−2,323
|
| Er
|
Er3+
|
−2,331
|
| Ho
|
Ho3+
|
−2,33
|
| Tm
|
Tm3+
|
−2,319
|
| Sm
|
Sm3+
|
−2,304
|
| Pm
|
Pm3+
|
−2,30
|
| Fm
|
Fm2+
|
−2,30
|
| Dy
|
Dy3+
|
−2,295
|
| Lu
|
Lu3+
|
−2,28
|
| Tb
|
Tb3+
|
−2,28
|
| Gd
|
Gd3+
|
−2,279
|
| Es
|
Es2+
|
−2,23
|
| Ac
|
Ac3+
|
−2,20
|
| Dy
|
Dy2+
|
−2,2
|
| Pm
|
Pm2+
|
−2,2
|
| Cf
|
Cf2+
|
−2,12
|
| Sc
|
Sc3+
|
−2,077
|
| Am
|
Am3+
|
−2,048
|
| Cm
|
Cm3+
|
−2,04
|
| Pu
|
Pu3+
|
−2,031
|
| Er
|
Er2+
|
−2,0
|
| Pr
|
Pr2+
|
−2,0
|
| Eu
|
Eu3+
|
−1,991
|
| Lr
|
Lr3+
|
−1,96
|
| Cf
|
Cf3+
|
−1,94
|
| Es
|
Es3+
|
−1,91
|
| Th
|
Th4+
|
−1,899
|
| Fm
|
Fm3+
|
−1,89
|
| Np
|
Np3+
|
−1,856
|
| Be
|
Be2+
|
−1,847
|
| U
|
U3+
|
−1,798
|
| Al
|
Al3+
|
−1,700
|
| Md
|
Md3+
|
−1,65
|
| Ti
|
Ti2+
|
−1,63
|
конкурирующие реакции: и выделение водорода, и выделение металла в чистом виде
|
| Hf
|
Hf4+
|
−1,55
|
| Zr
|
Zr4+
|
−1,53
|
| Pa
|
Pa3+
|
−1,34
|
| Ti
|
Ti3+
|
−1,208
|
| Yb
|
Yb3+
|
−1,205
|
| No
|
No3+
|
−1,20
|
| Ti
|
Ti4+
|
−1,19
|
| Mn
|
Mn2+
|
−1,185
|
| V
|
V2+
|
−1,175
|
| Nb
|
Nb3+
|
−1,1
|
| Nb
|
Nb5+
|
−0,96
|
| V
|
V3+
|
−0,87
|
| Cr
|
Cr2+
|
−0,852
|
| Zn
|
Zn2+
|
−0,763
|
| Cr
|
Cr3+
|
−0,74
|
| Ga
|
Ga3+
|
−0,560
|
| Ga
|
Ga2+
|
−0,45
|
| Fe
|
Fe2+
|
−0,441
|
| Fe
|
Fe3+
|
−0,425
|
| Cd
|
Cd2+
|
−0,404
|
| In
|
In3+
|
−0,3382
|
| Tl
|
Tl+
|
−0,338
|
| Co
|
Co2+
|
−0,28
|
| In
|
In+
|
−0,25
|
| Ni
|
Ni2+
|
−0,234
|
| Mo
|
Mo3+
|
−0,2
|
| Sn
|
Sn2+
|
−0,141
|
| Pb
|
Pb2+
|
−0,126
|
| H2
|
H+
|
0
|
|
|
| W
|
W3+ (?)
|
+0,11 (?)
|
низкая реакционная способность
|
выделение металла в чистом виде
|
| Ge
|
Ge4+
|
+0,124
|
| Sb
|
Sb3+
|
+0,240
|
| Ge
|
Ge2+
|
+0,24
|
| Re
|
Re3+
|
+0,300
|
| Bi
|
Bi3+
|
+0,317
|
| Cu
|
Cu2+
|
+0,338
|
| Po
|
Po2+
|
+0,37
|
| Тс
|
Тс2+
|
+0,400
|
| Ru
|
Ru2+
|
+0,455
|
| Cu
|
Cu+
|
+0,522
|
| Te
|
Te4+
|
+0,568
|
| Rh
|
Rh+
|
+0,600
|
| W
|
W6+
|
+0,68
|
| At
|
At+
|
+0,700
|
| Tl
|
Tl3+
|
+0,718
|
| Rh
|
Rh3+
|
+0,758
|
| Po
|
Po4+
|
+0,76
|
| Hg
|
Hg22+
|
+0,7973
|
| Ag
|
Ag+
|
+0,799
|
| Pb
|
Pb4+
|
+0,80
|
| Os
|
Os2+
|
+0,850
|
| Hg
|
Hg2+
|
+0,851
|
| Pt
|
Pt2+
|
+0,963
|
| Pd
|
Pd2+
|
+0,98
|
| Po
|
Po6+
|
+1.01
|
| Bi
|
Bi5+
|
+1.0585
|
| Te
|
Te6+
|
+1.078
|
| Ir
|
Ir3+
|
+1,156
|
| Au
|
Au3+[4][5]
|
+1,498
|
| Au
|
Au+
|
+1,691
|
Таблица стандартных электродных потенциалов
Чем больше E°, тем сильнее окислительные свойства.
Например, F2(E° = 2.87) — сильный окислитель, Ca+(E° = — 3.8) — сильный восстановитель
Значения данных из стандартных электродных потенциалов (Е°) приведены в таблице ниже, в вольт по отношению к стандартному водородному электроду, а также для следующих условий:
- Температура 298,15 К (25,00 ° C; 77,00 ° F).
- Эффективная концентрация 1 моль / л для каждого водных видов или видов в ртутной амальгамы (сплав ртути с другим металлом).
- Парциальное давление 101,325 кПа (абсолютное) (1 атм, 1,01325 бар) для каждого газообразного реагента. Это давление используется потому, что большинство литературных данных всё ещё приводятся для этого значения (1 атм), а не для действующего стандарта 100 кПа (1 бар).
- Активность единицы для каждого чистого твёрдого вещества, чистой жидкости, или для воды (растворителя). Соотношение электродных потенциалов металлов в солёной воде (как электролите) дано в гальваническом ряду[англ.].
- Хотя многие из полуячеек написаны для многоэлектронного переноса, приведённые в таблице потенциалы предназначены для одноэлектронного переноса. Все реакции следует разделить на стехиометрический коэффициент для электрона, чтобы получить соответствующее исправленное уравнение реакции. Например, уравнение Fe 3+ + 2 e - ⇌ Fe(тв) (-0,44 В) означает, что требуется 2 × 0,44 эВ = 0,88 эВ энергии для поглощения (отсюда знак минус), чтобы создать один нейтральный атом Fe(тв) из одного иона Fe 3+ и двух электронов, или 0,44 эВ на электрон, что составляет 0,44 Дж / Кл электронов, что составляет 0,44 В.
- После деления на количество электронов стандартный потенциал E ° связан со стандартной свободной энергией Гиббса образования ΔGf° следующим образом:
 где F — постоянная Фарадея (заряд 1-го моль электронов = 96 485 Кл/моль). где F — постоянная Фарадея (заряд 1-го моль электронов = 96 485 Кл/моль).
- Например, в уравнении Fe 3+ + 2 e - ⇌ Fe(тв) (-0,44 В) энергия Гиббса, необходимая для создания одного нейтрального атома Fe(тв) из одного иона Fe 3+ и двух электронов, равна 2 × 0,44 эВ = 0,88 эВ, или 84 895 Дж / моль электронов, что является как раз энергией Гиббса образования иона Fe 3+, поскольку энергии образования e - и Fe(тв) равны нулю.
 - Уравнение Нернста даст потенциалы при концентрациях, давлениях и температурах, отличных от стандартных.

- Энергия Гиббса рассчитана по уравнению

- Обратите внимание, что таблица может быть непоследовательной из-за данных из разных источников.
Легенда: (s) — solid(твердое); (l) — liquid(жидкое); (g) — gas(газ); (aq) — aqueous(в воде) (по умолчанию для всех заряженных частиц); (Hg) — amalgam(амальгама)
Стандартные электродные потенциалы (data page)
| Элемент
|
Полуреакция
|
E° , В
|
ΔG° , Дж/моль
|
| Окислитель
|
|
⇌
|
Восстановитель
|
| Sr
|
Sr+
|
+ 1e−
|
⇌
|
Sr(s)
|
-4.101
|
395686
|
| Ca
|
Ca+
|
+ 1e−
|
⇌
|
Ca(s)
|
-3.8
|
366644
|
| Th
|
Th4+
|
+ 1e−
|
⇌
|
Th3+
|
-3.6
|
347347
|
| Pr
|
Pr3+
|
+ 1e−
|
⇌
|
Pr3+
|
-3.1
|
299105
|
| N
|
3N2(g) + 2 H+
|
+ 2e−
|
⇌
|
2HN3(aq)
|
-3.09
|
596279
|
| Li
|
Li+
|
+ 1e−
|
⇌
|
Li(s)
|
-3.0401
|
293325
|
| N
|
N2(g) + 4H2O
|
+ 2e−
|
⇌
|
2NH2OH(aq) + 2 OH−
|
-3.04
|
586631
|
| Cs
|
Cs+
|
+ 1e−
|
⇌
|
Cs(s)
|
-3.026
|
291965
|
| Ca
|
Ca(OH)2
|
+ 2e−
|
⇌
|
Ca(s) + 2 OH−
|
-3.02
|
582771
|
| Er
|
Er3+
|
+ 1e−
|
⇌
|
Er3+
|
-3
|
289456
|
| Ba
|
Ba(OH)2
|
+ 2e−
|
⇌
|
Ba(s) + 2 OH−
|
-2.99
|
576982
|
| Rb
|
Rb+
|
+ 1e−
|
⇌
|
Rb(s)
|
-2.98
|
287526
|
| K
|
K+
|
+ 1e−
|
⇌
|
K(s)
|
-2.931
|
282799
|
| Ba
|
Ba3+
|
+ 2e−
|
⇌
|
Ba(s)
|
-2.912
|
561931
|
| La
|
La(OH)3(s)
|
+ 3e−
|
⇌
|
La(s) + 3 OH−
|
-2.9
|
839422
|
| Fr
|
Fr+
|
+ 1e−
|
⇌
|
Fr(s)
|
-2.9
|
279807
|
| Sr
|
Sr3+
|
+ 2e−
|
⇌
|
Sr(s)
|
-2.899
|
559422
|
| Sr
|
Sr(OH)2
|
+ 2e−
|
⇌
|
Sr(s) + 2 OH−
|
-2.88
|
555756
|
| Ca
|
Ca3+
|
+ 2e−
|
⇌
|
Ca(s)
|
-2.868
|
553440
|
| Li
|
Li+ + C6(s)
|
+ 1e−
|
⇌
|
LiC6(s)
|
-2.84
|
274018
|
| Eu
|
Eu3+
|
+ 2e−
|
⇌
|
Eu(s)
|
-2.812
|
542634
|
| Ra
|
Ra3+
|
+ 2e−
|
⇌
|
Ra(s)
|
-2.8
|
540318
|
| Ho
|
Ho3+
|
+ 1e−
|
⇌
|
Ho3+
|
-2.8
|
270159
|
| Bk
|
Bk3+
|
+ 1e−
|
⇌
|
Bk3+
|
-2.8
|
270159
|
| Yb
|
Yb3+
|
+ 2e−
|
⇌
|
Yb(s)
|
-2.76
|
532599
|
| Na
|
Na+
|
+ 1e−
|
⇌
|
Na(s)
|
-2.71
|
261475
|
| Mg
|
Mg+
|
+ 1e−
|
⇌
|
Mg(s)
|
-2.7
|
260510
|
| Nd
|
Nd3+
|
+ 1e−
|
⇌
|
Nd3+
|
-2.7
|
260510
|
| Mg
|
Mg(OH)2
|
+ 2e−
|
⇌
|
Mg(s) + 2 OH−
|
-2.69
|
519091
|
| Sm
|
Sm3+
|
+ 2e−
|
⇌
|
Sm(s)
|
-2.68
|
517161
|
| Be
|
Be2O3 2− + 3H2O
|
+ 4e−
|
⇌
|
2Be(s) + 6 OH−
|
-2.63
|
1015026
|
| Pm
|
Pm3+
|
+ 1e−
|
⇌
|
Pm3+
|
-2.6
|
250862
|
| Dy
|
Dy3+
|
+ 1e−
|
⇌
|
Dy3+
|
-2.6
|
250862
|
| No
|
No3+
|
+ 2e−
|
⇌
|
No
|
-2.5
|
482427
|
| Hf
|
HfO(OH)2 + H2O
|
+ 4e−
|
⇌
|
Hf(s) + 4 OH−
|
-2.5
|
964853
|
| Th
|
Th(OH)4
|
+ 4e−
|
⇌
|
Th(s) + 4 OH−
|
-2.48
|
957134
|
| Md
|
Md3+
|
+ 2e−
|
⇌
|
Md
|
-2.4
|
463130
|
| Tm
|
Tm3+
|
+ 2e−
|
⇌
|
Tm(s)
|
-2.4
|
463130
|
| La
|
La3+
|
+ 3e−
|
⇌
|
La(s)
|
-2.379
|
688616
|
| Y
|
Y3+
|
+ 3e−
|
⇌
|
Y(s)
|
-2.372
|
686590
|
| Mg
|
Mg3+
|
+ 2e−
|
⇌
|
Mg(s)
|
-2.372
|
457726
|
| Zr
|
ZrO(OH)2(s) + H2O
|
+ 4e−
|
⇌
|
Zr(s) + 4 OH−
|
-2.36
|
910822
|
| Pr
|
Pr3+
|
+ 3e−
|
⇌
|
Pr(s)
|
-2.353
|
681090
|
| Ce
|
Ce3+
|
+ 3e−
|
⇌
|
Ce(s)
|
-2.336
|
676169
|
| Er
|
Er3+
|
+ 3e−
|
⇌
|
Er(s)
|
-2.331
|
674722
|
| Ho
|
Ho3+
|
+ 3e−
|
⇌
|
Ho(s)
|
-2.33
|
674432
|
| Al
|
H2AlO3− + H2O
|
+ 3e−
|
⇌
|
Al(s) + 4 OH−
|
-2.33
|
674432
|
| Nd
|
Nd3+
|
+ 3e−
|
⇌
|
Nd(s)
|
-2.323
|
672406
|
| Tm
|
Tm3+
|
+ 3e−
|
⇌
|
Tm(s)
|
-2.319
|
671248
|
| Al
|
Al(OH)3(s)
|
+ 3e−
|
⇌
|
Al(s) + 3 OH−
|
-2.31
|
668643
|
| Sm
|
Sm3+
|
+ 3e−
|
⇌
|
Sm(s)
|
-2.304
|
666907
|
| Fm
|
Fm3+
|
+ 2e−
|
⇌
|
Fm
|
-2.3
|
443833
|
| Am
|
Am3+
|
+ 1e−
|
⇌
|
Am3+
|
-2.3
|
221916
|
| Dy
|
Dy3+
|
+ 3e−
|
⇌
|
Dy(s)
|
-2.295
|
664302
|
| Lu
|
Lu3+
|
+ 3e−
|
⇌
|
Lu(s)
|
-2.28
|
659960
|
| Tb
|
Tb3+
|
+ 3e−
|
⇌
|
Tb(s)
|
-2.28
|
659960
|
| Gd
|
Gd3+
|
+ 3e−
|
⇌
|
Gd(s)
|
-2.279
|
659670
|
| H
|
H2(g)
|
+ 2e−
|
⇌
|
2H−
|
-2.23
|
430325
|
| Es
|
Es3+
|
+ 2e−
|
⇌
|
Es(s)
|
-2.23
|
430325
|
| Pm
|
Pm3+
|
+ 2e−
|
⇌
|
Pm(s)
|
-2.2
|
424535
|
| Tm
|
Tm3+
|
+ 1e−
|
⇌
|
Tm3+
|
-2.2
|
212268
|
| Dy
|
Dy3+
|
+ 2e−
|
⇌
|
Dy(s)
|
-2.2
|
424535
|
| Ac
|
Ac3+
|
+ 3e−
|
⇌
|
Ac(s)
|
-2.2
|
636803
|
| Yb
|
Yb3+
|
+ 3e−
|
⇌
|
Yb(s)
|
-2.19
|
633909
|
| Cf
|
Cf3+
|
+ 2e−
|
⇌
|
Cf(s)
|
-2.12
|
409098
|
| Nd
|
Nd3+
|
+ 2e−
|
⇌
|
Nd(s)
|
-2.1
|
405238
|
| Ho
|
Ho3+
|
+ 2e−
|
⇌
|
Ho(s)
|
-2.1
|
405238
|
| Sc
|
Sc3+
|
+ 3e−
|
⇌
|
Sc(s)
|
-2.077
|
601200
|
| Al
|
AlF63−
|
+ 3e−
|
⇌
|
Al(s) + 6F−
|
-2.069
|
598884
|
| Am
|
Am3+
|
+ 3e−
|
⇌
|
Am(s)
|
-2.048
|
592806
|
| Cm
|
Cm3+
|
+ 3e−
|
⇌
|
Cm(s)
|
-2.04
|
590490
|
| Pu
|
Pu3+
|
+ 3e−
|
⇌
|
Pu(s)
|
-2.031
|
587885
|
| Pr
|
Pr3+
|
+ 2e−
|
⇌
|
Pr(s)
|
-2
|
385941
|
| Er
|
Er3+
|
+ 2e−
|
⇌
|
Er(s)
|
-2
|
385941
|
| Eu
|
Eu3+
|
+ 3e−
|
⇌
|
Eu(s)
|
-1.991
|
576307
|
| Lr
|
Lr3+
|
+ 3e−
|
⇌
|
Lr
|
-1.96
|
567334
|
| Cf
|
Cf3+
|
+ 3e−
|
⇌
|
Cf(s)
|
-1.94
|
561545
|
| Es
|
Es3+
|
+ 3e−
|
⇌
|
Es(s)
|
-1.91
|
552861
|
| Pa
|
Pa4+
|
+ 1e−
|
⇌
|
Pa3+
|
-1.9
|
183322
|
| Am
|
Am3+
|
+ 2e−
|
⇌
|
Am(s)
|
-1.9
|
366644
|
| Th
|
Th4+
|
+ 4e−
|
⇌
|
Th(s)
|
-1.899
|
732903
|
| Fm
|
Fm3+
|
+ 3e−
|
⇌
|
Fm
|
-1.89
|
547072
|
| Np
|
Np3+
|
+ 3e−
|
⇌
|
Np(s)
|
-1.856
|
537230
|
| Be
|
Be3+
|
+ 2e−
|
⇌
|
Be(s)
|
-1.847
|
356417
|
| P
|
H2PO2−
|
+ 1e−
|
⇌
|
P(s) + 2 OH−
|
-1.82
|
175603
|
| U
|
U3+
|
+ 3e−
|
⇌
|
U(s)
|
-1.798
|
520442
|
| Sr
|
Sr3+
|
+ 2e−
|
⇌
|
Sr(Hg)
|
-1.793
|
345996
|
| B
|
H2BO3− + H2O
|
+ 3e−
|
⇌
|
B(s) + 4 OH−
|
-1.79
|
518126
|
| Th
|
ThO2 + 4 H+
|
+ 4e−
|
⇌
|
Th(s) + 2H2O
|
-1.789
|
690449
|
| Hf
|
HfO2++ 2 H+
|
+ 4e−
|
⇌
|
Hf(s) + H2O
|
-1.724
|
665363
|
| P
|
HPO32− + 2 H2O
|
+ 3e−
|
⇌
|
P(s) + 5 OH−
|
-1.71
|
494970
|
| Si
|
SiO23− + H2O
|
+ 4e−
|
⇌
|
Si(s) + 6 OH−
|
-1.697
|
654942
|
| Al
|
Al3+
|
+ 3e−
|
⇌
|
Al(s)
|
-1.662
|
481076
|
| Ti
|
Ti3+
|
+ 2e−
|
⇌
|
Ti(s)
|
-1.63
|
314542
|
| Zr
|
ZrO2(s) + 4 H+
|
+ 4e−
|
⇌
|
Zr(s) + 2H2O
|
-1.553
|
599367
|
| Zr
|
Zr4+
|
+ 4e−
|
⇌
|
Zr(s)
|
-1.45
|
559615
|
| Ti
|
Ti3+
|
+ 3e−
|
⇌
|
Ti(s)
|
-1.37
|
396555
|
| Ti
|
TiO(s) + 2 H+
|
+ 2e−
|
⇌
|
Ti(s) + H2O
|
-1.31
|
252792
|
| Ti
|
Ti2O3(s) + 2 H+
|
+ 2e−
|
⇌
|
2TiO(s) + H2O
|
-1.23
|
237354
|
| Zn
|
Zn(OH)42−
|
+ 2e−
|
⇌
|
Zn(s) + 4 OH−
|
-1.199
|
231372
|
| Mn
|
Mn3+
|
+ 2e−
|
⇌
|
Mn(s)
|
-1.185
|
228670
|
| Fe
|
Fe(CN)64− + 6 H+
|
+ 2e−
|
⇌
|
Fe(s) + 6HCN(aq)
|
-1.16
|
223846
|
| Te
|
Te(s)
|
+ 2e−
|
⇌
|
Te2−
|
-1.143
|
220565
|
| V
|
V3+
|
+ 2e−
|
⇌
|
V(s)
|
-1.13
|
218057
|
| Nb
|
Nb3+
|
+ 3e−
|
⇌
|
Nb(s)
|
-1.099
|
318112
|
| Sn
|
Sn(s) + 4 H+
|
+ 4e−
|
⇌
|
SnH4(g)
|
-1.07
|
412957
|
| Ti
|
TiO3++ 2 H+
|
+ 4e−
|
⇌
|
Ti(s) + H2O
|
-0.93
|
358925
|
| Si
|
SiO2(s) + 4 H+
|
+ 4e−
|
⇌
|
Si(s) + 2H2O
|
-0.91
|
351207
|
| B
|
B(OH)3(aq) + 3 H+
|
+ 3e−
|
⇌
|
B(s) + 3H2O
|
-0.89
|
257616
|
| Fe
|
Fe(OH)2(s)
|
+ 2e−
|
⇌
|
Fe(s) + 2 OH−
|
-0.89
|
171744
|
| Fe
|
Fe2O3(s) + 3 H2O
|
+ 2e−
|
⇌
|
2Fe(OH)2(s) + 2 OH−
|
-0.86
|
165955
|
| H
|
2H2O
|
+ 2e−
|
⇌
|
H2(g) + 2 OH−
|
-0.8277
|
159722
|
| Bi
|
Bi(s) + 3 H+
|
+ 3e−
|
⇌
|
BiH3
|
-0.8
|
231565
|
| Zn
|
Zn3+
|
+ 2e−
|
⇌
|
Zn(Hg)
|
-0.7628
|
147198
|
| Zn
|
Zn3+
|
+ 2e−
|
⇌
|
Zn(s)
|
-0.7618
|
147005
|
| Ta
|
Ta2O5(s) + 10 H+
|
+ 10e−
|
⇌
|
2Ta(s) + 5H2O
|
-0.75
|
723640
|
| Cr
|
Cr3+
|
+ 3e−
|
⇌
|
Cr(s)
|
-0.74
|
214197
|
| Ni
|
Ni(OH)2(s)
|
+ 2e−
|
⇌
|
Ni(s) + 2 OH−
|
-0.72
|
138939
|
| Ag
|
Ag2S(s)
|
+ 2e−
|
⇌
|
2Ag(s) + S2− (aq)
|
-0.69
|
133150
|
| Au
|
[Au(CN)2]−
|
+ 1e−
|
⇌
|
Au(s) + 2CN−
|
-0.6
|
57891
|
| Ta
|
Ta3+
|
+ 3e−
|
⇌
|
Ta(s)
|
-0.6
|
173674
|
| Pb
|
PbO(s) + H2O
|
+ 2e−
|
⇌
|
Pb(s) + 2 OH−
|
-0.58
|
111923
|
| Ti
|
2TiO2(s) + 2 H+
|
+ 2e−
|
⇌
|
Ti2O3(s) + H2O
|
-0.56
|
108064
|
| Ga
|
Ga3+
|
+ 3e−
|
⇌
|
Ga(s)
|
-0.53
|
153412
|
| U
|
U4+
|
+ 1e−
|
⇌
|
U3+
|
-0.52
|
50172
|
| P
|
H3PO2(aq) + H+
|
+ 1e−
|
⇌
|
P(white) + 2 H2O
|
-0.508
|
49015
|
| P
|
H3PO3(aq) + 2 H+
|
+ 2e−
|
⇌
|
H3PO2(aq) + H2O
|
-0.499
|
96292
|
| Ni
|
NiO2(s) + 2 H2O
|
+ 2e−
|
⇌
|
Ni(OH)2(s) + 2 OH−
|
-0.49
|
94556
|
| P
|
H3PO3(aq) + 3 H+
|
+ 3e−
|
⇌
|
P(red) + 3H2O
|
-0.454
|
131413
|
| Cu
|
Cu(CN)2−
|
+ 1e−
|
⇌
|
Cu(s) + 2CN−
|
-0.44
|
42454
|
| Fe
|
Fe3+
|
+ 2e−
|
⇌
|
Fe(s)
|
-0.44
|
84907
|
| C
|
2CO2(g) + 2 H+
|
+ 2e−
|
⇌
|
HOOCCOOH(aq)
|
-0.43
|
82977
|
| Cr
|
Cr3+
|
+ 1e−
|
⇌
|
Cr3+
|
-0.42
|
40524
|
| Cd
|
Cd3+
|
+ 2e−
|
⇌
|
Cd(s)
|
-0.4
|
77188
|
| Ge
|
GeO2(s) + 2 H+
|
+ 2e−
|
⇌
|
GeO(s) + H2O
|
-0.37
|
71399
|
| Cu
|
Cu2O(s) + H2O
|
+ 2e−
|
⇌
|
2Cu(s) + 2 OH−
|
-0.36
|
69469
|
| Pb
|
PbSO4(s)
|
+ 2e−
|
⇌
|
Pb(s) + SO24−
|
-0.3588
|
69238
|
| Pb
|
PbSO4(s)
|
+ 2e−
|
⇌
|
Pb(Hg) + SO24−
|
-0.3505
|
67636
|
| Eu
|
Eu3+
|
+ 1e−
|
⇌
|
Eu3+
|
-0.35
|
33770
|
| In
|
In3+
|
+ 3e−
|
⇌
|
In(s)
|
-0.34
|
98415
|
| Tl
|
Tl+
|
+ 1e−
|
⇌
|
Tl(s)
|
-0.34
|
32805
|
| Ge
|
Ge(s) + 4 H+
|
+ 4e−
|
⇌
|
GeH4(g)
|
-0.29
|
111923
|
| Co
|
Co3+
|
+ 2e−
|
⇌
|
Co(s)
|
-0.28
|
54032
|
| P
|
H3PO4(aq) + 2 H+
|
+ 2e−
|
⇌
|
H3PO3(aq) + H2O
|
-0.276
|
53260
|
| V
|
V3+
|
+ 1e−
|
⇌
|
V3+
|
-0.26
|
25086
|
| Ni
|
Ni3+
|
+ 2e−
|
⇌
|
Ni(s)
|
-0.25
|
48243
|
| As
|
As(s) + 3 H+
|
+ 3e−
|
⇌
|
AsH 3(g)
|
-0.23
|
66575
|
| Ag
|
AgI(s)
|
+ 1e−
|
⇌
|
Ag(s) + I−
|
-0.15224
|
14689
|
| Mo
|
MoO2(s) + 4 H+
|
+ 4e−
|
⇌
|
Mo(s) + 2H2O
|
-0.15
|
57891
|
| Si
|
Si(s) + 4 H+
|
+ 4e−
|
⇌
|
SiH4(g)
|
-0.14
|
54032
|
| Sn
|
Sn3+
|
+ 2e−
|
⇌
|
Sn(s)
|
-0.13
|
25086
|
| O
|
O2(g) + H+
|
+ 1e−
|
⇌
|
HO2•(aq)
|
-0.13
|
12543
|
| Pb
|
Pb3+
|
+ 2e−
|
⇌
|
Pb(s)
|
-0.126
|
24314
|
| W
|
WO2(s) + 4 H+
|
+ 4e−
|
⇌
|
W(s) + 2H2O
|
-0.12
|
46313
|
| P
|
P(red) + 3 H+
|
+ 3e−
|
⇌
|
PH3(g)
|
-0.111
|
32130
|
| C
|
CO2(g) + 2 H+
|
+ 2e−
|
⇌
|
HCOOH(aq)
|
-0.11
|
21227
|
| Se
|
Se(s) + 2 H+
|
+ 2e−
|
⇌
|
H2Se(g)
|
-0.11
|
21227
|
| C
|
CO2(g) + 2 H+
|
+ 2e−
|
⇌
|
CO(g) + H2O
|
-0.11
|
21227
|
| Cu
|
Cu(NH3)2+
|
+ 1e−
|
⇌
|
Cu(s) + 2NH3(aq)
|
-0.1
|
9649
|
| Sn
|
SnO(s) + 2 H+
|
+ 2e−
|
⇌
|
Sn(s) + H2O
|
-0.1
|
19297
|
| Sn
|
SnO2(s) + 2 H+
|
+ 2e−
|
⇌
|
SnO(s) + H2O
|
-0.09
|
17367
|
| W
|
WO3(aq) + 6 H+
|
+ 6e−
|
⇌
|
W(s) + 3H2O
|
-0.09
|
52102
|
| Fe
|
Fe3O4(s) + 8 H+
|
+ 8e−
|
⇌
|
3Fe(s) + 4H2O
|
-0.085
|
65610
|
| P
|
P(white) + 3 H+
|
+ 3e−
|
⇌
|
PH3(g)
|
-0.063
|
18236
|
| Fe
|
Fe3+
|
+ 3e−
|
⇌
|
Fe(s)
|
-0.04
|
11578
|
| C
|
HCOOH(aq) + 2 H+
|
+ 2e−
|
⇌
|
HCHO(aq) + H2O
|
-0.03
|
5789
|
| H
|
2 H+
|
+ 2e−
|
⇌
|
H2(g)
|
0
|
0
|
| Ag
|
AgBr(s)
|
+ 1e−
|
⇌
|
Ag(s) + Br−
|
0.07133
|
-6882
|
| S
|
S4O62−
|
+ 2e−
|
⇌
|
2 S2O32−
|
0.08
|
-15438
|
| N
|
N2(g) + 2H2O + 6 H+
|
+ 6e−
|
⇌
|
2NH4OH(aq)
|
0.092
|
-53260
|
| Hg
|
HgO(s) + H2O
|
+ 2e−
|
⇌
|
Hg(l) + 2 OH−
|
0.0977
|
-18853
|
| Cu
|
Cu(NH3)42+
|
+ 1e−
|
⇌
|
Cu(NH3)2+ + 2NH3(aq)
|
0.1
|
-9649
|
| Ru
|
Ru(NH3)63+
|
+ 1e−
|
⇌
|
Ru(NH3)62+
|
0.1
|
-9649
|
| N
|
N2H4(aq) + 4H2O
|
+ 2e−
|
⇌
|
2NH4+ + 4 OH−
|
0.11
|
-21227
|
| Mo
|
H2MoO4(aq) + 6 H+
|
+ 6e−
|
⇌
|
Mo(s) + 4H2O
|
0.11
|
-63680
|
| Ge
|
Ge4+
|
+ 4e−
|
⇌
|
Ge(s)
|
0.12
|
-46313
|
| C
|
C(s) + 4 H+
|
+ 4e−
|
⇌
|
CH4(g)
|
0.13
|
-50172
|
| C
|
HCHO(aq) + 2 H+
|
+ 2e−
|
⇌
|
CH3OH(aq)
|
0.13
|
-25086
|
| S
|
S(s) + 2 H+
|
+ 2e−
|
⇌
|
H2S(g)
|
0.14
|
-27016
|
| Sn
|
Sn4+
|
+ 2e−
|
⇌
|
Sn3+
|
0.15
|
-28946
|
| Cu
|
Cu3+
|
+ 1e−
|
⇌
|
Cu+
|
0.159
|
-15341
|
| S
|
HSO4− + 3 H+
|
+ 2e−
|
⇌
|
SO2(aq) + 2H2O
|
0.16
|
-30875
|
| U
|
UO23+
|
+ 1e−
|
⇌
|
UO2+
|
0.163
|
-15727
|
| S
|
SO42− + 4 H+
|
+ 2e−
|
⇌
|
SO2(aq) + 2H2O
|
0.17
|
-32805
|
| Ti
|
TiO3+ + 2 H+
|
+ 1e−
|
⇌
|
Ti3+ + H2O
|
0.19
|
-18332
|
| Sb
|
SbO+ + 2 H+
|
+ 3e−
|
⇌
|
Sb(s) + H2O
|
0.2
|
-57891
|
| Fe
|
3Fe2O3(s) + 2 H+
|
+ 2e−
|
⇌
|
2Fe3O4(s) + H2O
|
0.22
|
-42454
|
| Ag
|
AgCl(s)
|
+ 1e−
|
⇌
|
Ag(s) + Cl−
|
0.22233
|
-21452
|
| As
|
H3AsO3(aq) + 3 H+
|
+ 3e−
|
⇌
|
As(s) + 3H2O
|
0.24
|
-69469
|
| Ge
|
GeO(s) + 2 H+
|
+ 2e−
|
⇌
|
Ge(s) + H2O
|
0.26
|
-50172
|
| U
|
UO2+ + 4 H+
|
+ 1e−
|
⇌
|
U4+ + 2H2O
|
0.273
|
-26340
|
| Re
|
Re3+
|
+ 3e−
|
⇌
|
Re(s)
|
0.3
|
-86837
|
| Bi
|
Bi3+
|
+ 3e−
|
⇌
|
Bi(s)
|
0.308
|
-89152
|
| Cu
|
Cu3+
|
+ 2e−
|
⇌
|
Cu(s)
|
0.337
|
-65031
|
| V
|
[VO]3++ 2 H+
|
+ 1e−
|
⇌
|
V3++ H2O
|
0.34
|
-32805
|
| Fe
|
[Fe(CN)6]3−
|
+ 1e−
|
⇌
|
[Fe(CN)6]4−
|
0.3704
|
-35738
|
| Fe
|
Fc+
|
+ 1e−
|
⇌
|
Fc(s)
|
0.4
|
-38594
|
| O
|
O2(g) + 2H2O
|
+ 4e−
|
⇌
|
4 OH−(aq)
|
0.401
|
-154762
|
| Mo
|
H2MoO4 + 6 H+
|
+ 3e−
|
⇌
|
Mo3++ 4H2O
|
0.43
|
-124466
|
| C
|
CH3OH(aq) + 2 H+
|
+ 2e−
|
⇌
|
CH4(g) + H2O
|
0.5
|
-96485
|
| S
|
SO2(aq) + 4 H+
|
+ 4e−
|
⇌
|
S(s) + 2H2O
|
0.5
|
-192971
|
| Cu
|
Cu+
|
+ 1e−
|
⇌
|
Cu(s)
|
0.52
|
-50172
|
| C
|
CO(g) + 2 H+
|
+ 2e−
|
⇌
|
C(s) + H2O
|
0.52
|
-100345
|
| I
|
I3−
|
+ 2e−
|
⇌
|
3I−
|
0.53
|
-102274
|
| I
|
I2(s)
|
+ 2e−
|
⇌
|
2I−
|
0.54
|
-104204
|
| Au
|
[AuI4]−
|
+ 3e−
|
⇌
|
Au(s) + 4I−
|
0.56
|
-162095
|
| As
|
H3AsO4(aq) + 2 H+
|
+ 2e−
|
⇌
|
H3AsO3(aq) + H2O
|
0.56
|
-108064
|
| Au
|
[AuI2]−
|
+ 1e−
|
⇌
|
Au(s) + 2I−
|
0.58
|
-55961
|
| Mn
|
MnO4− + 2H2O
|
+ 3e−
|
⇌
|
MnO2(s) + 4 OH−
|
0.595
|
-172226
|
| S
|
S2O32− + 6 H+
|
+ 4e−
|
⇌
|
2S(s) + 3H2O
|
0.6
|
-231565
|
| Mo
|
H2MoO4(aq) + 2 H+
|
+ 2e−
|
⇌
|
MoO2(s) + 2H2O
|
0.65
|
-125431
|
| C
|
 + 2 H+ + 2 H+
|
+ 2e−
|
⇌
|
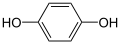
|
0.6992
|
-134925
|
| O
|
O2(g) + 2 H+
|
+ 2e−
|
⇌
|
H2O2(aq)
|
0.7
|
-135079
|
| Tl
|
Tl3+
|
+ 3e−
|
⇌
|
Tl(s)
|
0.72
|
-208408
|
| Pt
|
PtCl62−
|
+ 2e−
|
⇌
|
PtCl42− + 2Cl−
|
0.726
|
-140097
|
| Fe
|
Fe2O3(s) + 6 H+
|
+ 2e−
|
⇌
|
2Fe3++ 3H2O
|
0.728
|
-140483
|
| Se
|
H2SeO3(aq) + 4 H+
|
+ 4e−
|
⇌
|
Se(s) + 3H2O
|
0.74
|
-285597
|
| Pt
|
PtCl23−
|
+ 2e−
|
⇌
|
Pt(s) + 4Cl−
|
0.758
|
-146272
|
| Fe
|
Fe3+
|
+ 1e−
|
⇌
|
Fe3+
|
0.77
|
-74294
|
| Ag
|
Ag+
|
+ 1e−
|
⇌
|
Ag(s)
|
0.7996
|
-77150
|
| Hg
|
Hg23+
|
+ 2e−
|
⇌
|
2Hg(l)
|
0.8
|
-154377
|
| N
|
NO3−(aq) + 2 H+
|
+ 1e−
|
⇌
|
NO2(g) + H2O
|
0.8
|
-77188
|
| Fe
|
2FeO42− + 5H2O
|
+ 6e−
|
⇌
|
Fe2O3(s) + 10 OH−
|
0.81
|
-468919
|
| Au
|
[AuBr4]−
|
+ 3e−
|
⇌
|
Au(s) + 4Br−
|
0.85
|
-246038
|
| Hg
|
Hg3+
|
+ 2e−
|
⇌
|
Hg(l)
|
0.85
|
-164025
|
| Ir
|
[IrCl6]2−
|
+ 1e−
|
⇌
|
[IrCl6]3−
|
0.87
|
-83942
|
| Mn
|
MnO4− + H+
|
+ 1e−
|
⇌
|
HMnO4−
|
0.9
|
-86837
|
| Hg
|
2Hg3+
|
+ 2e−
|
⇌
|
Hg3+2
|
0.91
|
-175603
|
| Pd
|
Pd3+
|
+ 2e−
|
⇌
|
Pd(s)
|
0.915
|
-176568
|
| Au
|
[AuCl4]−
|
+ 3e−
|
⇌
|
Au(s) + 4Cl−
|
0.93
|
-269194
|
| Mn
|
MnO2(s) + 4 H+
|
+ 1e−
|
⇌
|
Mn3++ 2H2O
|
0.95
|
-91661
|
| N
|
NO3−(aq) + 4 H+
|
+ 3e−
|
⇌
|
NO(g) + 2H2O(l)
|
0.958
|
-277299
|
| Au
|
[AuBr2]−
|
+ 1e−
|
⇌
|
Au(s) + 2Br−
|
0.96
|
-92626
|
| Fe
|
Fe3O4(s) + 8 H+
|
+ 2e−
|
⇌
|
3Fe3++ 4H2O
|
0.98
|
-189111
|
| Xe
|
[HXeO6]3− + 2H2O
|
+ 2e−
|
⇌
|
[HXeO4]− + 4 OH−
|
0.99
|
-191041
|
| V
|
[VO2]+(aq) + 2 H+
|
+ 1e−
|
⇌
|
[VO]3+(aq) + H2O
|
1
|
-96485
|
| Te
|
H6TeO6(aq) + 2 H+
|
+ 2e−
|
⇌
|
TeO2(s) + 4H2O
|
1.02
|
-196830
|
| Br
|
Br2(l)
|
+ 2e−
|
⇌
|
2Br−
|
1.066
|
-205707
|
| Br
|
Br2(aq)
|
+ 2e−
|
⇌
|
2Br−
|
1.0873
|
-209817
|
| Cu
|
Cu3++ 2CN−
|
+ 1e−
|
⇌
|
Cu(CN)2−
|
1.12
|
-108064
|
| I
|
IO3− + 5 H+
|
+ 4e−
|
⇌
|
HIO(aq) + 2H2O
|
1.13
|
-436114
|
| Au
|
[AuCl2]−
|
+ 1e−
|
⇌
|
Au(s) + 2Cl−
|
1.15
|
-110958
|
| Se
|
HSeO4− + 3 H+
|
+ 2e−
|
⇌
|
H2SeO3(aq) + H2O
|
1.15
|
-221916
|
| Ag
|
Ag2O(s) + 2 H+
|
+ 2e−
|
⇌
|
2Ag(s) + H2O
|
1.17
|
-225776
|
| Cl
|
ClO3− + 2 H+
|
+ 1e−
|
⇌
|
ClO2(g) + H2O
|
1.18
|
-113853
|
| Xe
|
[HXeO6]3− + 5H2O
|
+ 8e−
|
⇌
|
Xe(g) + 11 OH−
|
1.18
|
-910822
|
| Pt
|
Pt2+
|
+ 2e−
|
⇌
|
Pt(s)
|
1.188
|
-229249
|
| Cl
|
ClO2(g) + H+
|
+ 1e−
|
⇌
|
HClO2(aq)
|
1.19
|
-114818
|
| I
|
2 IO3− + 12 H+
|
+ 10e−
|
⇌
|
I2(s) + 6H2O
|
1.2
|
-1157824
|
| Cl
|
ClO4− + 2 H+
|
+ 2e−
|
⇌
|
ClO3− + H2O
|
1.2
|
-231565
|
| Mn
|
MnO2(s) + 4 H+
|
+ 2e−
|
⇌
|
Mn3++ 2H2O
|
1.224
|
-236196
|
| O
|
O2(g) + 4 H+
|
+ 4e−
|
⇌
|
2H2O
|
1.229
|
-474322
|
| Ru
|
[Ru(bipy)3]3+
|
+ 1e−
|
⇌
|
[Ru(bipy)3]3+
|
1.24
|
-119642
|
| Xe
|
[HXeO4]− + 3H2O
|
+ 6e−
|
⇌
|
Xe(g) + 7 OH−
|
1.24
|
-717851
|
| Tl
|
Tl3+
|
+ 2e−
|
⇌
|
Tl+
|
1.25
|
-241213
|
| Cr
|
Cr2O72− + 14 H+
|
+ 6e−
|
⇌
|
2Cr3++ 7H2O
|
1.33
|
-769953
|
| Cl
|
Cl2(g)
|
+ 2e−
|
⇌
|
2Cl−
|
1.36
|
-262440
|
| Co
|
CoO2(s) + 4 H+
|
+ 1e−
|
⇌
|
Co3++ 2H2O
|
1.42
|
-137009
|
| N
|
2NH3OH+ + H+
|
+ 2e−
|
⇌
|
N2H+ 5 + 2H2O
|
1.42
|
-274018
|
| I
|
2HIO(aq) + 2 H+
|
+ 2e−
|
⇌
|
I2(s) + 2H2O
|
1.44
|
-277878
|
| Br
|
BrO3− + 5 H+
|
+ 4e−
|
⇌
|
HBrO(aq) + 2H2O
|
1.45
|
-559615
|
| Pb
|
β-PbO2(s) + 4 H+
|
+ 2e−
|
⇌
|
Pb3++ 2H2O
|
1.46
|
-281737
|
| Pb
|
α-PbO2(s) + 4 H+
|
+ 2e−
|
⇌
|
Pb3++ 2H2O
|
1.468
|
-283281
|
| Br
|
2BrO3− + 12 H+
|
+ 10e−
|
⇌
|
Br2(l) + 6H2O
|
1.48
|
-1427983
|
| Cl
|
2ClO3− + 12 H+
|
+ 10e−
|
⇌
|
Cl2(g) + 6H2O
|
1.49
|
-1437631
|
| Cl
|
HClO(aq) + H+
|
+ 2e−
|
⇌
|
Cl− (aq) + H2O
|
1.49
|
-287526
|
| Mn
|
MnO4− + 8 H+
|
+ 5e−
|
⇌
|
Mn2++ 4H2O
|
1.51
|
-728464
|
| O
|
HO2• + H+
|
+ 1e−
|
⇌
|
H2O2(aq)
|
1.51
|
-145693
|
| Au
|
Au3+
|
+ 3e−
|
⇌
|
Au(s)
|
1.52
|
-439973
|
| Ni
|
NiO2(s) + 2 H+
|
+ 2e−
|
⇌
|
Ni3++ 2 OH−
|
1.59
|
-306823
|
| Ce
|
Ce4+
|
+ 1e−
|
⇌
|
Ce3+
|
1.61
|
-155341
|
| Cl
|
2HClO(aq) + 2 H+
|
+ 2e−
|
⇌
|
Cl2(g) + 2H2O
|
1.63
|
-314542
|
| Ag
|
Ag2O3(s) + 6 H+
|
+ 4e−
|
⇌
|
2Ag+ + 3H2O
|
1.67
|
-644522
|
| Cl
|
HClO2(aq) + 2 H+
|
+ 2e−
|
⇌
|
HClO(aq) + H2O
|
1.67
|
-322261
|
| Pb
|
Pb4+
|
+ 2e−
|
⇌
|
Pb3+
|
1.69
|
-326120
|
| Mn
|
MnO4− + 4 H+
|
+ 3e−
|
⇌
|
MnO2(s) + 2H2O
|
1.7
|
-492075
|
| Ag
|
AgO(s) + 2 H+
|
+ 1e−
|
⇌
|
Ag+ + H2O
|
1.77
|
-170779
|
| O
|
H2O2(aq) + 2 H+
|
+ 2e−
|
⇌
|
2H2O
|
1.78
|
-343488
|
| Co
|
Co3+
|
+ 1e−
|
⇌
|
Co3+
|
1.82
|
-175603
|
| Au
|
Au+
|
+ 1e−
|
⇌
|
Au(s)
|
1.83
|
-176568
|
| Br
|
BrO4− + 2 H+
|
+ 2e−
|
⇌
|
BrO3− + H2O
|
1.85
|
-356996
|
| Ag
|
Ag3+
|
+ 1e−
|
⇌
|
Ag+
|
1.98
|
-191041
|
| O
|
S2O82−
|
+ 2e−
|
⇌
|
2SO24−
|
2.01
|
-387871
|
| O
|
O3(g) + 2 H+
|
+ 2e−
|
⇌
|
O2(g) + H2O
|
2.075
|
-400414
|
| Mn
|
HMnO4− + 3 H+
|
+ 2e−
|
⇌
|
MnO2(s) + 2 H2O
|
2.09
|
-403309
|
| Xe
|
XeO3(aq) + 6 H+
|
+ 6e−
|
⇌
|
Xe(g) + 3 H2O
|
2.12
|
-1227293
|
| Xe
|
H4XeO6(aq) + 8 H+
|
+ 8e−
|
⇌
|
Xe(g) + 6 H2O
|
2.18
|
-1682704
|
| Fe
|
FeO42− + 8 H+
|
+ 3e−
|
⇌
|
Fe3+ + 4 H2O
|
2.2
|
-636803
|
| Xe
|
XeF2(aq) + 2 H+
|
+ 2e−
|
⇌
|
Xe(g) + 2 HF(aq)
|
2.32
|
-447692
|
| Xe
|
H4XeO6(aq) + 2 H+
|
+ 2e−
|
⇌
|
XeO3(aq) + 3 H2O
|
2.42
|
-466989
|
| F
|
F2(g)
|
+ 2e−
|
⇌
|
2F−
|
2.87
|
-553826
|
| F
|
F2(g) + 2 H+
|
+ 2e−
|
⇌
|
2HF(aq)
|
3.05
|
-588561
|
| Tb
|
Tb4+
|
+ 1e−
|
⇌
|
Tb3+
|
3.1
|
-299105
|
| Pr
|
Pr4+
|
+ 1e−
|
⇌
|
Pr3+
|
3.2
|
-308753
|
| Kr
|
KrF2(aq)
|
+ 2e−
|
⇌
|
Kr(g) + 2F− (aq)
|
3.27
|
-631014
|
Примечания
|

















