Дијабетесна ретинопатија
Дијабетесна ретинопатија, болест мрежњаче у шећерној болести (ДР) (лат. Retinopathia diabetica) једна је од компликација шећерне болести која доводи до оштећења мреже капилара која крвљу снабдева мрежњачу ока. Хистопатолошке промене у дијабетесној ретинопатије резултат су микроваскуларних дисфункција мрежњаче настале у окружењу системске хипергликемије. Хистолошке промене које се јављају пре него што болест постане клинички манифестна обухватају осипање и задебљања перицита васкуларне базалне мембране. Најранији клинички налаз је појава микроанеурзматских формација, које су одраз препролиферативе промена. Остале промене у мрежњаче укључују препролиферативни едем жуте мрље, меки ексудат, трди ексудат, крварења унутар мрежњаче и абнормалности величине венских капилара (венско извлачење и дилатација). Пролиферативне промене у ДР одигравају се због наметнутих препролиферативних променама и обухватају васкуларизацију и пролиферацију фиброзног ткива у преретиналном простору, на периферији и шупљини стакластог тела. Највероватније је да су наведене морфолошке промене у ДР условљене интеракцијом бројних фактора који доводе до промена генске експресије и функције протеина у окружењу системске хипергликемије.[1][2][3][4] Болест се манифестује променама на очном дну које су праћене падом оштрине вида, а у најтежим случајевима и трајним губитком вида.[5] Дијабетесна ретинопатија је не само учестала већ и подмукла компликација шећерне болести најчешће без раних симптома, који и када се појаве захтевају компиковано лечење које је не тако често безуспешно и најчешће завршава слепилом.[6] Како се код великог броја болесника са шећерном болешћу може спречити прогресија ДР, добро организован и правовремени скрининг (рано откривање) ретинопатије од велике је важности, за успешно лечење и превенцију слепила.[7] У том смислу код болесника са типом 1 шећерне болести: офталмолошки или оптометријски преглед започиње у првих 5 година након постављене дијагнозе а код болесника са типом 2 шећерне болсети: чим се дијагноза постави. Затим се код обе групе болесника контролни офталмолошки или оптометријске преглед врше сваке 1 до 2 године у зависности од стања мрежњаче.[8] Код 100% особа са шећерном болешћу, током болести, развиће се неки вид, више или мање, изражене ретинопатије. Зато се може рећи да је дијабетесна ретинопатија озбиљан, не само медицински већ и социо-економски проблем друштва, као најчешћи узрок слепила код радно способне популације старости од 20 до 65 година. То поткрепљује и податак да се и до 25 пута чешће јавља код болесника са шећерном болешћу, него код опште популације, са нпр инциднцом од 50 до 65 на 100.000 болесника са шећерном болешћу годишње у Европи.[9] ИсторијаНајранији познати писани запис о шећерној болести потичу, највероватније из раног 6. века п. н. е., од индијског лекара Махаришија Сушруте који је болест описао као стање са „меденом мокраћом“. Сушрута је у свом, санскритским језиком написаном, делу Сушрута Самхита описао 76 очних болести (од којих 51 хируршких), као и неколико офталмолошких хируршких инструмента и техника.[10][11] Описи шећерне болести такође се појављује у раним египатским записима, а грчки лекари објавили су податке о грчевима у мишићима удова праћеним променама у мокраћи, сличним данашњим описима симптома код шећерне болести. Компликације у шећерној болести, као што су слепило и друге болести ока, мало су описане кроз историју медицине, јер су вероватно такви случајеви били ретки, због релативно кратког животног века болесника након развој шећерне болести. Херман фон Хелмхолц (1821—1894) и Ернст Абе (1840—1905), сувласник фабрике Цајс у Немачкој, значајно су допринели многим областима науке. Фон Хелмхолц је први конструисао офталмоскоп 1851. што је лекарима омогућило проучавање патолошких промена у унутрашњости ока, укључујући и оне код дијабетесне ретинопатије. Дијабетесну ретинопатију први је описао фон Јагер Бајтраг 1855. године.[12] У почетку, промене на очном дну тумачене су као последица хипертензије која је доста често удружена са шећерном болешћу, а ретинопатија код дијабетичара је објашњавана као инфламаторни одговор мрежњаче на повишени ниво албумина и урее. Нешто касније, утврђено је постојање везе између шећерне болести и васкуларних промена у мрежњачи. И поред ових открића, дијабетесна ретинопатија је дужи временски период била релативно ретка компликација у шећерној болести. Откриће инсулина од стране Сер Фредерик Грант Бантинг и Чарлс Херберт Беста 1921. унело је револуцију у лечење шећерне болести и значајно продужило живот особа са овом болешћу. Бантинг, Бест и сарадници (посебно хемичар Колип) успели су да изолују инсулин из панкреаса говечета на Универзитету у Торонту, што је 1922. године омогућило његову масовну примену у терапији шећерне болести. Годину дана касније, Бантинг и директор лабораторије Маклауд за ово откриће су добили Нобелову награду.[13] Нехумано звучи, али повећана „дуговечност болесника“ након масовне принмене инсулина обезбедила је болесницима са шећерном болешћу „да имају више времена“ за развој касних компликација као што је ретинопатија и слепило. Губитак вида и слепило код дијабетесне ретинопатије тако је постао један од водећих и све већих проблема у офталмологији, а њено лечење је у првој половини 20. века било безуспешно. На директан однос између нивоа шећера у крви и дијабетесне ретинопатија посумњало се почетком 20. века али дуго та сумња није доказана или бар универзално прихваћена. Док је део офталмолога тврдио да шећерна болест има примарни ефекат на базалну мембрану крвних судова независно од нивоа глукозе у крви,[14] други су чврсто веровали да контрола нивоа глукозе у крви успорава напредовање васкуларних промена у мрежњачи. Тек када су развијени апарати, које су пацијенти могли да користе за проверу ниво шећера у крви, у више наврата током дана, омогућена је интензивна превентивна контрола нивоа глукозе у крви. Бројне клиничке студије с краја 20. века доказале су да су редовном контролом глукозе створени услови за добру глукорегулацију у крви што је спречило или бар успорити прогресије ретинопатије код већег броја болесника.[15] Изучавање губитка вида, настог гледањем у Сунце, познато вековима још из времена Платона (427—347), које се карактерише опекотинама на мрежњачи имало је велики значај за даљи развој офталмоскопије и примену фотокоагулације у лечењу болести мрежњаче. Могућност коришћења Сунчевог светла за лечење болести мрежњаче постепено је еволуирао и у праксу увео немачки офталмолог нем. Gerhard Rudolph Edmund Meyer-Schwickerath, на основу сопствених запажања, које је уочио након помрачења Сунца 10. јула 1945, када је велики број људи изгубио вид због сунчевом светлошћу изазваних опекотина. Герхард је дошао на идеју да примени контролисану употребу светлост Сунца у лечењу болести мрежњаче. На крову операционе сале изградио је специјални уређај за хватање сунчеве светлости (познат као Meyer-Schwickerath коагулатор) и уз помоћ њега довео сноп усмерене сунчеве светлости на мрежњачу болесника. Тиме је он вршио прве фотокоагулација ока тј уз помоћ ње вештачки стварао опекотине на мрежњачи које је требало да смање прогресију болести.[16] Како се у пракси ова метода показала као непрактична, а опрема прегломазна, експерименте је Герхард наставио са другим изворима светлости. Герхард је прве резултате у лечењу отока мрежњаче и суспектних меланома мрежњаче применом сунчеве светлости званично објавио 1949. године. Слична истраживања, независно су радили и Moran-Sales, и убрзо након Герхарда, објавили своје резултате 1950. године. Ова истраживања била су заправо увод у данас масовно примењивану методу фотокоагулације. Први апарат за фотокоагулацију са светлосним луком који је потицао од ксенонских сијалица високог притиска (уместо сунчеве светлости), 1950. конструисала је и применила једна Америчка фирма (енгл. American Optical Corporation in Southbridge, Massachusetts).  Почетни резултати у лечењу дијабетесне ретинопатије применом фотокоагулације ксенонском лампом били су обесхрабрујући. Међутим након упорног истраживања током 1950-их и 1960-их од стране Ветцинга, Амалрика, Окуна и Весинга и све већег броја других офталмолога широм света добијајани су све бољи резултати у лечењу ДР.[17][18][19][20][21][22][23] Кембел и Звенг, нешто касније, независно користите таласне дужине рубинског ласера са ограниченим успехом у лечењу у раним 1960-им, да би још касније Бетхам и Ајело добили знатно боље резултате у лечењу дијабетесне ретинопатије рубинском ласерфотокоагулацијом, нарочито након примене широкопојасне панретиналне фотокоагулације (ПРП).[24][25] Историја лечења дијабетесне ретинопатије дуга је више од 60 година и наставља да се развија са новим иновацијама. Оне се састоје од много важних, креативних и нови концепата, елабората, бројних лабораторијских и клиничких истраживачких пројеката, развоја револуционарних инструмената и процедура и софистицираних метода које се корист за контролу шећера у крви, као и од одговарајуће фотокоагулације и очне хирургије. Будућност за болеснике са ДР је охрабрујућа због нових открића која ће надамо се додатно повећати способност да се сачува и поврати вид људи са шећерном болешћу. Анатомија и физиологија мрежњаче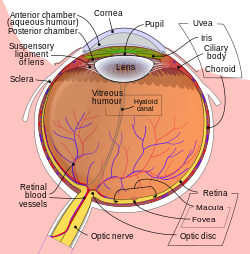  Мрежњача (лат. Retina), један је од најважнијих функционалних делова ока и њен унутрашњих омотач на задњем зиду. Она је око 0,5 mm дебела овојница и фотосензитивно ткиво сложене, слојевите грађе, које облаже унутрашњу површину очне јабучице. Мрежњача је структура сложене, слојевите грађе која се састоји од више врста ћелијских елемената: неурона, глијалних ћелија, микроглије, крвних судова, пигментног епитела. Неколико слојева нервних ћелија у мрежњачи међусобно је повезаних синапсама. Једине нервне ћелије у организму које су директно фотосензитивне су фоторецепторске ћелије. Фоторецепторске ћелије чине већим делом два типа ћелија, штапићи и чепићи, који помажу у стварању осећаја светла и распознавању боја. Штапићи се углавном активирају код слабијег светла у сумрак и ноћу и осигуравају црно бели (ноћни) вид док чепићи омогућавају вид дању и опажај боја. Трећи далеко ређи тип фоторецепторских ћелија чине фотосензитивне ганглијске ћелије које су важне за рефлексне реакције ока на интензивно дневно светло.[26] Видне ћелије ока повезане су са нервним влакнима који се по изласку из мрежњаче удружују у видни живац. Оптика ока ствара слику видног света на мрежњачи и има функцију сличну оној коју има филм у фотографском апарату. Светлост која пада на мрежњачу изазива читав низ електричних и хемијских надражаја који у даљем току, физиолошких функција, активирају нервне надражаје и шаљу их у видне центре у мозгу путем влакана видног живца. Мрежњача се функционално сматра делом централног нервног систем, а будући да се током ембрионалног развоја кичмењака она и видни живац формирају као изданци развијајућег мозга. То је једини део централног нервног система који се може неинвазивно приказати у живом организму.[26] За нормалну фунцију вида неопходна је ненарушена веза и комуникација између свих ћелија мрежњаче ока, које детаљније описујемо у наставку текста.
   Неурони и глијалне ћелије мрежњаче чине више од 95% укупне масе мрежњача. Како су транспарентни за видљиву светлост, њихова структура и функција се не може установити на клиничком прегледу. Као што је показано на слици десно, мрежњача се примарно састоји од нервног ткива, или неурона мрежњаче, тј ћелија које омогућавају вид. Оне укључују фоторецепторе, амакрине, биполарне, хоризонталне и ганглијске ћелије.[27] Електрични „улази“ из све четири врсте неурона конвергирају ка ганглијама, а ектрични импулси из ганглиона преносе сека мозгу преко аксона нервних влакана и оптиког живца. Висок степен конвергенције и интеграције сигнала у мрежњачи региструје се у односу 10:1, у фоторецепторима (≈ 130 милиона) и ганглионима (≈ 1,2 милиона) по људском оку. Стога, поремећај у било ком од неуронских слојева може да омете вид. Због специфичне структуре и редундантне грађе, мрежњача има способност да претрпи смрт многих ћелија пре губитка функције вида. [а]
Глијалне ћелије мрежњаче - Милерове ћелија и астроцити - су потпорне или ћелије подршке за неуроне и крвне судове мрежњаче.[28] Оне регулишу екстрацелуларну концентрацију материја потребних за стварање јонског акционог потенцијала, метаболизам неуротрансмитера (као што је глутамат), и транспорт супстрата кроз крвне судове потребног за метаболизам неурона мрежњаче (глукозе, липида, амино киселина). Њихова улога у регулацији глутамата нарочито је важна, јер вишак глутамата као одговор на исхемију мрежњаче или шећерну болест, делује токсично на неуроне што може изазвати смрт неуронских ћелија.[29] Васкуларни ендотелни фактор раста (VEGF) је главни цитокин укључен у овај процес као производ астроцити и Милерових ћелија. Астроцити сигналишу када крвни судови треба да створе баријеру у мрежњачи и измене проток крви,[29] развојем уских раскрсница у ендотелијалним ћелијама мрежњаче,[30] и преко функцију синапси мрежњаче,[31] регулишу функцију вида.[32] Међутим, многи детаљи начина на који глијалне ћелије контролишу нормалне функције ретине остају и даље непознаница.
Микроглију чине из коштане сржи изведени макрофаги који бораве у метаболичкој средини мрежњаче. Они реагују на разноврсне надражаје, као што су, инфекције или трауме мрежњаче (укључујући и ласерфотокоагулацију) све до пролиферације, миграције и отпуштање инфламаторних цитокина, као што су интерлеукин-1, ВЕГФ и фактор некрозе тумора-α.[33][34] Оштећења мрежњаче повећава миграцију из коштане сржи изведених имунских ћелија у мрежњачи и диференцијацију микроглијалних ћелија.[35] У кратком року, ови механизми могу представљати повољан одговор на лезију, али продужена дејства лезије активирају хронични одговор на ћелијска оштећења.
Фоторецепторске и друге ћелије мрежњаче ока примају кисеоник и друге хранљиве материје из сићушних крвних судова (микроциркулације) у њиховој околини. Ови крвни судови који чине васкуларну мрежу мрежњаче састоје се од крвних судова у и изван мрежњаче.[36] Микроциркулацију мрежњаче чине прекапиларне артериоле, капилари и постакпиларне вене. Артериоле поседује глатке мишићне ћелије, које им омогућавају да промени свој пречник и регулишу динамику локалне дистрибуције крви у мрежњачи. Прекапиларне артериоле су примарни судови за регулацију отпора протоку крви, док венула имају високу густину рецептора за вазоактивне супстанце, као што је хистамин. Венула су пре свега пасивни крвни судови, који служе за дренирање крви из мрежњаче. Капилари и венула су примарна места кроз која се врши дифузије течности у мрежњачи под нормалним условима. У патолошким стањима као што је шећерна болест кроз њихове зидове дифузија араста.[37] Ауторегулација мрежњаче као и код осталих крвних судова у другим органима је под утицајем централног нервног систем који у одређеном органу одржава одговарајућу проток крви упркос променама системског артеријскоги притиска.[36] Артеријски крвни судови мрежњаче у свом зиду имају глатке мишићне ћелије, док капилари, артериоле и венула поседују периците, који функционишу као модификоване глатке мишићне ћелије. Ове карактеристике крвних судова омогућавају мрежњачи да се њена циркулација процесом ауторегулације прилагоди и одговори на одговарајуће системске и локалне метаболичке захтеве. Ауторегулација крвних судова такођенастаје и као одговор на промене парцијалног притиска кисеоника (pO2) и угљен-диоксида (pCO2). Стога, се крвни судова скупљају као одговору на хипероксемију и шире као одговор на хиперкапнију. Артериоле мрежњаче се сужавају код болесника са хипертензијом што је офталмоскопски знак ауторегулаторог одговора за одржавање нормалног интраваскуларног (хидростатог) притисак преко обима васкуларног зида и протока течности кроз мрежњачу. Када ауторегулаторни механизми протока крви наиђу на баријеру у мрежњачи, као када су препуњени у хипертензији, крв, серозни ексудат и липидни ексудат се акумулирају у макули, па оптички диск може да набубри (постане едематозан). То је, карактеристика хипертензивних ретинопатија које могу да се схвате у светлу ових патофизиолошким процеса.[38] Под нормалним условима, проток крви кроз мрежњачу уравнотежен је, како би испорука хранљивих материја и уклањање отпадних продуката омогућило у мрежњачи одвијање нормаланог метаболизма. Зидови ових крвних судова су веома танки, како би хранљиве материје без потешкоћа могле да кроз њих прођу до чепића и штапића. Током година висок ниво шећера у крви има за последицу појаву системски промена у метаболизму угљених хидрата, липида и протеина, што доводи до васкуларних и ткивних оштећења у органу као што је мрежњаче. Тако, настаје дијабетесна ретинопатија као фундаментални поремећај функција мрежњаче због системски нарушеног метаболизма глукозе који оштећује нервне структуре ткива мрежњаче и њима придружене крвне судове, што доводи до неуроваскуларне дегенерације или сензорне неуропатије.[26]
 Жута пигментирн зона на мрежњачи ока,[39] по којој је добила назив жута мрља (лат. macula lutea), део је мрежњаче који садржи највећи број чулних ћелија. Цела област жуте мрље састоји се од централне или фовеалне јаме (лат. fovea centralis), јамског (фовеалног) нагиба, парафовее и перифовее. Жута мрља је зона најјаснијег вида на мрежњачи ока јер садржи највећи број густо збијене чулних ћели ја.[40] Налази се на мрежњачи где хоризонтална оса дели очну јабучицу на горњу и доњу половину. У жутој мрљи, ствара се обрнута и умањена слика онога што видимо, која је претходно прошла кроз рожњачу, зеницу, очно сочиво и стакласто тело.[41] Сматра се да жута мрља делује као филтер кратке таласне дужине, који се додаје објектив фотоапарата.[42] Централни део жуте мрље је централна јама која је од суштинског је значаја, као најважнији део мрежњаче, за људски вид, јер поседује заштитне механизме за избегавање штетног дејства интензивне светлости и ултраљубичастог зрачења. Ако уништимо жуту мрљу постајемо слепи.[43] Шећерном болешћу изазване болести окаСа овом групом болести ока, као статистички значајним компликацијама шећерне болести, сусреће се све већа група болесника у свету. У најчешће болести ока које се јављају као компликација шећерне болести спадају:
Класификација дијабетесне ретинопатијеКласификација дијабетесне ретинопатије у основи се заснива на појави и анатомском распореду оштећења које се јављају на мрежњачи.
На основу карактеристика ДР (описаних у горњој табели), ETDRS (Early Treatment Diabetic Retinopathy Study Research Group) група лекара која је спровела обимну студију, предложила је правило да се клинички издвоје пацијенти са великим степеном ризика за пролиферативну ДР. Они су то засновали на доказима да умерена НПДР у 15% случајева може да пређе у ПДР унутар годину дана, а тешка НПДР ако има две од наведених карактеристка, у 45% случајева у пролиферативну дијабетесне ретинопатију.[45] ЕпидемиологијаШећерна болест је масовно хронично обољења у сталном порасту. Почетком 21. века у свету је регистровано 171 милиона оболелих од шећерне болести (2,8% популације). Предвиђања су да ће до 2030. године тај број бити више него удвостручен и износиће 366 милиона (4,4% популације). Нарочито је изражен пораст броја оболелих од шећерне болести у развијеним земљама у којима је само од 1995.—2000. године инциденца порасла за 8,5%, а у земљама у развоју и двоструко више 18%.[46] Рана инвалидност до које доводи шећерна болест развојем бројних компликација међу којима доминантно место због губитка вида и 100% инвалидности, има дијабетесна ретинопатија, све више постаје велико оптерећење за медицински систем и национални буџет, пре свега земаља у развоју.[47]
ДР је један од водећих узрочник слепила и слабовидости како у развијеним тако и у земаљама у развоју, међу којима спада и Србија.[49] Глобално у свету ДР, као узрочник оштећења вида и слепила на петом је месту заступљености са 4,8%. У развијеним земљама Европе ДР је на трећем месту после сенилне дегенерације макуле и глаукома и заступљена је са око 17%.[50] Као водећи узрочник слепила радно активне популације (између 45 и 65 године) ДР поред медицинског велики је и социо-економски проблем. Према подацима из једне од најразвијенијих земаља света (Сједињене Америчке Државе), од око 16 милиона Американаца који болују од шећерне болести, само око 50% особа зна да болује од ДР. Од оних који за то знају, само половина спроводи редовну и одговарајућу негу очију. Стога, не изненађујуће чињеница да је дијабетесна ретинопатија један од водећих узрока слепила код лица старости од 25 до 74 година у Сједињеним Америчким Државама. Око 700.000 Американаца болује од пролиферативног облика дијабетесне ретинопатије, са годишњом учесталости од 65.000. Око 500.000 лица испољава клинички значајан едем макуле, са годишњом учесталости од 75.000.[51] Само у САД шећерна болест је одговорна за око 8.000 губитка вида сваке године, што значи да је ДР одговорна за 12% слепила.[52] Преваленца ретинопатије значајно се не разликује између мушкараца и жена (тај однос је 11,5% : 12,7%).[5] Студије спроведена у Данској показале су да је укупна преваленца ретинопатије код данске популације од 77% код мушкараца и 74% код жена са дијабетесом типа 1.[53] Међутим стопа слепила је различита међу одређеним етничким групама. Повећан ризик од дијабетесне ретинопатије, утврђен бројним истраживањима, постоји код америчких пацијената хиспаноцрнаца (16,3%) и мексичких Американаца (18,0%) у поређењу са нехиспано белцима (11,4%).[54] Са повећањем дужине трајања шећерне болести или са старењем од њеног почетка, постоји већи ризик за развоја дијабетесне ретинопатије и њених компликација, укључујући и дијабетесни едема макуле или пролиферативна дијабетесну ретинопатију. Тако се код пацијената са дијабетесом типа 1, клинички манифестни облик ретинопатије може јавити у првих 5 година након постављања дијагнозе шећерне болести. Након 10 до 15 година, 25 до 50% пацијената показују неке знаке ретинопатије. Певаленца ДР расте на 75 до 95% после 15 година болести и приближава се вредности од 100% након 30 година боловања од шећерне болести.[5] Пролиферативни облик дијабетесне ретинопатијае (ПДР) ретко се јавља у првој деценији болести код типа 1 шећерне болести, али се зато учесталије дијагностикује (од 14 до 17%) до 15 година живота, и непрестано расте са годинама.[5] Код болесника са шећерном болешћу типа 2, инциденца дијабетесне ретинопатије непрестано расте са трајањем болести. Тако 2,23% болесника са шећерном болешћу типа 2, има манифестну нонпролиферативу дијабетесну ретинопатију (НПДР) после 11 до 13 година, 41% после 14 до 16 година, а 60% након 16 година.[5] ЕтиологијаДијабетесна ретинопатија је последица или једна од тежих компликација код болесника са шећерном болешћу због патолошких промена на крвним судовима очног дна, тј мрежњаче или ретине. Узрокована је дуготрајно повишененим вредности шећера у крви које оштећују зидове крвних судова целог организма па и очију. Шећерном болешћу оштећени крвни судови постају пропустљива и доводе до крварења у мрежњачи. На ове промене, након више година болести због сужења лумена крвних судова долази до запушења капилара мрежњаче, што за последицу има исхемију у подручју које они исхрањују. У овом случају недостатак кисеоника за исхрану ћелија мрежњаче, представља стимуланс за раст (умножавања) нових капилара и фиброзног (ожиљног) ткива. Тако створени нови крвни судови су крхки, па лако долази до њиховог пуцања и крварења у оку, које има за последицу пропадање ткива мрежњаче. Тако на очном дну настају иреверзибилне промене које воде ка трајном губитку вида или слепилу.[5] Фактори ризикаДужина трајање шећерне болестиНајјачи предиктор за распрострањеност ретинопатије код болесника са типом 1 и типом 2 шећерне болести је дужина трајање шећерне болести. У спроведеним студијама, преваленца ретинопатија је 0% до 8% међу болесницима са трогодишњим трајањем, 25% до 28% са петогодишњим, 60% са десетогодишњим и 80% са петнаестогодишњим трајањем шећерне болести.[55][56][57][58]. У другим студијама наведена преваленција пролиферативне ретинопатије је 0% за болеснике са шећерном болешћу у трајању до 3 године, и повећава се на 25% након 15 година трајања болести од момента дијагностиковања. У принципу, већа је преваленца ретинопатије код типа 2 шећерне болести у односу на тип 1 шећерне болести јер су ефекти дужег трајања шећерне болести, пре постављања дијагнозе код пацијената са типом 2 шећерне болести, често непознати, или према неким студијама износе приближно 4 до 7 година пре постављања дијагнозе типа 2 шећерне болести.[59] Међу болесницима са шећерном болешћу у старијој животној доби, 2% су они код којих се за мање од 5 година развија ДР, или 5% оних код којих ће се за 15 или више година развити ДР. Код особа које нису примењивале инсулин као основни вид лечења шећерне болести, знаци пролиферативне ДР јавили су се након четворогодишњег периода праћења.[60] Неадекватна гликорегулацијаЈедан од најважнијих фактора ризика за обољевање од дијабетесне ретинопатије је остварени ниво гликорегулације у дужем временском периоду.[61][62][63][64][65][66] Већи број студија показао је да су и млађи и старије болесници са шећерном болешћу који нису имали манифестне знаке ДР имале значајно ниже средње вредности гликозилираног хемоглобина у односу на вредности које су имали пацијенте са ретинопатијом. Пацијенти са вишим вредностима гликозилираног хемоглобина доказано је да имају већи ризик од ретинопатија, тако да су они са средњим нивоима ХбА1ц преко 12% имали 3,2 пута веће шансе за развој ДР након 4 године од особа са нивоима ХбА1ц испод 12%.[67] Код болесника са шећерном болешћу типа 1 на строгој гликорегулацији или конвенционалном лечењу током истраживања у једној студији у периоду од 6,5 година, смањена је инциденција ретинопатије од 76% и рано напредовање болести за 54%. Свако смањење од 10% ХбА1ц (нпр., од 9,0% до 8,1%, односно од 8,0% до 7,2%) довело је до смањења ризика од ДР за 39%.[68] На основу напред наведених и других бројних епидемиолошка и клиничка испитивања доказано је да интензивна терапија и метаболичко одржавање нивоа (близу-нормалних вредности), гликозилираног хемоглобина може имати значајне и дугорочно добре резултате на даљи развој ДР. Значајно је да овај учинак нема праг, и да се дуго и даље одржава након иницијације такве терапије. Међутим, треба нагласити да на ризик од ДР највероватније у великој мери утиче на краћи рок спроведена гликорегулација, као и да постоји кашњење од око 1 ½ до 2 ½ године између метаболичке контроле и мерљивих промене ризика за појаву ретинопатије.[67] ХипертензијаУобичајено стање код пацијената са шећерном болешћу је и хипертензија (повишен крвни притисак >130/80 mm Hg). У једној америчкој студији утврђено је да 17% пацијената са шећерном болешћу типа 1 имало хипертензију, и да се у даљем току истраживања у 25% болесника развила хипертензија након 10 година.[69] Код пацијената са дијабетесном ретинопатијом, чврсто контрола крвног притиска одлаже прогресију болести, а све више доказа указује на то да ренин анготензин систем (РАС) игра важну улогу у регулацији крвног притиска. РАС је ензимска каскада у којој је ангиотензиноген прекурсор ангиотензин пептида. Каскадни процес почиње конверзијом неактивног облика ренина и проренина, до активног ренина.[70] Ренин претвара ангиотензиноген у ангиотензин - 1 (Ang I) који се даље цепа уз помоћ ангиотензин конвертујућег ензима (ACE) до ангиотензина-II (Ang II). Ang II је главни ефекторни пептид РАС, који делује пре свега на два рецептора, типа ангиотензин тип 1 (AT-1) и ангиотензин тип 2 (АТ2). Ang II је познат по томе да изазива системски и локални крвни притисак преко свог ефекта позитивне регулације преко ангиотензин II тип 1 рецептора. Бројни истраживача проучавали су компоненте РАС мрежњаче (Ang I, Ang II, ренин, ACE, AT-1, AT-2) у мрежњачи и установили су повећан ниво проренина, реннина и ангиотензин II у стакластом телу пацијената са ПДР и дијабетесним едемом макуле (ДМЕ), сугеришући тиме учешће РАС у патогенези дијабетесне ретинопатије.[71][72] Ang II је такође један од фактор раста, који промовише диференцијацију, апоптозу и уклањања екстрацелуларног матрикса.[73][74] Ang II потенцира штетан ефекат AGEs индукцијом RAGE експресије код хипертензије у оку јер блокира инхибиторе ACE, што указује на везу између AGE-RAGE и РАС и могуће њихово укључење у патогенезу дијабетесне ретинопатије.[70] АнемијаПрогресивно повећање ризика за развоја пролиферативе дијабетесне ретинопатије код дијабетичара у анемији, повезана је са смањењем хематокрита.[75] У најнижу вредност хематокрита од утицаја на повећани ризик од ДР, за мушкарце и жене у једној америчкој студији била је вредност од 52%. Слични налази су виђени и у студија са пацијенатима на клиници за дијабетес у Финској.[76] Дислипидемија - хиперлипидемијаХиперхолестеролемија као фактор ризика превасходно је заступљена код старијих болесника са типом 2 ДМ, чешће код секундарно инсулин зависних. Иако велики проценат болесника са ретинопатијом има повишене вредности холестерола у крви, у преко 50% случајева није нађена статистички значајна разлика у повишеном нивоу холестерола у болесника са и без ретинопатије. Наиме, болесници без ретинопатије су такође имали високе вредности холестерола, што не искључује утицај повишеног нивоа холестерола на развој ДР.[77] Дијабетесна нефропатија је једна од многобројних компликација шећерне болести и представља водећи појединачни узрок терминалне бубрежне инсуфицијенције. Јавља се код 30-40% болесника са шећерном болести. С обзиром да је дијабетес тип 2 много чешћи, већи број болесника са терминалном бубрежном инсуфицијенцијом чине оболели од овог типа шећерне болести.[78][79] Према неким истраживањима дијабетесна ретинопатија код трудница са шећерном болешћу највероватније је повезана са нижим нивоима активности плазма ренина (ПРА) и алдостерон, натриуретских пептида (АНП) у поређењу са њиховим вредностима код здравих труница. Снижена активност ренин-ангиотензин-система (РАС) може да услови хипердинамичнији проток крви и тиме допринесе прогресији ДР током трудноће у шећерној болести.[80] Теорија о настанку ДРТачан механизам којим шећерна болест изазива ДР остаје и даље нејасан, али неколико теорија покушава да објасни типичан ток и историју болести: Хормон растаХормон раста највероватније има узрочну улогу у развоју и прогресији дијабетесне ретинопатије. Истраживањем у дијабетесној ретинопатији утврђене су значајне реверзибилне промене код жена које су имале у току порођаја хеморагијску некрозу хипофизе (Шеханов синдром). То је довело до контроверзне примене у пракси, методе аблације хипофизе за лечење или превенцију дијабетесне ретинопатије. Од 1950. години ова техника је напуштен због бројних системских компликација и открића ефикасног ласерског третмана. Алдоза, редуктазе и вазопролиферативни факториУ основи шећерне болести поремећај је метаболизма глукозе као резултат смањених нивоа или активности инсулина. Повећани ниво глукозе у крви има структурни и физиолошки учинак на капиларе мрежњаче, изазивајући у њима бројне патолошке процесе који их чине функционално и анатомски некомпетентним. Упорни пораст нивоа глукозе у крви и његов вишак регулише метаболизам редуктазе и алдозе у одређеним ткивима, које конвертују шећер у алкохол (нпр., глукозу у сорбитол, галактозу у дулцитол). Унутарзидни перицити капилара мрежњаче највероватније су под утицајем повећаног нивоа сорбитола, што на крају доводи до губитка њихове примарне функције (тј, ауторегулационе функције капилара мрежњаче), што доводи до слабости и пропустљивости капиларних зидова. Повећана пропустљивост ових крвних судова резултати изласком течности и протеинских материјала, које се нагомилавају и клинички манифестују као задебљање и ексудат. Ако оток и ексудација захвате макулу, настаје смањење функције централног вида. Руптура микроанеуризматских промена насталих на измењеним крвним судовима рутине резултује крварењем у мрежњачи, површним (крварење у облику „пламена“) или у дубљим слојевима мрежњаче (блот и дот крварења). Применом наилфолд видео капилароскопије, откривена је висока преваленца капиларних промена код пацијената са шећерном болешћу, посебно код оних са оштећењем мрежњаче, што је у суштини одраз општег учешће микроваскуларних промена у оба типа, 1 и 2 шећерне болести.[5] Тромбоцити и вискозност крвиРазноврсност хематолошких абнормалности које се могу видети у шећерној болести; повећана агрегације и смањена савитљивост црвених крвних зрнаца, повећана агрегација и адхезија тромбоцита итд, само су неки од предиспонирајућих фактора који успоравањем протока крви и кисеоника, оштећују ендотел мрежњаче, и изазивају жаришну капиларну оклузију. Наведене промене заправо узрокују исхемију мрежњаче, која, последично, доприноси развоју дијабетесне ретинопатије. Едем макулеСа дужином трајања шећерне болести прогресивно расте и појава дијабетесне ретинопатије. Промене у макули односно клинички заначајан макуларни едем је један од најчешћих разлога смањења односно губика видне функције код пацијената са дијабетесном ретинопатијом. Код инсулин зависне шећерне болести, након 25 година болести, макуларни едем се јавља код 20% оболелих, а код инсулин независне шећерне болести, код 15% случајеве за исти период. Код болесника са диајбетесном ретинопатијом присутном најмање 10 година, клинички значајан едем макуле присутан је у просеку код 14% случајева. Едем макуле се може јавити самостално и бити једина манифестација шећерне болести или се може јавити у склопу осталих промена дијабетесне ретинопатије. Едем макуле је најчешћи узрок губитка вида код болесника са непролиферативном дијабетесном ретинопатијом (НПДР). Међутим, едем макуле не види се искључиво или само у пацијената са НПДР, јер се као компликација може јавити и у случајевима пролиферативне дијабетесне ретинопатија. Код дијагнозе благе непролиферативне ретинопатије, едем је присутан у 3% болесника. Код 38% болесника придружен је дијагнози умерене непролиферативне ретинопатије а чак 78% код пролиферативне ретинопатије.[81] Како тачан механизам настанка едема макуле није познат, постоје бројне теорије од којих се једна покушава да објасни развој едема макуле заснива, на повећаним нивоима диацилглицерола створеног из вишка глукозе. Сматра се да њу активира протеин киназа Ц, која, заузврат, утиче на динамику кретања крви кроз мрежњачу, посебно на пропустљивост и проток, што доводи до истицања течности и задебљање мрежњаче. Поред повећање пропустљивости, постоји и поремећај у ауторегулација крвног протока, задебљање базалне мембране и леукостаза су основне каратеристике крвних судова ретине у ДР. Резултати ових промена имају за последице оклузију капилара, поремећај ретиналне перфузије и следствено, доводи до исхемије мрежњаче. На овај начин настала исхемија доводи до настанка едема и макулопатије, а уједно је и главни стимуланс патолошке неоваскуларизације. ХипоксијаКако болест, хипоксија мрежњаче настаје због, могућег зачепљења капилар мрежњаче. Обимнија ретинална хипоксија изазива компензаторне механизме у очима, како обезбедила довољно кисеоника у ткивима. Микроваскуларни поремећаји мрежњаче, праћени хипоксијом представљају битан фактор ангиогенезе, или стварања нових крвних судова из већ постојећих ендотелних ћелија, пролиферацијом ћелија у оквиру ткива мрежњаче, који су неефикасни јер се понашају као шантови са неперфузионим подручјима (види слику испод).[82] НеоваскуларизацијаКонтинуирано и дуготрајно трајање и непрестано увећање исхемије мрежњаче у шећерној болести покреће производњу вазопролиферативних фактора који стимулишу формирање (неоангиогенезу) нових крвних судова.[83] Екстрацелуларни матрикс крвних судова прво разара протеаза, а нови капилари који произилазе углавном из венула мрежњаче, продиру у њену унутрашњу мембрану и формирају капиларну мрежу између унутрашње површине мрежњаче и њеног задњег хијалоидног дела.[84] Најновијим истраживањима утврђено је да код болесника са пролиферативном дијабетесном ретинопатијом (ПДР), ноћна, интермитентна хипоксија/реоксигенација, која настаје у сну због поремећаја дисања може бити један од фактор ризика за дужичну и/или угаону неоваскуларизацију.[85] Неоваскуларизација је најизраженија на граници перфузије и неперфузије мрежњаче најчешће се јавља дуж васкуларног лука и на главном оптичком нерву. Новостворени крвни судови пробијају и расту дуж површине мрежњаче у склеру и задњи хијалоидни део. Сами по себи, ови крвни судови ретко изазвају видне испаде, али су због крхкости веома попустљиви и лако се могу прекинути у стакластом телу, што може довести до крварења у шупљину стакластог тела или преретинални простор.[83][86] Неоваскуларизацијом створени нови и умножени крвни судови у почетку су повезани малом количином фиброглијалне супстанце у формираном фибробластном ткиву. Међутим, како се густина неоваскуларизованог дела повећава, тако расте и ниво влакнастог обликовања ткива.[87] У каснијим фазама шећерне болести, умножавање (неоваскуларизација) крвних судова мрежњаче може назадовати, остављајући за собом само мрежу фиброваскуларног ткива у слојевима мрежњаче и задњем хијалоидном слоју.[83] У стакластом телу ово новостворено фибробластно ткиво може да врши, тракционим силама, повлачење мрежњаче преко фиброглијалних веза. Проклизавање може изазвати едем мрежњаче, хетеротропију мрежњаче и обострано тракционо одигнуће (одлубљивање) мрежњаче од пигментног епитета.[88] ПатофизиологијаТачни механизми настанка дијабетесне ретинопатије још увек нису довољно истражени. И поред неколико биохемијских теорија које су до сада објављене, још увек се не могу у потпуности прихватити механизами изнети у њима, нити је пронађена у потпуности ефикасан начин лечења.[89] Оно што је доказано, улога је хроничне хипергликемије заједно са хиперлипидемијом и хипертензијом, што доприноси настанку дијабетесне ретинопатије.[90][91] Како дијабетесна ретинопатија подразумева промене у васкуларним и нервним елементима још у раним фазама шећерне болести, спречавање губитка вида код ових болесника зависи од бољег разумевања основних механизама и измењених односа између неурона и крвних судова мрежњаче. У том циљу у офталмологији су предузети многи кораци у изучавању патогенезе дијабетесне ретинопатије. Зато ће у даљем тексту бити приказани само они механизми који су до сада изучени. Главна карактеристика развоја ране дијабетесне ретинопатије су промена у структури и ћелијској композицији микроваскулатуре мрежњаче (што је шематизовано приказано на слици десно). Повећање пропустљивости, поремећај у ауторегулацији крвног протока, задебљање базалне мембране и леукостаза основне су каратеристике стања крвних судова мрежњаче у дијабетесној ретинопатији.[92][93] Ове промене у капиларној мрежи мрежњаче имају за последицу сужења, све до оклузије, поремећај перфузије и пратећу, исхемију мрежњаче.[94] Ћелијски и молекуларни механизам дијабетесне ретинопатијеГлавни и кључних механизами укључени у патофизиологију дијабетесне ретинопатије су:[1]
Пут полиола У шећерној болести пут полиола (сорбитол-алдоза редуктаза пут), постаје активан дејством високих нивоа глукозе у хипергликемији, што резултује индукцијом алдоза редуктазе и продукцијом сорбитола. Пут полиола, заправо је један од метаболичких процеса који вишак глукозе разлаже на сорбитол који се затим конвертује у фруктозу. Бројне студија су показале да се ниво глукозе, који се у енормно високим концентрацијама појављује у шећерној болести, пре свега, метаболише преко пута полиола који може довести до вишка сорбитола и мањка глутатиона. који настаје због смањене активности глутатион редуктазе услед недостатка никотин амид аденин динуклеотид фосфата (NADPH) који се интензивно троши у полиол путу глукозе. То последично резултује разним васкуларним компликацијама у мрежњачи због ограниченог растезања глатких мишићних ћелија, услед губитака васкуларних перицита и задебљање базалне мембране.[96] Цео механизам пута полиола постаје активан након што висок унутарћелијски ниво глукозе заситити нормалане путеве у метаболизму глукозе, тако да преостала глукоза након подмирења свих потребних метаболичких процеса у организму, остаје у вишку. Тако створени вишак глукозе, може доспети у до тада неактиван алдоза редуктаза пут или пут полиола. На том пут алдоза редуктаза претвара глукозу у сорбитол користећи у том процесу никотин амид аденин динуклеотид фосфат (NADPH) као кофактор. Сорбитол се у том процесу даље оксидира до фруктозе преко сорбитол дехидрогеназе са NAD(+) као кофактором. Као што видимо NADPH је неопходан за активност алдоза редуктазе. Стога, интезивирање пута полиола доводи до повећане потрошње NADPH.[97] Антиоксидативни ензими као што су глутатион редуктазе која регенерише редуковани глутатион такође захтева NADРН. У складу са овим променама, повећан је утрошак овог кофактора што доводи до ниже активности глутатион редуктазе, што умањује интрацелуларну концентрацију редукованог глутатиона, доводи до редокс-неравнотеже и индукције окидантивни стрес.[98][99][100] Такође и хиперпродукција NADPH и повећање односа са NADH/NAD доводи до променеа у саставу ензима и доприносе формирању реактивних метаболита који могу довести до ћелијске дисфункције и оштећења, које накнадно могу изазвати дисфункцију и евентуалне губитке перицита,[101][102][103][104][105] и задебљања базалне мембране.[в][106] AGEsАГЕ (крајњи производи гликације) формирају се неензимском кондензационом реакцијом (неензимском гликацијом) између редукције глукози и унутарћелијских и екстраћелијских протеине и липида или нуклеинске киселине кроз низ сложених реакције које дају неповратну унакрсно повезану комплексну групу једињења названу AGEs (енгл. Аdvanced glycation end products). Развој процеса старења у директној је вези са количином и трајањем хипергликемије. Блага повећања концентрација глукозе, показала су истраживања, дају велико повећања нивоа и доводе до акумулације крајњих производа напредне гликације (AGE).[107] AGEs функционално мења матрицу базалне мембране укључујући ту и промене типа IV колагена и ламинина. AGEs у интеракцији са типом IV колагена инхибира бочно спајање ових молекула у структуру мреже базалне мембране. Ефекти ламинина укључују и смањење везивања за тип IV колагена и смањена самомоуградње.[108] Измене на компонентама матрикса мрежњаче одговарне су за ткивна задебљање у доњем делу мембране код болесника са шећерном болешћу. AGEs заправо мења ћелијску функцију тако што се везивањем за рецепторе за гликозилацију крајњих производа (RAGEs).[109][110]  Везивањеm AGE на специфичним рецепторима ендотелних ћелије повећавају коагулациони фактори (фактор IX and X),[110] а смањују антикоагулациони фактори (тромбомодулини),[110] и индуковани вазоконстриктивни фактор (ендотелин-1),[111] који може довести до вазоконстрикције и тромбозе у окружењу AGEs. AGEs, такође може да промени и структуру ДНК нуклеарних протеина ћелија нензимском модификацијом какоја може да резултује измењеном експресијом гена.[112] AGEs повећа и екстралуминалну акумулацију плазма протеина, укључујући и липопротеине ниске густине након хемијског везивања са реактивним АГЕ прекурсорима матрикса протеина.[113][114] Зато су AGEs и промене изазване AGEs, предложен као одговоран чинилац за настанак патолошких промена које се могу видети у дијабетесној ретинопатији.[115] Протеин киназа C (PKC)Протеин киназа C (PKC) је породица од око 13 изоформи које су широко распростањене у различитим ткивима сисара. У хипергликемијском стању, неке изоформе PKC су првенствено производ новонастале, побољшане синтезе диацилглицерола (DAG) од глукозе до глицерол 3 - фосфата, који делују као активатор за различите изоформе PKC, из породице серин/треонин киназа, које поседују јединствену функцију.[116] Активности класичне изоформе (PKC-α, β-1/2, и PKC-δ) у великој мери су побољшана форма диацилглицерола (DAG) које су повезане са васкуларнин поремеђајима у патогенези ДР.[117] Протеин киназа C (PKC) и диацилглицерол (DAG) су унутарћелијске сигналне молекуле које су након активације одговорне за појаву примарне микроваскуларне исхемија, ексудације и ангиогенезе у ДР. Неке од промена услед активирања протеин киназе C (PKC) укључују: повећање протока крви, задебљања базалне мембране, експанзију екстрацелуларног матрикса, васкуларну пропустљивост, ангиогенезу, апоптозу, слепљивање (адхезију) леукоцита и активацију цитокина.[118][119] Повећана активност протеин киназе C (PKC) и диацилглицерола (DAG) утврђена је на животињском моделу са шећерном болешћу,[120] у коме је активирана PKC могла довести до васкуларног оштећења и повећане експресије фактор раста, који су предложени као фактори патолошких промена које се развијају у дијабетесној ретинопатији.[121][122][123] Повећан ниво слободних радикалаСтање хипергликемије која влада у шећерној болести, делује као оксидативни стрес, а овај преко оксидативне фосфорилација и аутооксидације глукозе повећава ниво слободних радикала у организму. Тако створене реактивне врсте кисеоника, настале као резултат дејства оксидативног стреса, имају утицај на развој неких од манифестација у дијабетесној ретинопатији, због оштећења у структури ДНК молекула ћелија мрежњаче. Зато је одржавање правилног редокс баланса ћелија (редукција — оксидација) од пресудне важности, за нормални рад ћелија, у шећерној болести, која обухвата ћелијску варијабилност, сигнализацију, активацију и пролиферацију.[124] [125][126][127][128] На основу напред изетих метаболичким промена и описаних промене у експресији гена и функције протеина може се закључити да су оне одговорне за бројне манифестације ћелијских дисфункција и пратећих васкуларних промена које се јављају у шећерној болести. Иако је релативна улога различите путеви недовољно јасна, са сигурношћу се може тврдити да је комбиновано или интерактивно дејством свих чинилаца и свих наведених путева одговорно за настанаак промена које се могу видети у дијабетесној ретинопатији.  Уместо закључка се може рећи, да дуготрајна (вишегодишња) хипергликемија резултује дугоготрајном вишегодишњом исхемијом која у шећерној болести може довести до метаболичког дисбаланса у ћелијама мрежњаче и активирања васкуларног ендотелног фактор раста (енгл. vaskular endothelial growth factor VEGF), који индукујући пролиферацију ендотелних ћелија мрежњаче, повећава пропустљивост крвних судова и инхибише апоптозу.[129] Овим механизмом исхемија доводи до настанка едема мрежњаче и макулопатије, а уједно је и главни стимуланс патолошке неоваскуларизације.[130][131] Макула као специфични анатомски и функционални предео мрежњаче од посебног је значаја у дијабетесној ретинопатији. Промене у макули односно макуларни едем један је од најчешћих разлога смањења и губитка видне оштрине у шећерној болести. Формирање едема и накупљање течности у макуларном пределу доводи до повећања волумена овог простора. Рефрактивни статус ока се помера ка хиперметропији, а структуралне промене у овој регији доводе до поремећаја у детекцији и трансформацији светлосног зрака у електричне импулсе. На тај начин видна оштрина ока се све више смањује. Фазе у развоју ДРДијабетесна ретинопатија је прогресивна болест која у свом еволутивном току пролази кроз неколико стадијума. Непролиферативна дијабетесна ретинопатија (НДР)Овај стадијум ДР је најранији и у овој фази болести, особе не морају имати сметње вида, а ако их имају, оне су последица макуларног едема (макула је тачка у централном делу мрежњаче одговорна за оштрину вида). Она настаје као последица промена у којима крвни судови постају пропустљивије, па крв излази у околно ткиво - видљива су ситна, тачкаста крварења. Макуларне едем је оток у подручју макуле који настаје због цурења течности и крви из крвних судова тога подручја. Сметње вида у овом стадијуму болести одликују се у смањењу оштрине вида, или искривљењу слике, а могућ је и поремећај у перцепцији боја. Пролиферативна дијабетесна ретинопатија (ПДР)Овај стадијум ДР је узнапредовала фаза болести која се јавља због смањеног допремања кисеоника у мрежњачу. Као последица овоаквог стања, крвни судови почињу ненормално да расту, како би се задовољила потреба мрежњаче за кисеоником. Овако створени, нови крвни судови, лошијег су квалитета и лако пуцају. Може доћи до крварења у стакласто тело ока (бистра желатинозна маса која испуњава очну јабучицу) што има за пшоследицу замагљени вид и бљескање пред очима. Како болест напредује, изражајније је измењено умножавање крвних судова и стварање ожиљака који се пружају до мрежњаче и повлаче је, што може бити узрок аблације (одлубљивања) мрежњаче са значајним, наглим слабљењем вида. Секундарни глаукомУнутарочни (интраокуларни) притисак (ИОП) је резулатат динамичке равнотеже стварања и одвода очне водице. Условљен је хомеостатским процесима регулисаним односом између продукције и елиминације очне водице. Иста количина од око 2,2-2,5 микролитра колико се продукује у оку у минути бива елиминисана у истом временском интервалу. И продукција и елиминација имају могућности повећања односно смањења у циљу одржавања константног ИОП-а. Нормалан унутарочн притисак креће се у распону од 10 mmHg - 22 mmHg (просечно 16 mmHg).[132] Секундарни глауком (повећање очног притиска) јавља се као једна од могућих микроваскуларних компликација код ДР, најчешће са аблацијом мрежњаче у последњем стадијуму дијабетесне ретинопатије. Узрок су новонастали крвни судови у ДР који узрокују отежано отицање очне водице и повећање унутарочног притиска, што у крајњем исходу доводи до атрофију очног живца и потпуни губитак вида. У зависности од степен оштећња крвних судова и накупљање очне воде и ћелијских метаболита у екстрацелуларном матриксу даје карактеристичан офталмоскопски изглед ока у секундарном глаукому код ДР.[133] КатарактаПромена на очном сочиву у смислу (катаракте), скраме или очне мрене још једна је компликација у ДР. Наиме, у бројним студијама примећено је да се код болесника са шећерном болешћу катаракта лакше и чешће развијаја.
Клиничка слика
Дијагноза
Тестови за рано откривање ДР (офталмолошки скрининг)
Диференцијална дијагноза
ТерапијаЛечење шећерне болести је примарно у превенцији ДР и постиже се регулацијом хипергликемије, дијетом, пероралним антидиајбетицима/ или инсулином. Уз то, је веома битно третирати додатне факор који доприносе развоју ДР; артеријску хипертензију, хиперлипопротеинемију, бубрежну дисфункцију, анемију, гојазност, пропагирати умерену физичку активност, избегавање пушења и стрес. Лечење већ присутне ДР спроводи се путем благовремене ласер терапије и у новије време фармаколошком употребом лекова интравитреално и оперативним решавањем поодмаклих случајева. Као најважнији чинилац у евалуацији и терапији болесника са ДР у шећерној болести јавља се офталмолог, са својим методама лечења. Иако офталмолог има кључну улогу, он мора да буде и координатор између пацијента и медицинског тима који примарно негује и лечи болесника са шећерном болешћу, укључујући ендокринолога, лекара основне здравствене заштите, интернисту и/или друго медицинско особља. У овом сложеном процесу офталмолог треба заједно са тимом да предложи и оптималну контролу метаболизма, која ће значајно да утиче на ток болести код болесника са ДР и шећерном болешћу. Добро образован тим лекара и остварена добра сарадње тима са болесником, важан је корак у терапији ДР, који је најчешће довољна да доведе до повољне резолуције промена у оку. При томе треба имати у виду да има и изузетака, што свакако не зависи од организације лечења, већ од резултата лечења исказаних кроз нивое терапијом остварене гликемије, хипертензије и липида у крви, што је најчешће од пресудног значаја за почети успех лечења. На крају може се рећи да успех лечења ДР од стране офталмолога у великој мери зависи од остварене метаболичке контроле и њеног утицаја на око. Опште мереТерапију ДР, у сваког пацијента треба да прате и опште мере лечења шећерне болести, које обухватају три основна облика:
Терапија поремећаја гликорегулације има за циљ, дефинисање и постизање дефинисати индивидуалних циљних вредности гликемије и HbA1c у складу са следећим критеријумима,
Непобитно је доказано, да је интензивна регулација хипергликемије, на ниво као што је то наведено у табели (HbA1c <7.0), повезана са смањен стопе развој и напредовање ретинопатију у тип 1 шећерне болести. Такође, у великој Британској студије шећерна болести, спроведаана интензивна контрола глукозе у крви (смањен HbA1c на 7,0%) у типуа 2 шећерне болести довело је до смањења ризика до 25% од микроваскуларних промена на крајњим тачакам, на основу чијег стања се одређује потребна за ласерфотокоагулацију мрежњаче. Подаци из ових студија послужили су као основа за израду препоруке, да је за успешно лешење ДР потребна интензивна контроле гликемије, са нивоом HbA1c испод 7%, како би се смањио ризик и напредовање ретинопатија, чиме се може постићи очување вида код особа са шећерном болешћу.[135]
Опсервационе студије су такође показале да су повишени нивои серумских липида директно повезани са тежином тврдих ексудата мрежњаче и смањене оштрине вида. Да су триглицериди повезани са тежим облицима ретинопатије, а да је висока густина и ниво ЛДЛ холестерола обрнуто пропорционалн, наводе неке од референцираних студија. Зато се снижавање нивоа липида, препоручују као обавезно у терапији ДР, како би се спречиле кардиоваскуларне болести, које прати и хипертензија као важан узрок губитка вида.[136][137][138]
Контрола хипертензије је од суштинског значаја у терапији дијабетесне ретинопатије и обавезно се препоручује сарадња са интернистом. Да поред гликорегулације, контрола крвног притиска игра важну улогу у дијабетсној ретинопатији показале су спроведене студије, у којима је правилно спроведена контрола крвног притисака директно била повезана са смањеним ризиком од прогресије ретинопатије.[139] То показују резултати из тих студија у којима се наводи смањењење од 37% микроваскуларних болести.[140] Офталмолошка терапија ДРПостоје три начина лечења дијабетесне ретинопатије која су врло успешна у спречавању губитка вида узрокованог овом болешћу. Заправо 90% људи са узнапредовалом дијабетичком ретинопатијом имају шансу спасити вид ако се терапијом отпочну пре него мрежњача буде трајно оштећена. Та три начина лечења су: ласерфотокоагулација, витректомија, убризгавање триамцинолона у око. Постојање ретинопатије није контраиндиација за кардиопротективно терапију аспирином, с обзиром да таква терапија не повећава ризик за настанак ретиналне хеморагије. Ласерфотокоагулација За сада, једини терапијски поступак који се показао ефикасним у лечењу дијабетесне ретинопатије је ласерфотокоагулација очног дна, под условом да је пре тога постигнута задовољавајућа метаболичка контрола шећерне болести.[143] Терапија се спроводи уз примену локалне анестезије, како би у току апликације померања главе пацијент била могућа. Значај
Индикације Ласерфотокоагулациона терапија је индикована код болесника са пролиферативне дијабетесне ретинопатије (ПДР), клинички значајним макуларне едемом и у неким случајевима тешке непролиферативне дијабетесне ретинопатије (НПДР) у циљу смањења ризика губитка вида. Ласерфококооагулацију треба применити и код свих болесникаа са шећерном болешћу и неоваскуларизацијом у пределу дискуса или ириса и крварења у корпус витреуму. Модификована енгл. ETD RS grid laser фотокоагулација користи се код пацијената са клинички значајним макуларним едемом у одсуству значајне макуларне исхемије. Нежењени ефекти Нежељени ефекти ласерфококооагулације могу бити
Врсте ласерфотокоагулацијеЛасерфотокоагулациона терапија, која се данас примењује у пракси, у зависности од индикација може бити,[144] Панретинална фотокоагулација Панретинална фотокоагулација, се примењује се код пролиферативне ретинопатије и у основи смањује учесталост појаве глаукома спречавајући настанак неоваскуларног глаукома.
Усмерена (фокална) или мрежаста фотокоагулација Усмерена (фокална) или мрежаста фотокоагулација, примењује се код макуларног едема.
Бројне студије потврдиле су изузетно повољене резултата примене панретиналне ласерфотокоагулације код пролиферативних ретинопатија док је фокална фотокоагулација смањила у значајној мери губитак видне оштрине као поледице макуларног едема.[142] Витректомија Витректомија једна је од метода витреоретинална хирургије кој обухвата процедуре које се раде на унутрашњим структурама ока, у овом случају, стакластом телу. Стакласта тело или витреум је желатинозна провидна структура која се налази иза сочива а испред мрежњаче ока. Индикације Витректомију треба применити у болесника са типом 1 шећерне болести и перзистентним крварењем у корпус витреуму. Витректомију би требало урадити и код болесника са тракционим одлубљивањем мрежњаче које угрожава макулу а требало би размотрити примену ове методе и код пацијената са фиброваскуларном пролиферацијом. Уколико је индикација била одлубљивање мрежњаче као последица постојања фиброваксуларних мембрана код пролиферативне дијабетесне ретинопатије, уклањањем тих мембрана и тампонадом силиконским уљем мрежњача се враћа на њено место и смањује могућност за њено поновно одлубљивање. Код болесника са типом 2 шећерне болести и крварењем у корпус витреуму које је тешко и онемогућава фотокоагулацију, обавезно треба размотрити примену витректомије. Уколико је индикација за витректомију било крварење у стакластом телу, уклањањем стакластог тела и присутне крви поново се омогућава пролазак светлости кроз унутрашњост ока до мрежњаче. Екстракција катаракте код пацијената са шећерном болешћу Операцију катаракте не би требало одлагати код пацијената са шећерном болешћу. Зато се она препоручује када се не може искључити постојање ретинопатије која угрожава вид. Када се планира екстракција катаракте у склопу постојања узнапредовале болести, која се није стабилизовала пре операције треба поразговарати са болесником о могућуој прогресији болести и потреби за постоперативним праћењем. Интравитреална фармакотерапија ДРТренутно, се неколико лекова користи у лечењу дијабетесне ретинопатије. Ови лекови се ординирају у око интравитреалним убрузгавањем, по чему је ова врста лечења и добила назив, интравитреална фармако терапија дијабетесне ретинопатије. Ова врста фармакотерапије за сада се користи само као додатак у лечењу традиционалном ласерском фотокоагулацијом дијабетесне ретинопатије. Да је оправдана комбинована примена неких од интравитреалних лекова са фокалном ласерском терапијом потврдила су клиничка испитивања у једној студији (енгл. Diabetic Retinopathy Clinical Research Network (DRCR.net)), која је показала одређену ефикасност, коју даљим истраживањима треба пратити.[145][146] Код пацијената са дугогодишњим едемом макуле која не реагује на конвенционалне начине лечења, као што је фокална или мрежаста ласерска фотокоагулација, примена интравитреално убризганог триамцинолон може се сматрати оправданом. Такође чекају се и резултати опесжнијих студија у примени бевацизумаба (Avastin) и ранибизумаба (Lucentis) у лечењу дијабетесног едема макуле.[147] Триамцинолон (Тriamcinolone) Интравитреални триамцинолон је један од најчешће коришћених препарата у лечењу дијабетесног едема макуле.[148] Недавна клиничка испитивања (енгл. Diabetic Retinopathy Clinical Research Network (DRCR.net)) показала су код неких болесника смањење едема макуле после интравитреалне примене триамцинолона, мада овај учинак није био тако изражен, као учинак који се постиже фокалним ласерским третманом у трајању од две године.[145] Поред тога, интравитреална примена триамцинолон може имати неке негативне ефекте, укључујући стероиди одговор праћен увећањем очног притиска,[149][150][151] инфективним (бактеријски ендоофтелмитис) и незаразним ендофталмитисом и катарактом.[152][153][154] Бевацизумаб (Avastin) и ранибизумабом (Lucentis) Други лекови који се користе у клиничкој пракси и у клиничким испитивањима укључују интравитреалне бевацизумаб и ранибизумабом (Lucentis).[155] Ови лекови су VEGF антитела и фрагменти антитела. Они могу помоћи у смањењу дијабетесног едема макуле (жуте мрље) и васкулогенезе диска или мрежњаче. Међутим, резултати и побољшању функције вида су мање импресиван. Да ли је то због трајног оштећење фоторецептора у време убризгавања лека у случајевима где је он примењени или се ради о рефрактарним случајевима даљим истраживањима треба да се утврди.[156] Мере превенцијеМере превенције дијабетесне ретинопатије у принципу се заснивају на строгој регулацији инсулина и и свих других поремећаја у шећерној болести и обахватају: Редовно узимање лекове према упутству лекара Коришћење инсулина, ако је то потребно Правилна регулација нивоа шећера у крви и крвног притиска
Телесно вежбање
Редовно лабораторијско испитивање
Редовне здравствене контроле
Редовни офталмолошки прегледи
Прогноза
Напомене
Референце
Литература
Спољашње везе
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia























