–ö–∞–ª–∏—ò—É–º–æ–≤–∏ –∫–∞–Ω–∞–ª–∏ Potassium channel Kv1.2, structure in a membrane-like environment. –ö–∞–ª–∏—ò—É–º—Å–∫–∏ –∫–∞–Ω–∞–ª –ö–≤1.2, —á–∏—ò–∞ —ò–µ —Å—Ç—Ä—É–∫—Ç—É—Ä–∞ —É –æ–∫—Ä—É–∂–µ—ö—É –Ω–∞–ª–∏–∫ –º–µ–º–±—Ä–∞–Ω–∏. –ö–∞–ª–∏—ò—É–º–æ–≤–∏ –∫–∞–Ω–∞–ª–∏ —Å—É –Ω–∞—ò—Ä–∞–∑–Ω–æ–≤—Ä—Å–Ω–∏—ò–∞ –≥—Ä—É–ø–∞ —ò–æ–Ω—Å–∫–∏—Ö –∫–∞–Ω–∞–ª–∞, –∫–æ—ò–∏ —Å–µ –Ω–∞–ª–∞–∑–∏ —É –≥–æ—Ç–æ–≤–æ —Å–≤–∏–º –æ—Ä–≥–∞–Ω–∏–∑–º–∏–º–∞.[ 1] [ 2] [ 3]
–ö–∞–ª–∏—ò—É–º–æ–≤–∏ (–ö + ) –∫–∞–Ω–∞–ª–∏ —Å–µ –Ω–∞–ª–∞–∑–µ —É —õ–µ–ª–∏—ò—Å–∫–∏–º –º–µ–º–±—Ä–∞–Ω–∞–º–∞ –∏ –∫–æ–Ω—Ç—Ä–æ–ª–∏—à—É —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç –ö + —ò–æ–Ω–∞ –∏–∑ –∏ –∏ —É —õ–µ–ª–∏—ò–µ. –û–Ω–∏ –∏–≥—Ä–∞—ò—É –∫—ô—É—á–Ω—É —É–ª–æ–≥—É —É –µ–∫—Å—Ü–∏—Ç–∞–±–∏–ª–Ω–∏–º –∏ –Ω–µ–µ–∫—Å—Ü–∏—Ç–∞–±–∏–ª–Ω–∏–º —õ–µ–ª–∏—ò–∞–º–∞ –∏ –º–æ–≥—É —Å–µ –Ω–∞—õ–∏ —É –≥–æ—Ç–æ–≤–æ —Å–≤–∏–º –≤—Ä—Å—Ç–∞–º–∞, –æ—Å–∏–º –∫–æ–¥ –Ω–µ–∫–∏—Ö –ø–∞—Ä–∞–∑–∏—Ç–∞.[ 4]
–ö–∞–ª–∏—ò—É–º–æ–≤–∏ –∫–∞–Ω–∞–ª–∏ —Ñ—É–Ω–∫—Ü–∏–æ–Ω–∏—à—É —Ç–∞–∫–æ –¥–∞ –≤–æ–¥–µ –∫–∞–ª–∏—ò—É–º–æ–≤–µ —ò–æ–Ω–µ –Ω–∏–∑ —ö–∏—Ö–æ–≤ –µ–ª–µ–∫—Ç—Ä–æ—Ö–µ–º–∏—ò—Å–∫–∏ –≥—Ä–∞–¥–∏—ò–µ–Ω—Ç, —á–∏–Ω–µ—õ–∏ —Ç–æ –±—Ä–∑–æ (–¥–æ –±—Ä–∑–∏–Ω–µ –¥–∏—Ñ—É–∑–∏—ò–µ –ö+ —ò–æ–Ω–∞ —É –≤–æ–¥–∏) –∏ —Å–µ–ª–µ–∫—Ç–∏–≤–Ω–æ (–∏—Å–∫—ô—É—á—É—ò—É—õ–∏, –ø—Ä–µ —Å–≤–µ–≥–∞, –Ω–∞—Ç—Ä–∏—ò—É–º —É–ø—Ä–∫–æ—Å —Ä–∞–∑–ª–∏—Ü–∏ –∏—Å–ø–æ–¥ –∞–Ω–≥—Å—Ç—Ä–æ–º–∞ —É —ò–æ–Ω—Å–∫–æ–º —Ä–∞–¥–∏—ò—É—Å—É).[ 5]
–î–æ–ø—Ä–∏–Ω–æ—Å–µ—õ–∏ —Ä–µ–≥—É–ª–∞—Ü–∏—ò–∏ —Ç—Ä–∞—ò–∞—ö–∞ —Å—Ä—á–∞–Ω–æ–≥ –∞–∫—Ü–∏–æ–Ω–æ–≥ –ø–æ—Ç–µ–Ω—Ü–∏—ò–∞–ª–∞ —É —Å—Ä—á–∞–Ω–æ–º –º–∏—à–∏—õ—É, –æ—à—Ç–µ—õ–µ—ö–µ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞ –º–æ–∂–µ –∏–∑–∞–∑–≤–∞—Ç–∏ –∞—Ä–∏—Ç–º–∏—ò–µ –æ–ø–∞—Å–Ω–µ –ø–æ –∂–∏–≤–æ—Ç. –ö–∞–ª–∏—ò—É–º–æ–≤–∏ –∫–∞–Ω–∞–ª–∏ —Ç–∞–∫–æ—í–µ –º–æ–≥—É –±–∏—Ç–∏ —É–∫—ô—É—á–µ–Ω–∏ —É –æ–¥—Ä–∂–∞–≤–∞—ö–µ –≤–∞—Å–∫—É–ª–∞—Ä–Ω–æ–≥ —Ç–æ–Ω—É—Å–∞.
–û–Ω–∏ —Ç–∞–∫–æ—í–µ —Ä–µ–≥—É–ª–∏—à—É —õ–µ–ª–∏—ò—Å–∫–µ –ø—Ä–æ—Ü–µ—Å–µ –∫–∞–æ —à—Ç–æ —ò–µ –ª—É—á–µ—ö–µ —Ö–æ—Ä–º–æ–Ω–∞ (–Ω–ø—Ä –æ—Å–ª–æ–±–∞—í–∞—ö–µ –∏–Ω—Å—É–ª–∏–Ω–∞ –∏–∑ –±–µ—Ç–∞ —õ–µ–ª–∏—ò–∞ —É –ø–∞–Ω–∫—Ä–µ–∞—Å—É) —Ç–∞–∫–æ –¥–∞ —ö–∏—Ö–æ–≤–æ –æ—à—Ç–µ—õ–µ—ö–µ –º–æ–∂–µ –¥–æ–≤–µ—Å—Ç–∏ –¥–æ –±–æ–ª–µ—Å—Ç–∏ (–∫–∞–æ —à—Ç–æ —ò–µ –¥–∏—ò–∞–±–µ—Ç–µ—Å).
–ù–µ–∫–∏ —Ç–æ–∫—Å–∏–Ω–∏, –∫–∞–æ —à—Ç–æ —ò–µ –¥–µ–Ω–¥—Ä–æ—Ç–æ–∫—Å–∏–Ω, —Å—É –º–æ—õ–Ω–∏ —ò–µ—Ä –±–ª–æ–∫–∏—Ä–∞—ò—É –∫–∞–ª–∏—ò—É–º–æ–≤–µ –∫–∞–Ω–∞–ª–µ.[ 6]
–ü–æ—Å—Ç–æ—ò–µ —á–µ—Ç–∏—Ä–∏ –≥–ª–∞–≤–Ω–µ –∫–ª–∞—Å–µ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞, —á–∏—ò–µ –∫–∞—Ä–∞–∫—Ç–µ—Ä–∏—Å—Ç–∏–∫–µ —Å—É –ø—Ä–∏–∫–∞–∑–∞–Ω–µ –Ω–∞ –¥–æ—ô–æ—ò —Ç–∞–±–µ–ª–∏.
–ö–ª–∞—Å–µ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞
–ö–ª–∞—Å–∞
–û–ø–∏—Å –∫–∞—Ä–∞–∫—Ç–µ—Ä–∏—Å—Ç–∏–∫–∞
–ö–∞–ª–∏—ò—É–º–æ–≤ –∫–∞–Ω–∞–ª –∞–∫—Ç–∏–≤–∏—Ä–∞–Ω –∫–∞–ª—Ü–∏—ò—É–º–æ–º –û–≤–∞—ò –∫–∞–Ω–∞–ª —Å–µ –æ—Ç–≤–∞—Ä–∞ –∫–∞–æ –æ–¥–≥–æ–≤–æ—Ä –Ω–∞ –ø—Ä–∏—Å—É—Å—Ç–≤–æ —ò–æ–Ω–∞ –∫–∞–ª—Ü–∏—ò—É–º–∞ –∏–ª–∏ –¥—Ä—É–≥–∏—Ö —Å–∏–≥–Ω–∞–ª–Ω–∏—Ö –º–æ–ª–µ–∫—É–ª–∞.
–ö–∞–ª–∏—ò—É–º–æ–≤ –∫–∞–Ω–∞–ª –∫–æ—ò–∏ —Å–µ –∏—Å–ø—Ä–∞–≤—ô–∞ –ø—Ä–µ–º–∞ —É–Ω—É—Ç—Ä–∞ –û–≤–∞—ò –∫–∞–Ω–∞–ª –ª–∞–∫—à–µ –ø—Ä–æ–ª–∞–∑–∏ —Å—Ç—Ä—É—ò—É (–ø–æ–∑–∏—Ç–∏–≤–Ω–æ –Ω–∞–µ–ª–µ–∫—Ç—Ä–∏—Å–∞—ö–µ) —É –ø—Ä–∞–≤—Ü—É –ø—Ä–µ–º–∞ —É–Ω—É—Ç—Ä–∞ (—É —õ–µ–ª–∏—ò—É).
Калијумов канал тандемских пора Ови канали су конститутивно отворени или поседују високу базалну активацију, као што су „канали калијума у мировању“ или „канали за цурење“ који постављају негативни мембрански потенцијал неурона.
–ù–∞–ø–æ–Ω—Å–∫–∏ –≤–æ—í–µ–Ω–∏ –∫–∞–ª–∏—ò—É–º—Å–∫–∏ –∫–∞–Ω–∞–ª–∏ –û–≤–æ —Å—É –Ω–∞–ø–æ–Ω—Å–∫–∏ —ò–æ–Ω—Å–∫–∏ –∫–∞–Ω–∞–ª–∏ –∫–æ—ò–∏ —Å–µ –æ—Ç–≤–∞—Ä–∞—ò—É –∏–ª–∏ –∑–∞—Ç–≤–∞—Ä–∞—ò—É –∫–∞–æ –æ–¥–≥–æ–≤–æ—Ä –Ω–∞ –ø—Ä–æ–º–µ–Ω–µ —Ç—Ä–∞–Ω—Å–º–µ–º–±—Ä–∞–Ω—Å–∫–æ–≥ –Ω–∞–ø–æ–Ω–∞.
–£ –¥–æ—ö–æ—ò —Ç–∞–±–µ–ª–∏ –ø—Ä–∏–∫–∞–∑–∞–Ω–æ —ò–µ –ø–æ—Ä–µ—í–µ—ö–µ –≥–ª–∞–≤–Ω–∏—Ö –∫–ª–∞—Å–∞ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞ —Å–∞ —Ä–µ–ø—Ä–µ–∑–µ–Ω—Ç–∞—Ç–∏–≤–Ω–∏–º –ø—Ä–∏–º–µ—Ä–∏–º–∞ (–∑–∞ –∫–æ–º–ø–ª–µ—Ç–Ω—É –ª–∏—Å—Ç—É –∫–∞–Ω–∞–ª–∞ —É–Ω—É—Ç–∞—Ä —Å–≤–∞–∫–µ –∫–ª–∞—Å–µ, –ø–æ–≥–ª–µ–¥–∞—ò—Ç–µ —Å—Ç—Ä–∞–Ω–∏—Ü–µ –æ–¥–≥–æ–≤–∞—Ä–∞—ò—É—õ–µ –∫–ª–∞—Å–µ).
–§—É–Ω–∫—Ü–∏—ò–∞ –∏ —Ñ–∞—Ä–º–∞–∫–æ–ª–æ–≥–∏—ò–∞ –∫–ª–∞—Å–∞ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞,.[ 7]
–ö–ª–∞—Å–∞
–ü–æ—Ç–∫–ª–∞—Å–∞
–§—É–Ω–∫—Ü–∏—ò–∞
–ë–ª–æ–∫–∞—Ç–æ—Ä–∏
–ê–∫—Ç–∏–≤–∞—Ç–æ—Ä–∏
–ò–Ω—Ö–∏–±–∏—Ü–∏—ò–∞ –∫–∞–æ –æ–¥–≥–æ–≤–æ—Ä –Ω–∞ –ø–æ–≤–µ—õ–∞—ö–µ –∏–Ω—Ç—Ä–∞—Ü–µ–ª—É–ª–∞—Ä–Ω–æ–≥ –∫–∞–ª—Ü–∏—ò—É–º–∞
–£–Ω—É—Ç—Ä–∞—à—ö–∏ –∏—Å–ø—Ä–∞–≤—ô–∞—á–∏
–Ý–µ—Ü–∏–∫–ª–∏—Ä–∞—ö–µ –∏ –ª—É—á–µ—ö–µ –∫–∞–ª–∏—ò—É–º–∞ —É ‚Äã‚Äã–Ω–µ—Ñ—Ä–æ–Ω–∏–º–∞
–ù–µ—Å–µ–ª–µ–∫—Ç–∏–≤–Ω–∏ :
GPCR - —Ä–µ–≥—É–ª–∏—Å–∞–Ω–∏ (Kir 3.x)
–û–Ω–∏ –ø–æ—Å—Ä–µ–¥—É—ò—É —É –∏–Ω—Ö–∏–±–∏—Ç–æ—Ä–Ω–æ–º –µ—Ñ–µ–∫—Ç—É –º–Ω–æ–≥–∏—Ö GPCR-ova
ATP-–æ—Å–µ—Ç—ô–∏–≤–∏ (Kir 6.x)
–ó–∞—Ç–≤–æ—Ä–µ–Ω–∏ –∫–∞–¥–∞ —ò–µ –∞–¥–µ–Ω–æ–∑–∏–Ω-—Ç—Ä–∏—Ñ–æ—Å—Ñ–∞—Ç (ATP) –≤–∏—Å–æ–∫ –¥–∞ –±–∏ —Å–µ –ø–æ—Ç—Å—Ç–∞–∫–ª–æ –ª—É—á–µ—ö–µ –∏–Ω—Å—É–ª–∏–Ω–∞
–î–æ–ø—Ä–∏–Ω–æ—Å–µ –ø–æ—Ç–µ–Ω—Ü–∏—ò–∞–ª—É –º–∏—Ä–æ–≤–∞—ö–∞
–Ý–µ–ø–æ–ª–∞—Ä–∏–∑–∞—Ü–∏—ò–∞ –∞–∫—Ü–∏–æ–Ω–æ–≥ –ø–æ—Ç–µ–Ω—Ü–∏—ò–∞–ª–∞
–û–≥—Ä–∞–Ω–∏—á–∞–≤–∞ —É—á–µ—Å—Ç–∞–ª–æ—Å—Ç –∞–∫—Ü–∏–æ–Ω–æ–≥ –ø–æ—Ç–µ–Ω—Ü–∏—ò–∞–ª–∞ (–ø–æ—Ä–µ–º–µ—õ–∞—ò–∏ –∏–∑–∞–∑–∏–≤–∞—ò—É –∞—Ä–∏—Ç–º–∏—ò—É)
KCNQ (Kv 7)-—Å–ø–µ—Ü–∏—Ñ–∏—á–Ω–∏:
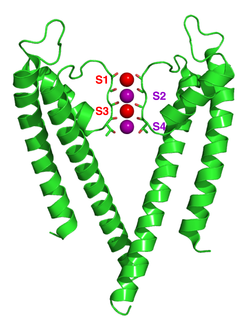
–ü–æ–≥–ª–µ–¥ –æ–¥–æ–∑–≥–æ –Ω–∞ –∫–∞–ª–∏—ò—É–º–æ–≤ –∫–∞–Ω–∞–ª —Å–∞ —ò–æ–Ω–∏–º–∞ –∫–∞–ª–∏—ò—É–º–∞ (—ô—É–±–∏—á–∞—Å—Ç–∏) –∫–æ—ò–∏ —Å–µ –∫—Ä–µ—õ—É –∫—Ä–æ–∑ –ø–æ—Ä–µ (—É —Ü–µ–Ω—Ç—Ä—É). –ö–∞–ª–∏—ò—É–º–æ–≤–∏ –∫–∞–Ω–∞–ª–∏ –∏–º–∞—ò—É —Ç–µ—Ç—Ä–∞–º–µ—Ä–Ω—É —Å—Ç—Ä—É–∫—Ç—É—Ä—É —É –∫–æ—ò–æ—ò —Å–µ —á–µ—Ç–∏—Ä–∏ –∏–¥–µ–Ω—Ç–∏—á–Ω–µ –ø—Ä–æ—Ç–µ–∏–Ω—Å–∫–µ –ø–æ–¥—ò–µ–¥–∏–Ω–∏—Ü–µ –ø–æ–≤–µ–∑—É—ò—É –¥–∞ –±–∏ —Ñ–æ—Ä–º–∏—Ä–∞–ª–µ —á–µ—Ç–≤–æ—Ä–æ—Å—Ç—Ä—É–∫–∏ —Å–∏–º–µ—Ç—Ä–∏—á–Ω–∏ (–¶4) –∫–æ–º–ø–ª–µ–∫—Å —Ä–∞—Å–ø–æ—Ä–µ—í–µ–Ω –æ–∫–æ —Ü–µ–Ω—Ç—Ä–∞–ª–Ω–µ –ø–æ—Ä–µ –∫–æ—ò–µ –ø—Ä–æ–≤–æ–¥–µ —ò–æ–Ω–µ (—Ö–æ–º–æ—Ç–µ—Ç—Ä–∞–º–µ—Ä–∞ ). –ê–ª—Ç–µ—Ä–Ω–∞—Ç–∏–≤–Ω–æ, —á–µ—Ç–∏—Ä–∏ —Å—Ä–æ–¥–Ω–µ, –∞–ª–∏ –Ω–µ –∏–¥–µ–Ω—Ç–∏—á–Ω–µ –ø—Ä–æ—Ç–µ–∏–Ω—Å–∫–µ –ø–æ–¥—ò–µ–¥–∏–Ω–∏—Ü–µ –º–æ–≥—É –¥–∞ —Å–µ —É–¥—Ä—É–∂–µ –¥–∞ —Ñ–æ—Ä–º–∏—Ä–∞—ò—É —Ö–µ—Ç–µ—Ä–æ—Ç–µ—Ç—Ä–∞–º–µ—Ä–Ω–µ –∫–æ–º–ø–ª–µ–∫—Å–µ —Å–∞ –ø—Å–µ—É–¥–æ –¶4 —Å–∏–º–µ—Ç—Ä–∏—ò–æ–º. –°–≤–µ –ø–æ–¥—ò–µ–¥–∏–Ω–∏—Ü–µ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞ –∏–º–∞—ò—É –∫–∞—Ä–∞–∫—Ç–µ—Ä–∏—Å—Ç–∏—á–Ω—É —Å—Ç—Ä—É–∫—Ç—É—Ä—É –ø–æ—Ä–µ-–ø–µ—Ç—ô–µ –∫–æ—ò–∞ –æ–±–ª–∞–∂–µ –≤—Ä—Ö –ø–æ—Ä–∞ –∏ –æ–¥–≥–æ–≤–æ—Ä–Ω–∞ —ò–µ –∑–∞ —Å–µ–ª–µ–∫—Ç–∏–≤–Ω—É –ø—Ä–æ–ø—É—Å—Ç—ô–∏–≤–æ—Å—Ç –∫–∞–ª–∏—ò—É–º–∞.
–ü–æ—Å—Ç–æ—ò–∏ –ø—Ä–µ–∫–æ 80 –≥–µ–Ω–∞ —Å–∏—Å–∞—Ä–∞ –∫–æ—ò–∏ –∫–æ–¥–∏—Ä–∞—ò—É –ø–æ–¥—ò–µ–¥–∏–Ω–∏—Ü–µ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞. –ú–µ—í—É—Ç–∏–º, –∫–∞–ª–∏—ò—É–º–æ–≤–∏ –∫–∞–Ω–∞–ª–∏ –ø—Ä–æ–Ω–∞—í–µ–Ω–∏ —É –±–∞–∫—Ç–µ—Ä–∏—ò–∞–º–∞ —Å—É –º–µ—í—É –Ω–∞—ò–∏—Å—Ç—Ä–∞–∂–µ–Ω–∏—ò–∏–º —ò–æ–Ω—Å–∫–∏–º –∫–∞–Ω–∞–ª–∏–º–∞, —É —Å–º–∏—Å–ª—É —ö–∏—Ö–æ–≤–µ –º–æ–ª–µ–∫—É–ª–∞—Ä–Ω–µ —Å—Ç—Ä—É–∫—Ç—É—Ä–µ. –ö–æ—Ä–∏—Å—Ç–µ—õ–∏ —Ä–µ–Ω–¥–≥–µ–Ω—Å–∫—É –∫—Ä–∏—Å—Ç–∞–ª–æ–≥—Ä–∞—Ñ–∏—ò—É ,[ 50] [ 51] [ 52] –ù–æ–±–µ–ª–æ–≤–∞ –Ω–∞–≥—Ä–∞–¥–∞ –∑–∞ —Ö–µ–º–∏—ò—É 2003. –¥–æ–¥–µ—ô–µ–Ω–∞ —ò–µ –Ý–æ–¥—É –ú–µ–∫–∏–Ω–æ–Ω—É –∑–∞ —ö–µ–≥–æ–≤ –ø–∏–æ–Ω–∏—Ä—Å–∫–∏ —Ä–∞–¥ —É –æ–≤–æ—ò –æ–±–ª–∞—Å—Ç–∏.[ 53]
–ù–∞ –æ–≤–æ—ò —Å–ª–∏—Ü–∏ —Å—É –ø—Ä–∏–∫–∞–∑–∞–Ω–µ —Å–∞–º–æ –¥–≤–µ –æ–¥ —á–µ—Ç–∏—Ä–∏ –ø–æ–¥—ò–µ–¥–∏–Ω–∏—Ü–µ —Ç–µ—Ç—Ä–∞–º–µ—Ä–∞ —Ä–∞–¥–∏ —ò–∞—Å–Ω–æ—õ–µ. –ü—Ä–æ—Ç–µ–∏–Ω —ò–µ –ø—Ä–∏–∫–∞–∑–∞–Ω –∫–∞–æ –∑–µ–ª–µ–Ω–∏ –¥–∏—ò–∞–≥—Ä–∞–º —Ü—Ä—Ç–∞–Ω–æ–≥ —Ñ–∏–ª–º–∞. –ü–æ—Ä–µ–¥ —Ç–æ–≥–∞, –ø—Ä–∏–∫–∞–∑–∞–Ω–µ —Å—É –∫–∞—Ä–±–æ–Ω–∏–ª–Ω–µ –≥—Ä—É–ø–µ –∫–∏—á–º–µ –∏ –ø—Ä–æ—Ç–µ–∏–Ω—Å–∫–∏ –∞—Ç–æ–º–∏ –±–æ—á–Ω–æ–≥ –ª–∞–Ω—Ü–∞ —Ç—Ä–µ–æ–Ω–∏–Ω–∞ (–∫–∏—Å–µ–æ–Ω–∏–∫ = —Ü—Ä–≤–µ–Ω–æ, —É–≥—ô–µ–Ω–∏–∫ = –∑–µ–ª–µ–Ω–æ). –ö–æ–Ω–∞—á–Ω–æ, —ò–æ–Ω–∏ –∫–∞–ª–∏—ò—É–º–∞ (–∫–æ—ò–∏ –∑–∞—É–∑–∏–º–∞—ò—É –º–µ—Å—Ç–∞ –°2 –∏ –°4) –∏ –∞—Ç–æ–º–∏ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –º–æ–ª–µ–∫—É–ª–∞ –≤–æ–¥–µ (–°1 –∏ –°3) —Å—É –ø—Ä–∏–∫–∞–∑–∞–Ω–∏ –∫–∞–æ —ô—É–±–∏—á–∞—Å—Ç–µ –∏ —Ü—Ä–≤–µ–Ω–µ —Å—Ñ–µ—Ä–µ. –ö—Ä–∏—Å—Ç–∞–ª–æ–≥—Ä–∞—Ñ—Å–∫–∞ —Å—Ç—Ä—É–∫—Ç—É—Ä–∞ –±–∞–∫—Ç–µ—Ä–∏—ò—Å–∫–æ–≥ KcsA –∫–∞–ª–∏—ò—É–º–æ–≤–æ–≥ –∫–∞–Ω–∞–ª–∞ (PDB:1K4C‚Äã).[ 54] [ 55] [ 56] [ 57] [ 58]
–ú–µ—Ö–∞–Ω–∏–∑–∞–º —Å–µ–ª–µ–∫—Ç–∏–≤–Ω–æ—Å—Ç–∏ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞ –æ—Å—Ç–∞—ò–µ –ø–æ–¥ –∫–æ–Ω—Ç–∏–Ω—É–∏—Ä–∞–Ω–æ–º –¥–µ–±–∞—Ç–æ–º. –ö–∞—Ä–±–æ–Ω–∏–ª –∫–∏—Å–µ–æ–Ω–∏–∫–∏ —Å—É —ò–∞–∫–æ –µ–ª–µ–∫—Ç—Ä–æ–Ω–µ–≥–∞—Ç–∏–≤–Ω–∏ –∏ –∫–∞—Ç—ò–æ–Ω–∏ –ø—Ä–∏–≤–ª–∞—á–Ω–∏. –§–∏–ª—Ç–µ—Ä –º–æ–∂–µ –¥–∞ –ø—Ä–∏–º–∏ —ò–æ–Ω–µ –∫–∞–ª–∏—ò—É–º–∞ –Ω–∞ 4 –º–µ—Å—Ç–∞ –æ–±–∏—á–Ω–æ –æ–∑–Ω–∞—á–µ–Ω–∞ –æ–¥ –°1 –¥–æ –°4 –ø–æ—á–µ–≤—à–∏ –æ–¥ –≤–∞–Ω—õ–µ–ª–∏—ò—Å–∫–µ —Å—Ç—Ä–∞–Ω–µ. –ü–æ—Ä–µ–¥ —Ç–æ–≥–∞, —ò–µ–¥–∞–Ω —ò–æ–Ω —Å–µ –º–æ–∂–µ –≤–µ–∑–∞—Ç–∏ —É —à—É–ø—ô–∏–Ω–∏ –Ω–∞ –º–µ—Å—Ç—É –∑–≤–∞–Ω–æ–º –°–¶ –∏–ª–∏ —ò–µ–¥–∞–Ω –∏–ª–∏ –≤–∏—à–µ —ò–æ–Ω–∞ –Ω–∞ –µ–∫—Å—Ç—Ä–∞—Ü–µ–ª—É–ª–∞—Ä–Ω–æ—ò —Å—Ç—Ä–∞–Ω–∏ –Ω–∞ –≤–∏—à–µ –∏–ª–∏ –º–∞—ö–µ –¥–æ–±—Ä–æ –¥–µ—Ñ–∏–Ω–∏—Å–∞–Ω–∏–º –º–µ—Å—Ç–∏–º–∞ –∑–≤–∞–Ω–∏–º –°0 –∏–ª–∏ –°–µ–∫—Ç. –ú–æ–≥—É—õ–µ —ò–µ –Ω–µ–∫–æ–ª–∏–∫–æ —Ä–∞–∑–ª–∏—á–∏—Ç–∏—Ö –∑–∞—É–∑–µ—Ç–æ—Å—Ç–∏ –æ–≤–∏—Ö –ª–æ–∫–∞—Ü–∏—ò–∞. –ü–æ—à—Ç–æ —Å—É —Ä–µ–Ω–¥–≥–µ–Ω—Å–∫–µ —Å—Ç—Ä—É–∫—Ç—É—Ä–µ –ø—Ä–æ—Å–µ—á–Ω–µ –≤—Ä–µ–¥–Ω–æ—Å—Ç–∏ –∑–∞ –º–Ω–æ–≥–µ –º–æ–ª–µ–∫—É–ª–µ, –Ω–∏—ò–µ –º–æ–≥—É—õ–µ –∑–∞–∫—ô—É—á–∏—Ç–∏ —Å—Ç–≤–∞—Ä–Ω—É –∑–∞—É–∑–µ—Ç–æ—Å—Ç –¥–∏—Ä–µ–∫—Ç–Ω–æ –∏–∑ —Ç–∞–∫–≤–µ —Å—Ç—Ä—É–∫—Ç—É—Ä–µ. –ì–µ–Ω–µ—Ä–∞–ª–Ω–æ, –ø–æ—Å—Ç–æ—ò–∏ –Ω–µ–¥–æ—Å—Ç–∞—Ç–∞–∫ –∑–±–æ–≥ –µ–ª–µ–∫—Ç—Ä–æ—Å—Ç–∞—Ç–∏—á–∫–æ–≥ –æ–¥–±–∏—ò–∞—ö–∞ –¥–∞ –¥–≤–∞ —Å—É—Å–µ–¥–Ω–∞ –º–µ—Å—Ç–∞ –∑–∞—É–∑–∏–º–∞—ò—É —ò–æ–Ω–∏. –ü—Ä–µ–¥–ª–æ–∑–∏ –∑–∞ –º–µ—Ö–∞–Ω–∏–∑–∞–º —Å–µ–ª–µ–∫—Ç–∏–≤–Ω–æ—Å—Ç–∏ —Å—É –Ω–∞–ø—Ä–∞–≤—ô–µ–Ω–∏ –Ω–∞ –æ—Å–Ω–æ–≤—É —Å–∏–º—É–ª–∞—Ü–∏—ò–∞ –º–æ–ª–µ–∫—É–ª–∞—Ä–Ω–µ –¥–∏–Ω–∞–º–∏–∫–µ, –º–æ–¥–µ–ª–∞ –∏–≥—Ä–∞—á–∞–∫–∞ –≤–µ–∑–∏–≤–∞—ö–∞ —ò–æ–Ω–∞,[ 59] [ 60] [ 61]
–ú–µ—Ö–∞–Ω–∏–∑–∞–º –∑–∞ —Ç—Ä–∞–Ω—Å–ª–æ–∫–∞—Ü–∏—ò—É —ò–æ–Ω–∞ —É –ö—Ü—Å–ê —ò–µ –æ–ø—à–∏—Ä–Ω–æ –ø—Ä–æ—É—á–∞–≤–∞–Ω —Ç–µ–æ—Ä–∏—ò—Å–∫–∏–º –ø—Ä–æ—Ä–∞—á—É–Ω–∏–º–∞ –∏ —Å–∏–º—É–ª–∞—Ü–∏—ò–æ–º.[ 62] ext –∏ S0 , –∫–æ—ò–∞ –æ–¥—Ä–∞–∂–∞–≤–∞—ò—É —ò–æ–Ω–µ –∫–æ—ò–∏ —É–ª–∞–∑–µ –∏ –∏–∑–ª–∞–∑–µ –∏–∑ —Ñ–∏–ª—Ç–µ—Ä–∞, —Ç–∞–∫–æ—í–µ –≤–∞–∂–Ω–∏ –∞–∫—Ç–µ—Ä–∏ —É –ø—Ä–æ–≤–æ–¥—ô–∏–≤–æ—Å—Ç–∏ —ò–æ–Ω–∞.
–û–≤–∞—ò —Ä–µ–≥–∏–æ–Ω –Ω–µ—É—Ç—Ä–∞–ª–∏—à–µ –æ–∫–æ–ª–∏–Ω—É –æ–∫–æ –∫–∞–ª–∏—ò—É–º–æ–≤–æ–≥ —ò–æ–Ω–∞ —Ç–∞–∫–æ –¥–∞ –≥–∞ –Ω–µ –ø—Ä–∏–≤–ª–∞—á–µ –Ω–∏–∫–∞–∫–≤–∞ –Ω–∞–µ–ª–µ–∫—Ç—Ä–∏—Å–∞—ö–∞. –ó–∞—É–∑–≤—Ä–∞—Ç, —Ç–æ —É–±—Ä–∑–∞–≤–∞ —Ä–µ–∞–∫—Ü–∏—ò—É.
–¶–µ–Ω—Ç—Ä–∞–ª–Ω–∞ –ø–æ—Ä–∞, —à–∏—Ä–∏–Ω–µ 10 –ê , –Ω–∞–ª–∞–∑–∏ —Å–µ –±–ª–∏–∑—É —Ü–µ–Ω—Ç—Ä–∞ —Ç—Ä–∞–Ω—Å–º–µ–º–±—Ä–∞–Ω—Å–∫–æ–≥ –∫–∞–Ω–∞–ª–∞, –≥–¥–µ —ò–µ –µ–Ω–µ—Ä–≥–µ—Ç—Å–∫–∞ –±–∞—Ä–∏—ò–µ—Ä–∞ –Ω–∞—ò–≤–∏—à–∞ –∑–∞ –ø–æ–ø—Ä–µ—á–Ω–∏ —ò–æ–Ω –∑–±–æ–≥ —Ö–∏–¥—Ä–æ—Ñ–æ–±–Ω–æ—Å—Ç–∏ –∑–∏–¥–∞ –∫–∞–Ω–∞–ª–∞. –ü–æ—Ä–∞ –∏—Å–ø—É—ö–µ–Ω–∞ –≤–æ–¥–æ–º –∏ –ø–æ–ª–∞—Ä–Ω–∏ –¶-—Ç–µ—Ä–º–∏–Ω–∞–ª —Å–ø–∏—Ä–∞–ª–µ –ø–æ—Ä–∞ –æ–ª–∞–∫—à–∞–≤–∞ –µ–Ω–µ—Ä–≥–µ—Ç—Å–∫—É –±–∞—Ä–∏—ò–µ—Ä—É –∑–∞ —ò–æ–Ω–µ. –°–º–∞—Ç—Ä–∞ —Å–µ –¥–∞ –æ–¥–±–∏—ò–∞—ö–µ –≤–∏—à–∫–∞ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö —ò–æ–Ω–∞ –ø–æ–º–∞–∂–µ –ø—Ä–æ–ø—É—Å–Ω–æ—Å—Ç–∏ —ò–æ–Ω–∞. –ü—Ä–∏—Å—É—Å—Ç–≤–æ –ø–æ—Ä–∞ –º–æ–∂–µ —Å–µ –∏–Ω—Ç—É–∏—Ç–∏–≤–Ω–æ —Å—Ö–≤–∞—Ç–∏—Ç–∏ –∫–∞–æ —ò–µ–¥–∞–Ω –æ–¥ –º–µ—Ö–∞–Ω–∏–∑–∞–º–∞ –∫–∞–Ω–∞–ª–∞ –∑–∞ –ø—Ä–µ–≤–∞–∑–∏–ª–∞–∂–µ—ö–µ –¥–∏–µ–ª–µ–∫—Ç—Ä–∏—á–Ω–µ –±–∞—Ä–∏—ò–µ—Ä–µ, –∏–ª–∏ –æ–¥–±–∏—ò–∞—ö–∞ –æ–¥ —Å—Ç—Ä–∞–Ω–µ –Ω–∏—Å–∫–æ–¥–∏–µ–ª–µ–∫—Ç—Ä–∏—á–Ω–µ –º–µ–º–±—Ä–∞–Ω–µ, –∑–∞–¥—Ä–∂–∞–≤–∞—ö–µ–º –∫–∞–ª–∏—ò—É–º–æ–≤–æ–≥ —ò–æ–Ω–∞ —É –≤–æ–¥–µ–Ω–æ–º –æ–∫—Ä—É–∂–µ—ö—É —Å–∞ –≤–∏—Å–æ–∫–∏–º –¥–∏–µ–ª–µ–∫—Ç—Ä–∏—á–Ω–∏–º –¥–µ—ò—Å—Ç–≤–æ–º.
–ú–æ–¥—É–ª–∞—Ü–∏—ò–µ —Ñ—É–Ω–∫—Ü–∏—ò–µ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞ –º–æ–≥—É –∏–∑–∞–∑–≤–∞—Ç–∏ –µ–Ω–¥–æ–≥–µ–Ω–∏ –ª–∏–≥–∞–Ω–¥–∏ –∏–ª–∏ –ª–µ–∫–æ–≤–∏ –∫–æ—ò–∏ –º–æ–≥—É –±–∏—Ç–∏: –±–ª–æ–∫–∞—Ç–æ—Ä–∏ –∏–ª–∏ –∞–∫—Ç–∏–≤–∞—Ç–æ—Ä–∏ (–æ–¥–Ω–æ—Å–Ω–æ –æ—Ç–≤–∞—Ä–∞—á–∏ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞).[ 15] [ 15]
–ë–ª–æ–∫–∞—Ç–æ—Ä–∏ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞ –∏–Ω—Ö–∏–±–∏—Ä–∞—ò—É –ø—Ä–æ—Ç–æ–∫ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö —ò–æ–Ω–∞ –∫—Ä–æ–∑ –∫–∞–Ω–∞–ª. –û–Ω–∏ —Å–µ –∏–ª–∏ —Ç–∞–∫–º–∏—á–µ —Å–∞ –≤–µ–∑–∏–≤–∞—ö–µ–º –∫–∞–ª–∏—ò—É–º–∞ —É–Ω—É—Ç–∞—Ä —Ñ–∏–ª—Ç–µ—Ä–∞ —Å–µ–ª–µ–∫—Ç–∏–≤–Ω–æ—Å—Ç–∏ –∏–ª–∏ —Å–µ –≤–µ–∑—É—ò—É –∏–∑–≤–∞–Ω —Ñ–∏–ª—Ç–µ—Ä–∞ –¥–∞ –±–∏ –æ–∫–ª—É–¥–∏—Ä–∞–ª–∏ –ø—Ä–æ–≤–æ–¥—ô–∏–≤–æ—Å—Ç —ò–æ–Ω–∞. –ü—Ä–∏–º–µ—Ä —ò–µ–¥–Ω–æ–≥ –æ–¥ –æ–≤–∏—Ö –∫–æ–Ω–∫—É—Ä–µ–Ω–∞—Ç–∞ —Å—É –∫–≤–∞—Ç–µ—Ä–Ω–∞—Ä–Ω–∏ –∞–º–æ–Ω–∏—ò—É–º —ò–æ–Ω–∏, –∫–æ—ò–∏ —Å–µ –≤–µ–∑—É—ò—É –∑–∞ –≤–∞–Ω—õ–µ–ª–∏—ò—Å–∫–æ –ª–∏—Ü–µ[ 63] [ 64] [ 65] [ 66]
–à–æ–Ω–∏ –±–∞—Ä–∏—ò—É–º–∞ —Ç–∞–∫–æ—í–µ –º–æ–≥—É –±–ª–æ–∫–∏—Ä–∞—Ç–∏ —Å—Ç—Ä—É—ò–µ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞,[ 67] [ 68] [ 69] [ 70] [ 71] [ 72]
–ú–µ–¥–∏—Ü–∏–Ω—Å–∫–∏, –±–ª–æ–∫–∞—Ç–æ—Ä–∏ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞, –∫–∞–æ —à—Ç–æ —Å—É 4-–∞–º–∏–Ω–æ–ø–∏—Ä–∏–¥–∏–Ω –∏ 3,4-–¥–∏–∞–º–∏–Ω–æ–ø–∏—Ä–∏–¥–∏–Ω , —Å—É –∏—Å–ø–∏—Ç–∏–≤–∞–Ω–∏ –∑–∞ –ª–µ—á–µ—ö–µ —Å—Ç–∞—ö–∞ –∫–∞–æ —à—Ç–æ —ò–µ –º—É–ª—Ç–∏–ø–ª–∞ —Å–∫–ª–µ—Ä–æ–∑–∞ .[ 73] —Å—Ä—Ü—É . –°—Ö–æ–¥–Ω–æ —Ç–æ–º–µ, —Å–≤–∏ –Ω–æ–≤–∏ –ª–µ–∫–æ–≤–∏ —Å–µ –æ–±–∞–≤–µ–∑–Ω–æ –ø—Ä–µ—Ç–∫–ª–∏–Ω–∏—á–∫–∏ —Ç–µ—Å—Ç–∏—Ä–∞–Ω–∏ –Ω–∞ —Å—Ä—á–∞–Ω—É –±–µ–∑–±–µ–¥–Ω–æ—Å—Ç.
–û—Ç–≤–∞—Ä–∞—á–∏ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞ –∏–ª–∏ –∞–∫—Ç–∏–≤–∞—Ç–æ—Ä –≤—Ä—Å—Ç–∞ —ò–µ –ª–µ–∫–∞ –∫–æ—ò–∏ –æ–ª–∞–∫—à–∞–≤–∞ –ø—Ä–µ–Ω–æ—Å —ò–æ–Ω–∞ –∫—Ä–æ–∑ –∫–∞–ª–∏—ò—É–º–æ–≤–µ –∫–∞–Ω–∞–ª–µ. –û—Ç–≤–∞—Ä–∞—ö–µ —ò–∞–∫–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞ —É —õ–µ–ª–∏—ò—Å–∫–∏–º –º–µ–º–±—Ä–∞–Ω–∞–º–∞ —Å–∞ —Ä–µ–∑—É–ª—Ç—É—ò—É—õ–∏–º –ø–æ–≤–µ—õ–∞—ö–µ–º –ø—Ä–æ–≤–æ–¥—ô–∏–≤–æ—Å—Ç–∏ –∫–∞–ª–∏—ò—É–º–∞, –ø–æ–º–µ—Ä–∞ –º–µ–º–±—Ä–∞–Ω—Å–∫–∏ –ø–æ—Ç–µ–Ω—Ü–∏—ò–∞–ª —É —Ö–∏–ø–µ—Ä–ø–æ–ª–∞—Ä–∏–∑—É—ò—É—õ–µ–º –ø—Ä–∞–≤—Ü—É –∫–∞ —Ä–∞–≤–Ω–æ—Ç–µ–∂–Ω–æ–º –ø–æ—Ç–µ–Ω—Ü–∏—ò–∞–ª—É –∫–∞–ª–∏—ò—É–º–∞. –•–∏–ø–µ—Ä–ø–æ–ª–∞—Ä–∏–∑–∞—Ü–∏—ò–∞ —Å–º–∞—ö—É—ò–µ –≤–µ—Ä–æ–≤–∞—Ç–Ω–æ—õ—É –æ—Ç–≤–∞—Ä–∞—ö–∞ —ò–æ–Ω—Å–∫–∏—Ö –∫–∞–Ω–∞–ª–∞ —É–∫—ô—É—á–µ–Ω–∏—Ö —É –¥–µ–ø–æ–ª–∞—Ä–∏–∑–∞—Ü–∏—ò—É –º–µ–º–±—Ä–∞–Ω–µ –∏ –µ–∫—Å—Ü–∏—Ç–∞—Ü–∏—ò–∞ —ò–µ —Å–º–∞—ö–µ–Ω–∞. –í–µ—Ä—É—ò–µ —Å–µ –¥–∞ –æ—Ç–≤–∞—Ä–∞—á–∏ –∫–∞–ª–∏—ò—É–º—Å–∫–∏—Ö –∫–∞–Ω–∞–ª–∞ —Ö–∏–ø–µ—Ä–ø–æ–ª–∞—Ä–∏–∑—É—ò—É —õ–µ–ª–∏—ò–µ –≥–ª–∞—Ç–∫–∏—Ö –º–∏—à–∏—õ–∞ –¥–∏—Ä–µ–∫—Ç–Ω–∏–º –¥–µ–ª–æ–≤–∞—ö–µ–º –Ω–∞ —õ–µ–ª–∏—ò—Å–∫—É –º–µ–º–±—Ä–∞–Ω—É.[ 74]
–ù–∞—ò–ø–æ–∑–Ω–∞—Ç–∏—ò–∏ —á–ª–∞–Ω–æ–≤–∏ –≥—Ä—É–ø–µ —Å—É –∫—Ä–æ–º–∞–∫–∞–ª–∏–º , –Ω–∏–∫–æ—Ä–∞–Ω–¥–∏–ª –∏ –ø–∏–Ω–∞—Ü–∏–¥–∏–ª , –∞–ª–∏ –∏–º–∞ —ò–æ—à –Ω–µ–∫–æ–ª–∏–∫–æ –Ω–æ–≤–∏—Ö —ò–µ–¥–∏—ö–µ—ö–∞. –ü–æ—Ä–µ–¥ —Ç–æ–≥–∞, –Ω–µ–¥–∞–≤–Ω–æ —Å–µ –ø–æ–∫–∞–∑–∞–ª–æ –¥–∞ –∏ –∫–ª–∏–Ω–∏—á–∫–∏ –ø–æ–∑–Ω–∞—Ç–∏ –ª–µ–∫–æ–≤–∏ –∫–∞–æ –Ω–ø—Ä. –¥–∏–∞–∑–æ–∫—Å–∏–¥ –∏ –º–∏–Ω–æ–∫—Å–∏–¥–∏–ª –ø–æ–∫–∞–∑—É—ò—É —Å–≤–æ—ò—Å—Ç–≤–∞ –æ—Ç–≤–∞—Ä–∞—ö–∞ –ö+ –∫–∞–Ω–∞–ª–∞. –ù–∏–∫–æ—Ä–∞–Ω–¥–∏–ª –∏ –Ω–æ–≤–∞ —ò–µ–¥–∏—ö–µ—ö–∞ –∫–æ—ò–∞ —Å–∞–¥—Ä–∂–µ –Ω–∏—Ç—Ä–æ –≥—Ä—É–ø–µ –∏–º–∞—ò—É –¥–≤–æ—Å—Ç—Ä—É–∫–∏ –º–µ—Ö–∞–Ω–∏–∑–∞–º –¥–µ–ª–æ–≤–∞—ö–∞, —Ç–∞–∫–æ—í–µ –∞–∫—Ç–∏–≤–∏—Ä–∞—ò—É—õ–∏ –≥–≤–∞–Ω–∏–ª–∞—Ç —Ü–∏–∫–ª–∞–∑—É, –µ—Ñ–µ–∫–∞—Ç –∫–æ—ò–∏ –¥–æ–ø—Ä–∏–Ω–æ—Å–∏ —ö–∏—Ö–æ–≤–æ–º –ø—Ä–æ—Ñ–∏–ª—É –∫–∞—Ä–¥–∏–æ–≤–∞—Å–∫—É–ª–∞—Ä–Ω–∏—Ö –µ—Ñ–µ–∫–∞—Ç–∞.[ 75]
–û—Ç–≤–∞—Ä–∞—á–∏ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞ –∏–º–∞—ò—É —à–∏—Ä–æ–∫ —Å–ø–µ–∫—Ç–∞—Ä –µ—Ñ–µ–∫–∞—Ç–∞. –ù–µ–∫–µ –æ–¥ —ö–∏—Ö–æ–≤–∏—Ö —Å–≤–æ—ò—Å—Ç–∞–≤–∞ –∏ –¥–µ–ª–æ–≤–∞—ö–∞ —Å—É —Å—É–º–∏—Ä–∞–Ω–µ, –∞ —ö–∏—Ö–æ–≤–µ —Å–∞–¥–∞—à—ö–µ –ø—Ä–∏–º–µ–Ω–µ –∏/–∏–ª–∏ –ø–æ—Ç–µ–Ω—Ü–∏—ò–∞–ª –∑–∞ –±—É–¥—É—õ—É –ø—Ä–∏–º–µ–Ω—É, –Ω–ø—Ä. —Ö–∏–ø–µ—Ä—Ç–µ–Ω–∑–∏—ò–∞ , –∞–Ω–≥–∏–Ω–∞ –ø–µ–∫—Ç–æ—Ä–∏—Å , –∞—Å—Ç–º–∞ , –Ω–µ—Å—Ç–∞–±–∏–ª–Ω–æ—Å—Ç –º–æ–∫—Ä–∞—õ–Ω–µ –±–µ—à–∏–∫–µ –∏ –Ω–µ–∫–æ–ª–∏–∫–æ –¥—Ä—É–≥–∏—Ö –ø–æ—Ä–µ–º–µ—õ–∞—ò–∞. –ó–∞–∫—ô—É—á–µ–Ω–æ —ò–µ –¥–∞ –æ—Ç–≤–∞—Ä–∞—ö–µ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞ –ø—Ä–µ–¥—Å—Ç–∞–≤—ô–∞ –∑–∞–Ω–∏–º—ô–∏–≤ —Ñ–∞—Ä–º–∞–∫–æ–ª–æ—à–∫–∏ –ø—Ä–∏–Ω—Ü–∏–ø —Å–∞ –º–Ω–æ–≥–æ –ø–æ—Ç–µ–Ω—Ü–∏—ò–∞–ª–Ω–∏—Ö –∫–ª–∏–Ω–∏—á–∫–∏—Ö –ø—Ä–∏–º–µ–Ω–∞. –ú–µ—í—É—Ç–∏–º, —á–∏–Ω–∏ —Å–µ –¥–∞ –≤–µ—õ–∏–Ω–∞ –¥–æ—Å—Ç—É–ø–Ω–∏—Ö –ª–µ–∫–æ–≤–∞ –Ω–µ–º–∞ –¥–æ–≤–æ—ô–Ω—É —Å–µ–ª–µ–∫—Ç–∏–≤–Ω–æ—Å—Ç —Ç–∫–∏–≤–∞ –¥–∞ –±–∏ –∏–º –±–∏–ª–∞ –∫–æ—Ä–∏—Å–Ω–∞ —Ç–µ—Ä–∞–ø–∏—ò—Å–∫–∞ –∞–ª—Ç–µ—Ä–Ω–∞—Ç–∏–≤–∞. –ü—Ä–µ –Ω–µ–≥–æ —à—Ç–æ —Å–µ –ø–æ—Ç–µ–Ω—Ü–∏—ò–∞–ª –Ω–æ–≤–∏—Ö —á–ª–∞–Ω–æ–≤–∞ –≥—Ä—É–ø–µ —É –∫–ª–∏–Ω–∏—á–∫–∏–º –∏—Å–ø–∏—Ç–∏–≤–∞—ö–∏–º–∞ –ø—Ä–∞–≤–∏–ª–Ω–æ –ø—Ä–æ—Ü–µ–Ω–∏, –ø–æ—Ç—Ä–µ–±–Ω–∞ —Å—É –¥–∞—ô—ô–∞ –∫–ª–∏–Ω–∏—á–∫–∞ –∏—Å–∫—É—Å—Ç–≤–∞.[ 76]
–ù–µ–∫–µ –≤—Ä—Å—Ç–µ –∫–∞–ª–∏—ò—É–º–æ–≤–∏—Ö –∫–∞–Ω–∞–ª–∞ –∞–∫—Ç–∏–≤–∏—Ä–∞—ò—É –º—É—Å–∫–∞—Ä–∏–Ω—Å–∫–∏ —Ä–µ—Ü–µ–ø—Ç–æ—Ä–∏ –∏ –æ–Ω–∏ —Å–µ –Ω–∞–∑–∏–≤–∞—ò—É –º—É—Å–∫–∞—Ä–∏–Ω—Å–∫–∏ –∫–∞–ª–∏—ò—É–º–æ–≤–∏ –∫–∞–Ω–∞–ª–∏ (IKACh). –û–≤–∏ –∫–∞–Ω–∞–ª–∏ —Å—É —Ö–µ—Ç–µ—Ä–æ—Ç–µ—Ç—Ä–∞–º–µ—Ä —Å–∞—Å—Ç–∞–≤—ô–µ–Ω –æ–¥ –¥–≤–µ GIRK1 –∏ –¥–≤–µ GIRK4 –ø–æ–¥—ò–µ–¥–∏–Ω–∏—Ü–µ.[ 77] [ 78] [ 79] [ 80]
^ Littleton JT, Ganetzky B (април 2000). „Ion channels and synaptic organization: analysis of the Drosophila genome”. Neuron . 26 (1): 35—43. PMID 10798390 . S2CID 5694563 . doi :10.1016/S0896-6273(00)81135-6   ^ Hille, Bertil (2001). „Chapter 5: Potassium Channels and Chloride Channels”. Ion channels of excitable membranes 131 –168. ISBN 978-0-87893-321-1 . ^ Jessell TM, Kandel ER , Schwartz JH (2000). „Chapter 6: Ion Channels”. Principles of Neural Science 105–124 . ISBN 978-0-8385-7701-1 . ^ Kuo, Mario M.-C.; Haynes, W. John; Loukin, Stephen H.; Kung, Ching; Saimi, Yoshiro (2005). „Prokaryotic K + channels: From crystal structures to diversity” . FEMS Microbiology Reviews (на језику: енглески). 29 (5): 961—985. ISSN 1574-6976 . doi :10.1016/j.femsre.2005.03.003 . ^ Lim C, Dudev T (2016). Sigel A, Sigel H, Sigel RK, ур. „Chapter 10. Potassium Versus Sodium Selectivity in Monovalent Ion Channel Selectivity Filters”. The Alkali Metal Ions: Their Role in Life . Metal Ions in Life Sciences. Springer. 16 : 325—347. PMID 26860305 . doi :10.1007/978-3-319-21756-7_9 . ^ indirectly cited from reference number 3,4,5,6 in Rehm H, Lazdunski M (јул 1988). „Purification and subunit structure of a putative K+-channel protein identified by its binding properties for dendrotoxin I” . Proceedings of the National Academy of Sciences of the United States of America . 85 (13): 4919—4923. Bibcode :1988PNAS...85.4919R . PMC 280549  PMID 2455300 . doi :10.1073/pnas.85.13.4919  
^ а б в г д ђ е ж з Rang, HP (2015). Pharmacology (8 изд.). Edinburgh: Churchill Livingstone. стр. 59. ISBN 978-0-443-07145-4 . ^ Thompson J, Begenisich T (maj 2000). „Electrostatic interaction between charybdotoxin and a tetrameric mutant of Shaker K(+) channels” . Biophysical Journal . 78 (5): 2382—91. Bibcode :2000BpJ....78.2382T . PMC 1300827  PMID 10777734 . doi :10.1016/S0006-3495(00)76782-8 . ^ Naranjo D, Miller C (januar 1996). „A strongly interacting pair of residues on the contact surface of charybdotoxin and a Shaker K+ channel”. Neuron . 16 (1): 123—30. PMID 8562075 . S2CID 16794677 . doi :10.1016/S0896-6273(00)80029-X   ^ Yu M, Liu SL, Sun PB, Pan H, Tian CL, Zhang LH (januar 2016). „Peptide toxins and small-molecule blockers of BK channels” . Acta Pharmacologica Sinica . 37 (1): 56—66. PMC 4722972  PMID 26725735 . doi :10.1038/aps.2015.139 . ^ Candia S, Garcia ML, Latorre R (1992). „Mode of action of iberiotoxin, a potent blocker of the large conductance Ca(2+)-activated K+ channel” . Biophysical Journal . 63 (2): 583—90. Bibcode :1992BpJ....63..583C . PMC 1262182  PMID 1384740 . doi :10.1016/S0006-3495(92)81630-2 . ^ Stocker M, Krause M, Pedarzani P (april 1999). „An apamin-sensitive Ca2+-activated K+ current in hippocampal pyramidal neurons” . Proceedings of the National Academy of Sciences of the United States of America . 96 (8): 4662—7. Bibcode :1999PNAS...96.4662S . PMC 16389  PMID 10200319 . doi :10.1073/pnas.96.8.4662   ^ McLeod JF, Leempoels JM, Peng SX, Dax SL, Myers LJ, Golder FJ (novembar 2014). „GAL-021, a new intravenous BKCa-channel blocker, is well tolerated and stimulates ventilation in healthy volunteers”. British Journal of Anaesthesia . 113 (5): 875—83. PMID 24989775 . doi :10.1093/bja/aeu182   ^ Dopico AM, Bukiya AN, Kuntamallappanavar G, Liu J (2016). „Modulation of BK Channels by Ethanol” . International Review of Neurobiology . 128 : 239—79. ISBN 9780128036198 . PMC 5257281  PMID 27238266 . doi :10.1016/bs.irn.2016.03.019 . ^ а б в г Patnaik, Pradyot (2003). Handbook of inorganic chemicals 77 –78. ISBN 978-0-07-049439-8 . ^ Sackin H, Syn S, Palmer LG, Choe H, Walters DE (februar 2001). „Regulation of ROMK by extracellular cations” . Biophysical Journal . 80 (2): 683—97. Bibcode :2001BpJ....80..683S . PMC 1301267  PMID 11159436 . doi :10.1016/S0006-3495(01)76048-1 . ^ Kobayashi T, Washiyama K, Ikeda K (2006). „Inhibition of G protein-activated inwardly rectifying K+ channels by ifenprodil”. Neuropsychopharmacology . 31 (3): 516—24. PMID 16123769 . doi :10.1038/sj.npp.1300844   ^ Soeda F, Fujieda Y, Kinoshita M, Shirasaki T, Takahama K (maj 2016). „Centrally acting non-narcotic antitussives prevent hyperactivity in mice: Involvement of GIRK channels”. Pharmacology, Biochemistry, and Behavior . 144 : 26—32. PMID 26892760 . S2CID 30118634 . doi :10.1016/j.pbb.2016.02.006 . ^ Yamamoto G, Soeda F, Shirasaki T, Takahama K (april 2011). „[Is the GIRK channel a possible target in the development of a novel therapeutic drug of urinary disturbance?]”. Yakugaku Zasshi . 131 (4): 523—32. PMID 21467791 . doi :10.1248/yakushi.131.523   ^ Kawaura K, Honda S, Soeda F, Shirasaki T, Takahama K (maj 2010). „[Novel antidepressant-like action of drugs possessing GIRK channel blocking action in rats]”. Yakugaku Zasshi . 130 (5): 699—705. PMID 20460867 . doi :10.1248/yakushi.130.699   ^ Jin W, Lu Z (septembar 1998). „A novel high-affinity inhibitor for inward-rectifier K+ channels”. Biochemistry . 37 (38): 13291—9. PMID 9748337 . doi :10.1021/bi981178p . ^ Kawaura K, Ogata Y, Inoue M, Honda S, Soeda F, Shirasaki T, Takahama K (decembar 2009). „The centrally acting non-narcotic antitussive tipepidine produces antidepressant-like effect in the forced swimming test in rats”. Behavioural Brain Research . 205 (1): 315—8. PMID 19616036 . S2CID 29236491 . doi :10.1016/j.bbr.2009.07.004 . ^ Kaufmann K, Romaine I, Days E, Pascual C, Malik A, Yang L, et al. (septembar 2013). „ML297 (VU0456810), the first potent and selective activator of the GIRK potassium channel, displays antiepileptic properties in mice” . ACS Chemical Neuroscience . 4 (9): 1278—86. PMC 3778424  PMID 23730969 . doi :10.1021/cn400062a . ^ Serrano-Martín X, Payares G, Mendoza-León A (decembar 2006). „Glibenclamide, a blocker of K+(ATP) channels, shows antileishmanial activity in experimental murine cutaneous leishmaniasis” . Antimicrobial Agents and Chemotherapy . 50 (12): 4214—6. PMC 1693980  PMID 17015627 . doi :10.1128/AAC.00617-06 . ^ Lawrence CL, Proks P, Rodrigo GC, Jones P, Hayabuchi Y, Standen NB, Ashcroft FM (2001). „Gliclazide produces high-affinity block of KATP channels in mouse isolated pancreatic beta cells but not rat heart or arterial smooth muscle cells” . Diabetologia . 44 (8): 1019—25. PMID 11484080 . doi :10.1007/s001250100595   ^ а б в г д ђ Enyedi P, Czirják G (april 2010). „Molecular background of leak K+ currents: two-pore domain potassium channels” . Physiological Reviews . 90 (2): 559—605. PMID 20393194 . S2CID 9358238 . doi :10.1152/physrev.00029.2009 . ^ а б в г д ђ Lotshaw DP (2007). „Biophysical, pharmacological, and functional characteristics of cloned and native mammalian two-pore domain K+ channels”. Cell Biochemistry and Biophysics . 47 (2): 209—56. PMID 17652773 . S2CID 12759521 . doi :10.1007/s12013-007-0007-8 . ^ Fink M, Lesage F, Duprat F, Heurteaux C, Reyes R, Fosset M, Lazdunski M (juni 1998). „A neuronal two P domain K+ channel stimulated by arachidonic acid and polyunsaturated fatty acids” . The EMBO Journal . 17 (12): 3297—308. PMC 1170668  PMID 9628867 . doi :10.1093/emboj/17.12.3297 . ^ Goldstein SA, Bockenhauer D, O'Kelly I, Zilberberg N (mart 2001). „Potassium leak channels and the KCNK family of two-P-domain subunits” . Nature Reviews. Neuroscience . 2 (3): 175—84. PMID 11256078 . S2CID 9682396 . doi :10.1038/35058574 . ^ Sano Y, Inamura K, Miyake A, Mochizuki S, Kitada C, Yokoi H, et al. (juli 2003). „A novel two-pore domain K+ channel, TRESK, is localized in the spinal cord”. The Journal of Biological Chemistry . 278 (30): 27406—12. PMID 12754259 . doi :10.1074/jbc.M206810200   ^ Czirják G, Tóth ZE, Enyedi P (april 2004). „The two-pore domain K+ channel, TRESK, is activated by the cytoplasmic calcium signal through calcineurin”. The Journal of Biological Chemistry . 279 (18): 18550—8. PMID 14981085 . doi :10.1074/jbc.M312229200   ^ Kindler CH, Yost CS, Gray AT (april 1999). „Local anesthetic inhibition of baseline potassium channels with two pore domains in tandem” . Anesthesiology . 90 (4): 1092—102. PMID 10201682 . doi :10.1097/00000542-199904000-00024 . ^ а б в Meadows HJ, Randall AD (mart 2001). „Functional characterisation of human TASK-3, an acid-sensitive two-pore domain potassium channel” . Neuropharmacology . 40 (4): 551—9. PMID 11249964 . S2CID 20181576 . doi :10.1016/S0028-3908(00)00189-1 . ^ Kindler CH, Paul M, Zou H, Liu C, Winegar BD, Gray AT, Yost CS (juli 2003). „Amide local anesthetics potently inhibit the human tandem pore domain background K+ channel TASK-2 (KCNK5)” . The Journal of Pharmacology and Experimental Therapeutics . 306 (1): 84—92. PMID 12660311 . S2CID 1621972 . doi :10.1124/jpet.103.049809 . ^ Punke MA, Licher T, Pongs O, Friederich P (juni 2003). „Inhibition of human TREK-1 channels by bupivacaine” . Anesthesia and Analgesia . 96 (6): 1665—73, table of contents. PMID 12760993 . S2CID 39630495 . doi :10.1213/01.ANE.0000062524.90936.1F . ^ Lesage F, Guillemare E, Fink M, Duprat F, Lazdunski M, Romey G, Barhanin J (mart 1996). „TWIK-1, a ubiquitous human weakly inward rectifying K+ channel with a novel structure” . The EMBO Journal . 15 (5): 1004—11. PMC 449995  PMID 8605869 . doi :10.1002/j.1460-2075.1996.tb00437.x . ^ Duprat F, Lesage F, Fink M, Reyes R, Heurteaux C, Lazdunski M (septembar 1997). „TASK, a human background K+ channel to sense external pH variations near physiological pH” . The EMBO Journal . 16 (17): 5464—71. PMC 1170177  PMID 9312005 . doi :10.1093/emboj/16.17.5464 . ^ Reyes R, Duprat F, Lesage F, Fink M, Salinas M, Farman N, Lazdunski M (novembar 1998). „Cloning and expression of a novel pH-sensitive two pore domain K+ channel from human kidney”. The Journal of Biological Chemistry . 273 (47): 30863—9. PMID 9812978 . doi :10.1074/jbc.273.47.30863   ^ Meadows HJ, Benham CD, Cairns W, Gloger I, Jennings C, Medhurst AD, et al. (april 2000). „Cloning, localisation and functional expression of the human orthologue of the TREK-1 potassium channel”. Pflügers Archiv . 439 (6): 714—22. PMID 10784345 . doi :10.1007/s004240050997 . ^ „UniProtKB - Q9NPC2 (KCNK9_HUMAN)” . Uniprot. Приступљено 29. 5. 2019 . ^ а б Kennard LE, Chumbley JR, Ranatunga KM, Armstrong SJ, Veale EL, Mathie A (mart 2005). „Inhibition of the human two-pore domain potassium channel, TREK-1, by fluoxetine and its metabolite norfluoxetine” . British Journal of Pharmacology . 144 (6): 821—9. PMC 1576064  PMID 15685212 . doi :10.1038/sj.bjp.0706068 . ^ Patel AJ, Honoré E, Lesage F, Fink M, Romey G, Lazdunski M (maj 1999). „Inhalational anesthetics activate two-pore-domain background K+ channels”. Nature Neuroscience . 2 (5): 422—6. PMID 10321245 . S2CID 23092576 . doi :10.1038/8084 . ^ Gray AT, Zhao BB, Kindler CH, Winegar BD, Mazurek MJ, Xu J, et al. (juni 2000). „Volatile anesthetics activate the human tandem pore domain baseline K+ channel KCNK5” . Anesthesiology . 92 (6): 1722—30. PMID 10839924 . S2CID 45487917 . doi :10.1097/00000542-200006000-00032 . ^ Kirsch GE, Narahashi T (juni 1978). „3,4-diaminopyridine. A potent new potassium channel blocker” . Biophysical Journal . 22 (3): 507—12. Bibcode :1978BpJ....22..507K . PMC 1473482  PMID 667299 . doi :10.1016/s0006-3495(78)85503-9 . ^ Tiku PE, Nowell PT (decembar 1991). „Selective inhibition of K(+)-stimulation of Na,K-ATPase by bretylium” . British Journal of Pharmacology . 104 (4): 895—900. PMC 1908819  PMID 1667290 . doi :10.1111/j.1476-5381.1991.tb12523.x . ^ Hille B (maj 1967). „The selective inhibition of delayed potassium currents in nerve by tetraethylammonium ion” . The Journal of General Physiology . 50 (5): 1287—302. PMC 2225709  PMID 6033586 . doi :10.1085/jgp.50.5.1287 . ^ Armstrong CM (oktobar 1971). „Interaction of tetraethylammonium ion derivatives with the potassium channels of giant axons” . The Journal of General Physiology . 58 (4): 413—37. PMC 2226036  PMID 5112659 . doi :10.1085/jgp.58.4.413 . ^ „Amiodarone” . Drugbank. Приступљено 28. 5. 2019 . ^ Rogawski MA, Bazil CW (juli 2008). „New molecular targets for antiepileptic drugs: alpha(2)delta, SV2A, and K(v)7/KCNQ/M potassium channels” . Current Neurology and Neuroscience Reports . 8 (4): 345—52. PMC 2587091  PMID 18590620 . doi :10.1007/s11910-008-0053-7 . ^ Doyle DA, Morais Cabral J, Pfuetzner RA, Kuo A, Gulbis JM, Cohen SL, et al. (април 1998). „The structure of the potassium channel: molecular basis of K+ conduction and selectivity”. Science . 280 (5360): 69—77. Bibcode :1998Sci...280...69D . PMID 9525859 . doi :10.1126/science.280.5360.69 . ^ MacKinnon R, Cohen SL, Kuo A, Lee A, Chait BT (април 1998). „Structural conservation in prokaryotic and eukaryotic potassium channels”. Science . 280 (5360): 106—109. Bibcode :1998Sci...280..106M . PMID 9525854 . S2CID 33907550 . doi :10.1126/science.280.5360.106 . ^ Armstrong C (април 1998). „The vision of the pore”. Science . 280 (5360): 56—57. PMID 9556453 . S2CID 35339674 . doi :10.1126/science.280.5360.56 . ^ „The Nobel Prize in Chemistry 2003” . The Nobel Foundation. Приступљено 2007-11-16 . ^ Zhou Y, Morais-Cabral JH, Kaufman A, MacKinnon R (новембар 2001). „Chemistry of ion coordination and hydration revealed by a K+ channel-Fab complex at 2.0 A resolution”. Nature . 414 (6859): 43—48. Bibcode :2001Natur.414...43Z . PMID 11689936 . S2CID 205022645 . doi :10.1038/35102009 . ^ Molecular cell biology ISBN 978-1-4641-8339-3 . ^ Lodish H, Berk A, Kaiser C, Krieger M, Bretscher A, Ploegh H, et al. (2016). Molecular Cell Biology (8th изд.). New York, NY: W. H. Freeman and Company. стр. 499. ISBN 978-1-4641-8339-3 . ^ Sauer DB, Zeng W, Raghunathan S, Jiang Y (октобар 2011). „Protein interactions central to stabilizing the K+ channel selectivity filter in a four-sited configuration for selective K+ permeation” . Proceedings of the National Academy of Sciences of the United States of America . 108 (40): 16634—16639. Bibcode :2011PNAS..10816634S . PMC 3189067  PMID 21933962 . doi :10.1073/pnas.1111688108   ^ Hellgren, Mikko; Sandberg, Lars; Edholm, Olle (2006). „A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study” . Biophysical Chemistry . 120 (1): 1—9. ISSN 0301-4622 . doi :10.1016/j.bpc.2005.10.002 . ^ Noskov, Sergei Yu.; Bernèche, Simon; Roux, Benoît (2004). „Control of ion selectivity in potassium channels by electrostatic and dynamic properties of carbonyl ligands” . Nature . 431 (7010): 830—834. ISSN 0028-0836 . doi :10.1038/nature02943 . ^ Varma, Sameer; Rempe, Susan B. (2007). „Tuning Ion Coordination Architectures to Enable Selective Partitioning” . Biophysical Journal . 93 (4): 1093—1099. ISSN 0006-3495 . doi :10.1529/biophysj.107.107482 . ^ Derebe, Mehabaw G.; Sauer, David B.; Zeng, Weizhong; Alam, Amer; Shi, Ning; Jiang, Youxing (2010-12-27). „Tuning the ion selectivity of tetrameric cation channels by changing the number of ion binding sites” . Proceedings of the National Academy of Sciences . 108 (2): 598—602. ISSN 0027-8424 . doi :10.1073/pnas.1013636108 . ^ Thomas, Michael; Jayatilaka, Dylan; Corry, Ben (2007). „The Predominant Role of Coordination Number in Potassium Channel Selectivity” . Biophysical Journal . 93 (8): 2635—2643. ISSN 0006-3495 . doi :10.1529/biophysj.107.108167 . ^ Luzhkov VB, Aqvist J (фебруар 2005). „Ions and blockers in potassium channels: insights from free energy simulations”. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics . 1747 (1): 109—120. PMID 15680245 . doi :10.1016/j.bbapap.2004.10.006 . ^ Luzhkov VB, Osterberg F, Aqvist J (новембар 2003). „Structure-activity relationship for extracellular block of K+ channels by tetraalkylammonium ions”. FEBS Letters . 554 (1–2): 159—164. PMID 14596932 . S2CID 32031835 . doi :10.1016/S0014-5793(03)01117-7   ^ Posson DJ, McCoy JG, Nimigean CM (фебруар 2013). „The voltage-dependent gate in MthK potassium channels is located at the selectivity filter” . Nature Structural & Molecular Biology . 20 (2): 159—166. PMC 3565016  PMID 23262489 . doi :10.1038/nsmb.2473 . ^ Choi KL, Mossman C, Aubé J, Yellen G (март 1993). „The internal quaternary ammonium receptor site of Shaker potassium channels”. Neuron . 10 (3): 533—541. PMID 8461140 . S2CID 33361945 . doi :10.1016/0896-6273(93)90340-w . ^ Piasta KN, Theobald DL, Miller C (октобар 2011). „Potassium-selective block of barium permeation through single KcsA channels” . The Journal of General Physiology . 138 (4): 421—436. PMC 3182450  PMID 21911483 . doi :10.1085/jgp.201110684 . ^ Neyton J, Miller C (новембар 1988). „Potassium blocks barium permeation through a calcium-activated potassium channel” . The Journal of General Physiology . 92 (5): 549—567. PMC 2228918  PMID 3235973 . doi :10.1085/jgp.92.5.549 . ^ Lockless SW, Zhou M, MacKinnon R (мај 2007). „Structural and thermodynamic properties of selective ion binding in a K+ channel” . PLOS Biology . 5 (5): e121. PMC 1858713  PMID 17472437 . doi :10.1371/journal.pbio.0050121 . ^ Jiang Y, MacKinnon R (март 2000). „The barium site in a potassium channel by x-ray crystallography” . The Journal of General Physiology . 115 (3): 269—272. PMC 2217209  PMID 10694255 . doi :10.1085/jgp.115.3.269 . ^ Lam YL, Zeng W, Sauer DB, Jiang Y (август 2014). „The conserved potassium channel filter can have distinct ion binding profiles: structural analysis of rubidium, cesium, and barium binding in NaK2K” . The Journal of General Physiology . 144 (2): 181—192. PMC 4113894  PMID 25024267 . doi :10.1085/jgp.201411191 . ^ Guo R, Zeng W, Cui H, Chen L, Ye S (август 2014). „Ionic interactions of Ba2+ blockades in the MthK K+ channel” . The Journal of General Physiology . 144 (2): 193—200. PMC 4113901  PMID 25024268 . doi :10.1085/jgp.201411192 . ^ Judge SI, Bever CT (јул 2006). „Potassium channel blockers in multiple sclerosis: neuronal Kv channels and effects of symptomatic treatment”. Pharmacology & Therapeutics . 111 (1): 224—259. PMID 16472864 . doi :10.1016/j.pharmthera.2005.10.006 . ^ Mizutani S, Prasad SM, Sellitto AD, Schuessler RB, Damiano RJ, Lawton JS (August 2005). "Myocyte volume and function in response to osmotic stress: observations in the presence of an adenosine triphosphate-sensitive potassium channel opener". Circulation. 112 (9 Suppl): I219–23.
^ Stojnic, Natasa; Gojkovic-Bukarica, Ljiljana; Peric, Miodrag; Grbovic, Leposava; Lesic, Aleksandar; Bumbasirevic, Marko; Heinle, Helmut (2007). „Potassium Channel Opener Pinacidil Induces Relaxation of the Isolated Human Radial Artery” . Journal of Pharmacological Sciences . 104 (2): 122—129. ISSN 1347-8613 . doi :10.1254/jphs.fp0061434 . ^ Wang, Tong (2003-02-01). „The Effects of the Potassium Channel Opener Minoxidil on Renal Electrolytes Transport in the Loop of Henle” . Journal of Pharmacology and Experimental Therapeutics . 304 (2): 833—840. ISSN 0022-3565 . doi :10.1124/jpet.102.043380 . ^ Krapivinsky G, Gordon EA, Wickman K, Velimirović B, Krapivinsky L, Clapham DE (март 1995). „The G-protein-gated atrial K+ channel IKACh is a heteromultimer of two inwardly rectifying K(+)-channel proteins”. Nature . 374 (6518): 135—141. Bibcode :1995Natur.374..135K . PMID 7877685 . S2CID 4334467 . doi :10.1038/374135a0 . ^ Corey S, Krapivinsky G, Krapivinsky L, Clapham DE (фебруар 1998). „Number and stoichiometry of subunits in the native atrial G-protein-gated K+ channel, IKACh”. The Journal of Biological Chemistry . 273 (9): 5271—5278. PMID 9478984 . doi :10.1074/jbc.273.9.5271   ^ Kunkel MT, Peralta EG (новембар 1995). „Identification of domains conferring G protein regulation on inward rectifier potassium channels”. Cell . 83 (3): 443—449. PMID 8521474 . S2CID 14720432 . doi :10.1016/0092-8674(95)90122-1   ^ Wickman K, Krapivinsky G, Corey S, Kennedy M, Nemec J, Medina I, Clapham DE (април 1999). „Structure, G protein activation, and functional relevance of the cardiac G protein-gated K+ channel, IKACh” . Annals of the New York Academy of Sciences . 868 (1): 386—398. Bibcode :1999NYASA.868..386W . PMID 10414308 . S2CID 25949938 . doi :10.1111/j.1749-6632.1999.tb11300.x . Архивирано из оригинала 2006-01-29. г.
Hille, Bertil (2001). „Chapter 5: Potassium Channels and Chloride Channels”. Ion channels of excitable membranes 131 –168. ISBN 978-0-87893-321-1 . Soussia, I. Ben et al. Mutation of a single residue promotes gating of vertebrate and invertebrate two-pore domain potassium channels. Nat. Commun. 10, 787 (2019).
Wang, W. & MacKinnon, R. Cryo-EM structure of the open human ether-√Ý-go-go-related K+ channel hERG. Cell 169, 422‚Äì430.e10 (2017).
Schönherr, R. & Heinemann, S. H. Molecular determinants for activation and inactivation of HERG, a human inward rectifier potassium channel. J. Physiol. 493, 635–642 (1996).
Gustina, A. S. & Trudeau, M. C. The eag domain regulates hERG channel inactivation gating via a direct interaction. J. Gen. Physiol. 141, 229–241 (2013).
Pau, V. P. T. et al. Structure and function of multiple Ca2+-binding sites in a K+ channel regulator of K+ conductance (RCK) domain. Proc. Natl. Acad. Sci. USA 108, 17684–17689 (2011).
Otwinowski, Z. & Minor, W. in Methods in Enzymology, Macromolecular Crystallography Part A 307–326 (Academic Press, 1997).
McCoy, A. J. et al. Phaser crystallographic software. J. Appl. Crystallogr. 40, 658–674 (2007).
Emsley, P. & Cowtan, K. Coot: model-building tools for molecular graphics. Acta Crystallogr. D 60, 2126–2132 (2004). Emsley, P., Lohkamp, B., Scott, W. G. & Cowtan, K. Features and development of Coot. Acta Crystallogr. D 66, 486–501 (2010). Adams, P. D. et al. PHENIX: a comprehensive Python-based system for macromolecular structure solution. Acta Crystallogr. D 66, 213–221 (2010).
Lee, J. et al. CHARMM-GUI input generator for NAMD, GROMACS, AMBER, OpenMM, and CHARMM/OpenMM simulations using the CHARMM36 additive force field. J. Chem. Theory Comput. 12, 405–413 (2016).
Jo, S., Kim, T., Iyer, V. G. & Im, W. CHARMM-GUI: a web-based graphical user interface for CHARMM. J. Comput. Chem. 29, 1859–1865 (2008).
Jo, S., Lim, J. B., Klauda, J. B. & Im, W. CHARMM-GUI membrane builder for mixed bilayers and its application to yeast membranes. Biophys. J. 97, 50–58 (2009).
Wu, E. L. et al. CHARMM-GUI membrane builder toward realistic biological membrane simulations. J. Comput. Chem. 35, 1997–2004 (2014).
Larsson, P. & Kasson, P. M. Lipid converter, a framework for lipid manipulations in molecular dynamics simulations. J. Membr. Biol. 247, 1137–1140 (2014).
Schrödinger, LLC. The PyMOL Molecular Graphics System, Version 1.8 (Schrödinger, LLC, New York, 2015).
Roux, B. The membrane potential and its representation by a constant electric field in computer simulations. Biophys. J. 95, 4205–4216 (2008).
Gumbart, J., Khalili-Araghi, F., Sotomayor, M. & Roux, B. Constant electric field simulations of the membrane potential illustrated with simple systems. Biochim. Biophys. Acta 1818, 294–302 (2012).
Berendsen, H. J. C., van der Spoel, D. & van Drunen, R. GROMACS: a message-passing parallel molecular dynamics implementation. Comput. Phys. Commun. 91, 43–56 (1995).
Lindahl, E., Hess, B. & van der Spoel, D. GROMACS 3.0: a package for molecular simulation and trajectory analysis. Mol. Model. Annu. 7, 306–317 (2001).
Van Der Spoel, D. et al. GROMACS: fast, flexible, and free. J. Comput. Chem. 26, 1701–1718 (2005).
Hess, B., Kutzner, C., van der Spoel, D. & Lindahl, E. GROMACS 4: algorithms for highly efficient, load-balanced, and scalable molecular simulation. J. Chem. Theory Comput. 4, 435–447 (2008).
Pronk, S. et al. GROMACS 4.5: a high-throughput and highly parallel open source molecular simulation toolkit. Bioinformatics 29, 845–854 (2013).
Abraham, M. J. et al. GROMACS: high performance molecular simulations through multi-level parallelism from laptops to supercomputers. SoftwareX 1–2, 19–25 (2015).
Maier, J. A. et al. ff14SB: improving the accuracy of protein side chain and backbone parameters from ff99SB. J. Chem. Theory Comput. 11, 3696–3713 (2015).
Huang, J. et al. CHARMM36m: an improved force field for folded and intrinsically disordered proteins. Nat. Methods 14, 71–73 (2017).
Berger, O., Edholm, O. & Jähnig, F. Molecular dynamics simulations of a fluid bilayer of dipalmitoylphosphatidylcholine at full hydration, constant pressure, and constant temperature. Biophys. J. 72, 2002–2013 (1997).
Cordomí, A., Caltabiano, G. & Pardo, L. Membrane protein simulations using AMBER force field and Berger lipid parameters. J. Chem. Theory Comput. 8, 948–958 (2012).
Jorgensen, W. L., Chandrasekhar, J., Madura, J. D., Impey, R. W. & Klein, M. L. Comparison of simple potential functions for simulating liquid water. J. Chem. Phys. 79, 926–935 (1983).
Joung, I. S. & Cheatham, T. E. Determination of alkali and halide monovalent ion parameters for use in explicitly solvated biomolecular simulations. J. Phys. Chem. B 112, 9020–9041 (2008).
Feenstra, K. A., Hess, B. & Berendsen, H. J. C. Improving efficiency of large time-scale molecular dynamics simulations of hydrogen-rich systems. J. Comput. Chem. 20, 786–798 (1999).
Hess, B., Bekker, H., Berendsen, H. J. C. & Fraaije, J. G. E. M. LINCS: a linear constraint solver for molecular simulations. J. Comput. Chem. 18, 1463–1472 (1997).
Darden, T., York, D. & Pedersen, L. Particle mesh Ewald: an N ⊕log(N) method for Ewald sums in large systems. J. Chem. Phys. 98, 10089–10092 (1993).
Bussi, G., Donadio, D. & Parrinello, M. Canonical sampling through velocity rescaling. J. Chem. Phys. 126, 014101 (2007).
Berendsen, H. J. C., Postma, J. P. M., van Gunsteren, W. F., DiNola, A. & Haak, J. R. Molecular dynamics with coupling to an external bath. J. Chem. Phys. 81, 3684–3690 (1984).
Klauda, J. B. et al. Update of the CHARMM all-atom additive force field for lipids: validation on six lipid types. J. Phys. Chem. B 114, 7830–7843 (2010).
MacKerell, A. D. et al. All-atom empirical potential for molecular modeling and dynamics studies of proteins. J. Phys. Chem. B 102, 3586–3616 (1998).
Beglov, D. & Roux, B. Finite representation of an infinite bulk system: solvent boundary potential for computer simulations. J. Chem. Phys. 100, 9050–9063 (1994).
Hoover, W. G. Canonical dynamics: equilibrium phase-space distributions. Phys. Rev. A 31, 1695–1697 (1985).
Nosé, S. A unified formulation of the constant temperature molecular dynamics methods. J. Chem. Phys. 81, 511–519 (1984).
Parrinello, M. & Rahman, A. Polymorphic transitions in single crystals: a new molecular dynamics method. J. Appl. Phys. 52, 7182–7190 (1981).
Öster, C. et al. The conduction pathway of potassium channels is water free under physiological conditions. Sci. Adv. 5, eaaw6756 (2019).
Derebe, M. G. et al. Tuning the ion selectivity of tetrameric cation channels by changing the number of ion binding sites. Proc. Natl. Acad. Sci. USA 108, 598–602 (2011).
Sauer, D. B., Zeng, W., Canty, J., Lam, Y. & Jiang, Y. Sodium and potassium competition in potassium-selective and non-selective channels. Nat. Commun. 4, 2721 (2013).
Brohawn, S. G., Campbell, E. B. & MacKinnon, R. Domain-swapped chain connectivity and gated membrane access in a Fab-mediated crystal of the human TRAAK K+ channel. Proc. Natl. Acad. Sci. USA 110, 2129–2134 (2013).
Lindorff-Larsen, K. et al. Improved side-chain torsion potentials for the Amber ff99SB protein force field. Proteins Struct. Funct. Bioinform. 78, 1950–1958 (2010).
Braun, E. et al. Best practices for foundations in molecular simulations [Article v1.0]. Living J. Comput. Mol. Sci. 1, 5957 (2019).
–ù–∞–ø–æ–Ω–æ–º-–∫–æ–Ω—Ç—Ä–æ–ª–∏—Å–∞–Ω–∏ L-—Ç–∏–ø /
Cav α (
1.1 ,
1.2 ,
1.3 ,
1.4 )
· N-тип /
Cav α2.2 · P-тип /
Cav α (
2.1 )
· Q-тип /
Cav α2.1 · R-тип /
Cav α2.3 · T-тип /
Cav α (
3.1 ,
3.2 ,
3.3 )
α2 δ-подјединица (
1 ,
2 )
· β-подјединица (
β1 ,
β2 ,
β3 ,
β4 )
· γ-подјединица (
γ1 ,
γ2 ,
γ3 ,
γ4 )
–ö–∞—Ç—ò–æ–Ω—Å–∫–∏ –∫–∞–Ω–∞–ª–∏ —Å–ø–µ—Ä–º–µ (
1 ,
2 ,
3 ,
4 )
· Двопорни канал (
1 ,
2 )
–õ–∏–≥–∞–Ω–¥–æ–º –∫–æ–Ω—Ç—Ä–æ–ª–∏—Å–∞–Ω–∏
Напоном-контролисани Nav α (
1.1 ,
1.2 ,
1.3 ,
1.4 ,
1.5 ,
1.6 ,
1.7 ,
1.8 ,
1.9 ,
7A )
· Nav β (
1 ,
2 ,
3 ,
4 )
–ö–æ–Ω—Å—Ç–∏—Ç—É—Ç–∏–≤–Ω–æ –∞–∫—Ç–∏–≤–Ω–∏
Напоном-контролисани Kv α1-6 (
1.1 ,
1.2 ,
1.3 ,
1.4 ,
1.5 ,
1.6 ,
1.7 ,
1.8 )
· (
2.1 ,
2.2 )
· (
3.1 ,
3.2 ,
3.3 ,
3.4 )
· (
4.1 ,
4.2 ,
4.3 )
· (
5.1 )
· (
6.1 ,
6.2 ,
6.3 ,
6.4 )
Kv α7-12 (
7.1 ,
7.2 ,
7.3 ,
7.4 ,
7.5 )
· (
8.1 ,
8.2 )
· (
9.1 ,
9.2 ,
9.3 )
· (
10.1 ,
10.2 )
· (
11.1/hERG ,
11.2 ,
11.3 )
· (
12.1 ,
12.2 ,
12.3 )
Kv β (
1 ,
2 ,
3 )
· KCNIP (
1 ,
2 ,
3 ,
4 )
· minK/ISK · minK/ISK-сличан · MiRP (
1 ,
2 ,
3 )
· Shaker ген Калцијумом-активирани БК канал (
α1 ,
β1 ,
β2 ,
β3 ,
β4 )
· SK канал (
SK1 ,
SK2 ,
SK3 ,
SK4 )
· KCa (
1.1 ,
2.1 ,
2.2 ,
2.3 ,
3.1 ,
4.1 ,
4.2 ,
5.1 )
Унутрашњи-исправљачи KATP · Kir (
1.1 ,
2.1 ,
2.2 ,
2.3 ,
2.4 ,
2.6 )
· GIRK /
Kir (
3.1 ,
3.2 ,
3.3 ,
3.4 )
· Kir (
4.1 ,
4.2 ,
5.1 ,
6.1 ,
6.2 ,
7.1 )
–î–æ–º–µ–Ω —Ç–∞–Ω–¥–µ–º–∞ –ø–æ—Ä–∞ K2P (
1 ,
2 ,
3 ,
4 ,
5 ,
6 ,
7 ,
9 ,
10 ,
12 ,
13 ,
15 ,
16 ,
17 ,
18 )
–î—Ä—É–≥–∏
M+ : TRP –∫–∞—Ç—ò–æ–Ω—Å–∫–∏ –∫–∞–Ω–∞–ª TRPA (
1 )
· TRPC (
1 ,
2 ,
3 ,
4 ,
4AP ,
5 ,
6 ,
7 )
· TRPM (
1 ,
2 ,
3 ,
4 ,
5 ,
6 ,
7 ,
8 )
· TRPML (
1 ,
2 ,
3 )
· TRPP (
1 ,
2 )
· TRPV (
1 ,
2 ,
3 ,
4 ,
5 ,
6 )
Cl- : Хлоридни канал ANO1 · Бестрофин (
1 ,
2 )
· CFTR · CLCA (
1 ,
2 ,
3 ,
4 )
· CLCN (
1 ,
2 ,
3 ,
4 ,
5 ,
6 ,
7 ,
KA ,
KB )
· CLIC (
1 ,
2 ,
3 ,
4 ,
5 ,
6 ,
L1 )
· CLNS (
1A ,
1B )
–¶–∏–∫–ª–∏—á–Ω–∏–º –Ω—É–∫–ª–µ–æ—Ç–∏–¥–æ–º-–∫–æ–Ω—Ç—Ä–æ–ª–∏—Å–∞–Ω–∏ (FC )–ü–æ—Ä–∏–Ω –ü—Ä–æ–ø—É—Å–Ω–∞ –≤–µ–∑–∞ –ö–æ–Ω–µ–∫—Å–∏–Ω : A (
GJA1 ,
GJA3 ,
GJA4 ,
GJA5 ,
GJA8 ,
GJA9 ,
GJA10 )
· B (
GJB1 ,
GJB2 ,
GJB3 ,
GJB4 ,
GJB5 ,
GJB6 ,
GJB7 )
· C (
GJC1 ,
GJC2 ,
GJC3 )
· D (
GJD2 ,
GJD3 ,
GJD4 )
· E (
GJE1 )
–ò–Ω–µ–∫—Å–∏–Ω –ì–µ–Ω–µ—Ä–∞–ª–Ω–æ
–ú–æ–ª–∏–º–æ –í–∞—Å, –æ–±—Ä–∞—Ç–∏—Ç–µ –ø–∞–∂—ö—É –Ω–∞ –≤–∞–∂–Ω–æ —É–ø–æ–∑–æ—Ä–µ—ö–µ –æ–±–ª–∞—Å—Ç–∏ –º–µ–¥–∏—Ü–∏–Ω–µ (–∑–¥—Ä–∞–≤—ô–∞) .