Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЄЯ«░Я»ЂЯ«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ
Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЄЯ«░Я»ЂЯ«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ (Oxygen difluoride) Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ OF2 Я«јЯ«ЕЯ»ЇЯ«▒ Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЇЯ«▒Я»Ђ Я«хЯ«ЙЯ«»Я»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»Ї Я«хЯ«┐Я«хЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ««Я»Ї Я«њЯ«░Я»Ђ Я«ЋЯ«ЕЯ«┐Я«« Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї Я«џЯ»ЄЯ«░Я»ЇЯ««Я««Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«фЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЕЯ»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»ЂЯ««Я»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї Я«ЄЯ«џЯ»ЇЯ«џЯ»ЄЯ«░Я»ЇЯ««Я««Я»Ї Я«ЁЯ«▒Я«┐Я«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│ Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«њЯ«ЕЯ»ЇЯ«▒Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЪЯ»ѕЯ«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«јЯ«ЕЯ»ЇЯ«▒ Я«фЯ»єЯ«»Я«░Я«ЙЯ«▓Я»ЂЯ««Я»Ї Я«ЄЯ«цЯ»Ђ Я«ЁЯ«┤Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«БЯ»ѕЯ«цЯ«┐Я«▒Я«ЕЯ»Ї Я«ЋЯ»ѓЯ«ЪЯ»Ђ Я«јЯ«▓Я«ЋЯ»ЇЯ«ЪЯ»ЇЯ«░Я«ЙЯ«ЕЯ»Ї Я«џЯ»ІЯ«ЪЯ«┐Я«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«цЯ«│Я»ЇЯ«│Я»ЂЯ«ЋЯ»ѕ Я«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ»ѕ Я«ЋЯ«БЯ«┐Я«цЯ»ЇЯ«цЯ»ЂЯ«│Я»ЇЯ«│Я«фЯ«ЪЯ«┐ Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЄЯ«░Я»ЂЯ«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«хЯ«│Я»ѕЯ«еЯ»ЇЯ«ц Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»ЇЯ«▒Я»Ђ Я«хЯ«ЪЯ«┐Я«хЯ«┐Я«»Я«▓Я»ѕ Я«ЈЯ«▒Я»ЇЯ«▒Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«цЯ»Ђ Я«њЯ«░Я»Ђ Я«хЯ«▓Я»ЂЯ«хЯ«ЙЯ«Е Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«┐Я«»Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«ЄЯ«цЯ»Є Я«ЋЯ«ЙЯ«░Я«БЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ«ЙЯ«Ћ Я«ЄЯ«░Я«ЙЯ«ЋЯ»ЇЯ«ЋЯ»єЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я«јЯ«░Я«┐Я«фЯ»іЯ«░Я»ЂЯ«│Я»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»ЂЯ««Я»Ї Я«ЄЯ«цЯ»Ђ Я«ЁЯ«▒Я«┐Я«хЯ«┐Я«»Я«▓Я«ЙЯ«│Я«░Я»ЇЯ«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«ЋЯ«хЯ«ЕЯ«цЯ»ЇЯ«цЯ»ѕ Я«ѕЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ.[2] Рѕњ144.75 ┬░ Я«џЯ»єЯ«▓Я»ЇЯ«џЯ«┐Я«»Я«џЯ»Ђ Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕ Я«јЯ«ЕЯ»ЇЯ«▒ Я«ЋЯ»іЯ«цЯ«┐Я«еЯ«┐Я«▓Я»ѕЯ«»Я»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ. OF2 Я«јЯ«ЕЯ»ЇЯ«фЯ«цЯ»Ђ Я«јЯ«│Я«┐Я«цЯ«┐Я«▓Я»Ї Я«єЯ«хЯ«┐Я«»Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї Я«џЯ»ЄЯ«░Я»ЇЯ««Я««Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«ЄЯ«цЯ»ѕ Я«јЯ«│Я«┐Я«цЯ«┐Я«▓Я»Ї Я«цЯ«ЕЯ«┐Я««Я»ѕЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐ Я«фЯ«┐Я«░Я«┐Я«цЯ»ЇЯ«цЯ»єЯ«ЪЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ«▓Я«ЙЯ««Я»Ї. Я««Я»ѓЯ«хЯ«БЯ»Ђ Я«џЯ»ЄЯ«░Я»ЇЯ««Я««Я«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«ЄЯ«џЯ»ЇЯ«џЯ»ЄЯ«░Я»ЇЯ««Я««Я»Ї Я«ЁЯ«▒Я«┐Я«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«цЯ«»Я«ЙЯ«░Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЄЯ«░Я»ЂЯ«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я««Я»ЂЯ«цЯ«ЕЯ»ЇЯ««Я»ЂЯ«цЯ«▓Я«┐Я«▓Я»Ї 1929 Я«єЯ««Я»Ї Я«єЯ«БЯ»ЇЯ«ЪЯ«┐Я«▓Я»Ї Я«ЋЯ«БЯ»ЇЯ«ЪЯ«▒Я«┐Я«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я«ЁЯ«▒Я«┐Я«хЯ«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«цЯ»Ђ. Я«ЅЯ«░Я»ЂЯ«ЋЯ«┐Я«» Я«фЯ»іЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«џЯ«┐Я«»Я««Я»Ї Я«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«љЯ«цЯ«░Я»ІЯ«фЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»ЂЯ««Я»Ї Я«џЯ«┐Я«▒Я«┐Я«цЯ«│Я«хЯ»Ђ Я«цЯ«БЯ»ЇЯ«БЯ»ђЯ«░Я»ЂЯ««Я»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ»Ђ Я««Я«┐Я«ЕЯ»ЇЯ«ЕЯ«ЙЯ«▒Я»ЇЯ«фЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЅЯ«ЪЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ«ЙЯ«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЄЯ«░Я»ЂЯ«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї.[3][4] Я«еЯ«хЯ»ђЯ«Е Я«цЯ«»Я«ЙЯ«░Я«┐Я«фЯ»ЇЯ«фЯ»Ђ Я«џЯ»ІЯ«ЪЯ«┐Я«»Я««Я»Ї Я«љЯ«цЯ«░Я«ЙЯ«ЋЯ»ЇЯ«џЯ»ѕЯ«ЪЯ«┐Я«ЕЯ»Ї Я«еЯ»ђЯ«░Я»ЇЯ«цЯ»ЇЯ«ц Я«ЋЯ«░Я»ѕЯ«џЯ«▓Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«фЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЕЯ»ѕЯ«џЯ»Ї Я«џЯ»ЄЯ«░Я»ЇЯ«цЯ»ЇЯ«цЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«»Я«џЯ»Ї Я«џЯ»єЯ«»Я»ЇЯ«цЯ»Ђ Я«цЯ«»Я«ЙЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»Ђ Я«еЯ«хЯ»ђЯ«Е Я«цЯ«»Я«ЙЯ«░Я«┐Я«фЯ»ЇЯ«фЯ»Ђ Я««Я»ЂЯ«▒Я»ѕЯ«»Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«џЯ»ІЯ«ЪЯ«┐Я«»Я««Я»Ї Я«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«ЊЯ«░Я»Ї Я«ЅЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«│Я»ѕЯ«фЯ»іЯ«░Я»ЂЯ«│Я«ЙЯ«Ћ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ:
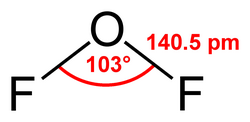
Я«ЋЯ«ЪЯ»ЇЯ«ЪЯ««Я»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЄЯ«░Я»ЂЯ«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«хЯ«│Я»ѕЯ«еЯ»ЇЯ«ц Я««Я»ѓЯ«▓Я«ЋЯ»ЇЯ«ЋЯ»ѓЯ«▒Я»Ђ Я«хЯ«ЪЯ«┐Я«хЯ«┐Я«»Я«▓Я»ѕ Я«ЈЯ«▒Я»ЇЯ«▒Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»іЯ«│Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. F-O-F Я«џЯ«ЋЯ«фЯ»Ї Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»Ї Я«фЯ«┐Я«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ»Ї Я«ЋЯ»ІЯ«БЯ««Я»Ї 103 Я«фЯ«ЙЯ«ЋЯ»ѕЯ«ЋЯ«│Я«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЁЯ«БЯ»ЂЯ«хЯ«┐Я«ЕЯ»Ї Я«ЄЯ«»Я«▓Я»ЇЯ«фЯ«ЙЯ«Е Рѕњ2 Я«јЯ«ЕЯ»ЇЯ«▒ Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«фЯ»Ї Я«фЯ«цЯ«┐Я«▓Я«ЙЯ«Ћ +2 Я«јЯ«ЕЯ»ЇЯ«▒ Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒ Я«јЯ«БЯ»ЇЯ«БЯ«ЙЯ«▓Я»Ї Я«њЯ«░Я»Ђ Я«џЯ«ЋЯ»ЇЯ«цЯ«┐Я«хЯ«ЙЯ«»Я»ЇЯ«еЯ»ЇЯ«ц Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«┐Я«»Я«ЙЯ«Ћ Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї Я«фЯ«БЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї200 ┬░Я«џЯ»єЯ«▓Я»ЇЯ«џЯ«┐Я«»Я«џЯ»Ђ Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я««Я»ЄЯ«▓Я»Ї Я«џЯ»ѓЯ«ЪЯ»ЂЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ«ЙЯ«▓Я»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЄЯ«░Я»ЂЯ«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЕЯ«ЙЯ«ЋЯ«џЯ»Ї Я«џЯ«┐Я«цЯ»ѕЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ.
OF2 Я«фЯ«▓ Я«ЅЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«єЯ«ЋЯ»ЇЯ«џЯ»ѕЯ«ЪЯ»ЂЯ«ЋЯ«│Я»Ї Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»ЂЯ«ЋЯ«│Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЁЯ«▓Я»ІЯ«ЋЯ«ЎЯ»ЇЯ«ЋЯ«│Я»ЂЯ««Я»Ї Я«ЄЯ«цЯ«ЕЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е: Я«фЯ«ЙЯ«џЯ»ЂЯ«фЯ«░Я«џЯ»Ђ OF2 Я«ЅЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ PF5 Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї POF3 Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«џЯ»ЄЯ«░Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ; Я«ЋЯ«еЯ»ЇЯ«цЯ«ЋЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ SO2 Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї SF4 Я«фЯ»ІЯ«ЕЯ»ЇЯ«▒ Я«џЯ»ЄЯ«░Я»ЇЯ««Я«ЎЯ»ЇЯ«ЋЯ«│Я»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ; Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я««Я«еЯ»ЇЯ«цЯ«хЯ«ЙЯ«»Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ«│Я»ѕЯ«фЯ»Ї Я«фЯ»іЯ«▒Я»ЂЯ«цЯ»ЇЯ«цЯ«хЯ«░Я»ѕ Я«хЯ«┤Я«ЋЯ»ЇЯ«ЋЯ«цЯ»ЇЯ«цЯ«┐Я«▒Я»ЇЯ«ЋЯ»Ђ Я««Я«ЙЯ«▒Я«ЙЯ«Ћ, Я«џЯ»єЯ«ЕЯ«ЙЯ«ЕЯ»Ї Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ»ЂЯ«ЪЯ«ЕЯ»Ї Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЅЯ«»Я«░Я»ЇЯ«еЯ»ЇЯ«ц Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЄЯ«џЯ»ЇЯ«џЯ»ЄЯ«░Я»ЇЯ««Я««Я»Ї XeF4 Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«џЯ»єЯ«ЕЯ«ЙЯ«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»ЂЯ«ЋЯ«│Я»ѕ Я«ЁЯ«│Я«┐Я«ЋЯ»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЄЯ«░Я»ЂЯ«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«цЯ«БЯ»ЇЯ«БЯ»ђЯ«░Я»ЂЯ«ЪЯ«ЕЯ»Ї Я««Я«┐Я«Ћ Я««Я»єЯ«цЯ»ЂЯ«хЯ«ЙЯ«Ћ Я«хЯ«┐Я«ЕЯ»ѕЯ«фЯ»ЂЯ«░Я«┐Я«еЯ»ЇЯ«цЯ»Ђ Я«љЯ«цЯ«░Я»ІЯ«фЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я«цЯ»ЇЯ«цЯ»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ:
Я«ЋЯ«еЯ»ЇЯ«цЯ«Ћ Я«ЪЯ»ѕ Я«єЯ«ЋЯ»ЇЯ«џЯ»ѕЯ«ЪЯ»ѕ Я«ЋЯ«еЯ»ЇЯ«цЯ«Ћ Я««Я»ѓЯ«хЯ«ЙЯ«ЋЯ»ЇЯ«џЯ»ѕЯ«ЪЯ«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«цЯ«ЕЯ«┐Я«« Я«фЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЕЯ«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я««Я»Ї Я«џЯ»єЯ«»Я»ЇЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ:
Я«ЄЯ«░Я»ЂЯ«фЯ»ЇЯ«фЯ«┐Я«ЕЯ»ЂЯ««Я»Ї, Я«фЯ»ЂЯ«▒ Я«іЯ«цЯ«Й Я«ЋЯ«цЯ«┐Я«░Я»ЇЯ«хЯ»ђЯ«џЯ»ЇЯ«џЯ«┐Я«ЕЯ»Ї Я««Я»ЂЯ«ЕЯ»ЇЯ«ЕЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї, Я«хЯ«┐Я«ЕЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«ѕЯ«ЪЯ»ЂЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«ЙЯ«▓Я»Ї Я«ЋЯ«еЯ»ЇЯ«цЯ«Ћ Я«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ (SO2F2) Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«фЯ»ѕЯ«░Я»ІЯ«џЯ«▓Я»ЇЯ«фЯ»ѓЯ«░Я»ѕЯ«▓Я»Ї Я«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ (S2O5F2) Я«єЯ«ЋЯ«┐Я«»Я«хЯ»ѕ Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ«┐Я«ЕЯ»ЇЯ«▒Я«Е:
Я«фЯ«ЙЯ«цЯ»ЂЯ«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ»ЂЯ«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЄЯ«░Я»ЂЯ«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«цЯ«ЕЯ»Ї Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»ЄЯ«▒Я»ЇЯ«▒Я«фЯ»Ї Я«фЯ«БЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї Я«ЋЯ«ЙЯ«░Я«БЯ««Я«ЙЯ«Ћ Я«њЯ«░Я»Ђ Я«фЯ«ЙЯ«цЯ»ЂЯ«ЋЯ«ЙЯ«фЯ»ЇЯ«фЯ«▒Я»ЇЯ«▒ Я«хЯ«ЙЯ«»Я»ЂЯ«хЯ«ЙЯ«Ћ Я«ЋЯ«░Я»ЂЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«еЯ»ђЯ«░Я»ЂЯ«ЪЯ«ЕЯ»Ї OF2 Я«џЯ»ЄЯ«░Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ»Ђ Я«еЯ»ђЯ«░Я«ЙЯ«▒Я»ЇЯ«фЯ«ЋЯ»ЂЯ«фЯ»ЇЯ«фЯ»Ђ Я«хЯ«┐Я«ЕЯ»ѕЯ«ЋЯ»ЇЯ«ЋЯ»Ђ Я«ЅЯ«ЪЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«┐Я«ЕЯ«ЙЯ«▓Я»Ї Я«ЅЯ«░Я»ЂЯ«хЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї Я«љЯ«цЯ«░Я»ІЯ«фЯ»ЂЯ«│Я»ІЯ«░Я«┐Я«ЋЯ»Ї Я«ЁЯ««Я«┐Я«▓Я««Я»Ї Я««Я«┐Я«ЋЯ«хЯ»ЂЯ««Я»Ї Я«ЁЯ«░Я«┐Я«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«цЯ«ЕЯ»ЇЯ««Я»ѕ Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«цЯ«ЙЯ«ЋЯ»ЂЯ««Я»Ї. Я««Я»ЄЯ«▓Я»ЂЯ««Я»Ї Я«ЄЯ«цЯ»Ђ Я«еЯ«џЯ»ЇЯ«џЯ»ЂЯ«цЯ»ЇЯ«цЯ«ЕЯ»ЇЯ««Я»ѕЯ«»Я»ЂЯ«ЪЯ»ѕЯ«»Я«цЯ«ЙЯ«ЋЯ«хЯ»ЂЯ««Я»Ї Я«ЁЯ«▒Я«┐Я«»Я«фЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«ЄЯ«┤Я»ѕЯ«»Я«еЯ«џЯ«┐Я«хЯ»Ђ Я«еЯ»ІЯ«»Я»ѕ Я«ЅЯ«БЯ»ЇЯ«ЪЯ«ЙЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«цЯ«┐Я«▒Я«ЕЯ»Ї Я«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ»ЂЯ«│Я»ЇЯ«│Я«цЯ»Ђ. Я«ЄЯ«цЯ«ЕЯ«ЙЯ«▓Я»Ї Я«јЯ«▓Я»ЂЯ««Я»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я«┐Я«▓Я»Ї Я«ЄЯ«░Я»ЂЯ«еЯ»ЇЯ«цЯ»Ђ Я«ЋЯ«ЙЯ«▓Я»ЇЯ«џЯ«┐Я«»Я««Я»Ї Я«хЯ»єЯ«│Я«┐Я«»Я»ЄЯ«▒Я»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ Я««Я«▒Я»ЇЯ«▒Я»ЂЯ««Я»Ї Я«ЄЯ«░Я»ЂЯ«цЯ«» Я«фЯ«ЙЯ«цЯ«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ»ЂЯ«ЋЯ«┐Я«▒Я«цЯ»Ђ. Я«фЯ«БЯ»ЇЯ«фЯ«ЙЯ«ЪЯ»ЇЯ«ЪЯ«┐Я«▓Я»ЇЯ«░Я«ЙЯ«фЯ«░Я»ЇЯ«ЪЯ»Ї Я«јЯ«▓Я»Ї. Я«фЯ«ЙЯ«░Я»ЇЯ«хЯ«░Я»ЇЯ«ЪЯ«┐Я«ЕЯ»Ї Я«ЁЯ«▒Я«┐Я«хЯ«┐Я«»Я«▓Я»Ї Я«фЯ»ЂЯ«ЕЯ»ѕЯ«ЋЯ«цЯ»ѕ Я«еЯ«ЙЯ«хЯ«▓Я«ЙЯ«Е Я«ЋЯ»ЄЯ««Я»ЇЯ«▓Я«ЙЯ«ЪЯ»Ї 30Я«ЋЯ»Є Я«еЯ«ЙЯ«хЯ«▓Я«┐Я«▓Я»Ї Я«џЯ»ѓЯ«░Я«┐Я«» Я««Я«БЯ»ЇЯ«ЪЯ«▓Я«цЯ»ЇЯ«цЯ«┐Я«ЕЯ»Ї Я«ЋЯ»ѕЯ«фЯ»ЇЯ«фЯ«░Я»Ї Я«фЯ«ЪЯ»ЇЯ«ЪЯ»ѕЯ«»Я«┐Я«▓Я»Ї Я«хЯ«ЙЯ«┤Я»ЂЯ««Я»Ї Я«ЋЯ«▒Я»ЇЯ«фЯ«ЕЯ»ѕЯ«»Я«ЙЯ«Е Я«хЯ«ЙЯ«┤Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»ѕ Я«хЯ«ЪЯ«┐Я«хЯ«ЎЯ»ЇЯ«ЋЯ«│Я«ЙЯ«▓Я»Ї, Я«єЯ«ЋЯ»ЇЯ«џЯ«┐Я«џЯ«ЕЯ»Ї Я«ЄЯ«░Я»ЂЯ«фЯ»ЂЯ«│Я»ІЯ«░Я»ѕЯ«ЪЯ»Ђ Я«ЊЯ«░Я»Ї Я«ЅЯ«»Я«┐Я«░Я»ЇЯ«хЯ»ЄЯ«цЯ«┐Я«»Я«┐Я«»Я«▓Я»Ї Я«ЋЯ«░Я»ѕЯ«фЯ»ЇЯ«фЯ«ЙЯ«ЕЯ«ЙЯ«ЋЯ«фЯ»Ї Я«фЯ«»Я«ЕЯ»ЇЯ«фЯ«ЪЯ»ЂЯ«цЯ»ЇЯ«цЯ«фЯ»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«цЯ»Ђ. OF2 30 Я«ЋЯ»єЯ«▓Я»ЇЯ«хЯ«┐Я«ЕЯ»Ї Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕЯ«»Я«┐Я«▓Я»Ї Я«ЄЯ«цЯ»Ђ Я«њЯ«░Я»Ђ Я«цЯ«┐Я«ЪЯ«фЯ»ЇЯ«фЯ»іЯ«░Я»ЂЯ«│Я«ЙЯ«Ћ Я«ЄЯ«░Я»ЂЯ«ЋЯ»ЇЯ«ЋЯ»ЂЯ««Я»Ї Я«фЯ»ІЯ«цЯ»Ђ, Я«ЋЯ«▒Я»ЇЯ«фЯ«ЕЯ»ѕЯ«»Я«ЙЯ«Е Я«хЯ»ЄЯ«▒Я»ЇЯ«▒Я»ЂЯ«ЋЯ«┐Я«░Я«ЋЯ«хЯ«ЙЯ«џЯ«┐Я«ЋЯ«│Я«┐Я«ЕЯ»Ї Я«хЯ«ЙЯ«┤Я»ЇЯ«ЋЯ»ЇЯ«ЋЯ»ѕ Я«хЯ«ЪЯ«┐Я«хЯ«ЎЯ»ЇЯ«ЋЯ«│Я»Ї Я«єЯ«▒Я»ЇЯ«▒Я«▓Я»Ї Я«ЈЯ«▒Я»ЇЯ«фЯ«┐Я«ЋЯ«│Я«ЙЯ«ЋЯ«џЯ»Ї Я«џЯ»єЯ«»Я«▓Я»ЇЯ«фЯ«ЪЯ»ЇЯ«ЪЯ«Е. Я«ЋЯ«цЯ«┐Я«░Я«┐Я«»Я«ЋЯ»ЇЯ«Ћ Я«хЯ»єЯ«фЯ»ЇЯ«фЯ««Я»ѓЯ«ЪЯ»ЇЯ«ЪЯ«▓Я»Ї Я««Я»ѓЯ«▓Я««Я»Ї Я«ЅЯ«»Я«░Я»ЇЯ«еЯ»ЇЯ«ц Я«ЅЯ«ЪЯ«▓Я»Ї Я«хЯ»єЯ«фЯ»ЇЯ«фЯ«еЯ«┐Я«▓Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«цЯ«┐Я«░Я«х OF2 Я«ЄЯ«░Я«цЯ»ЇЯ«цЯ«цЯ»ЇЯ«цЯ»ѕ Я«фЯ«░Я«ЙЯ««Я«░Я«┐Я«цЯ»ЇЯ«цЯ«▓Я»ѕЯ«»Я»ЂЯ««Я»Ї Я«ЄЯ«хЯ»ѕ Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ»іЯ«БЯ»ЇЯ«ЪЯ«Е. Я««Я»ЄЯ«▒Я»ЇЯ«ЋЯ»ІЯ«│Я»ЇЯ«ЋЯ«│Я»Ї
Я«ЋЯ»ЂЯ«▒Я«┐Я«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї
Я«фЯ»ЂЯ«▒ Я«ЄЯ«БЯ»ѕЯ«фЯ»ЇЯ«фЯ»ЂЯ«ЋЯ«│Я»Ї |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia