Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ìÓ«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì (Ôôÿ) (Sulphur) Ó«ÆÓ«░Ó»ü Ó«ñÓ«®Ó«┐Ó««Ó««Ó»ì Ó«åÓ«òÓ»üÓ««Ó»ì. Ó«çÓ«ñÓ«®Ó»ì Ó«òÓ»üÓ«▒Ó«┐Ó«»Ó»ÇÓ«ƒÓ»ü S. Ó«çÓ«ñÓ»ìÓ«ñÓ«®Ó«┐Ó««Ó«ñÓ»ìÓ«ñÓ«┐Ó«®Ó»ì Ó«àÓ«úÓ»ü Ó«ÄÓ«úÓ»ì 16. Ó«çÓ«ñÓ»ü Ó«¬Ó»üÓ«ÁÓ«┐Ó«»Ó«┐Ó«▓Ó»ì Ó««Ó«┐Ó«òÓ»üÓ«¿Ó»ìÓ«ñÓ»ü Ó«òÓ«┐Ó«ƒÓ»êÓ«òÓ»ìÓ«òÓ»üÓ««Ó»ì Ó«ÜÓ»üÓ«ÁÓ»êÓ«»Ó«▒Ó»ìÓ«▒ Ó«àÓ«▓Ó»ïÓ«òÓ««Ó»ì Ó«åÓ«òÓ»üÓ««Ó»ì. Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«çÓ«»Ó«▒Ó»ìÓ«òÓ»êÓ«»Ó«┐Ó«▓Ó»ì Ó««Ó«×Ó»ìÓ«ÜÓ«│Ó»ì Ó«¿Ó«┐Ó«▒Ó«¬Ó»ì Ó«¬Ó«ƒÓ«┐Ó«òÓ««Ó«¥Ó«òÓ«òÓ»ì Ó«òÓ«┐Ó«ƒÓ»êÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«àÓ«┤Ó»üÓ«òÓ«┐Ó«» Ó««Ó«úÓ««Ó»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ«ñÓ»ü. Ó«çÓ«ñÓ»ü Ó«çÓ«»Ó«▒Ó»ìÓ«òÓ»êÓ«»Ó«┐Ó«▓Ó»ì Ó«ñÓ«®Ó«┐Ó««Ó««Ó»ì Ó«åÓ«òÓ«ÁÓ»üÓ««Ó»ì Ó«¬Ó«▓ Ó«ñÓ«®Ó«┐Ó««Ó«ÖÓ»ìÓ«òÓ«│Ó»ïÓ«ƒÓ»ü Ó«ÜÓ»çÓ«░Ó»ìÓ«ÁÓ«ñÓ«¥Ó«▓Ó»ì Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ»ü, Ó«ÜÓ«▓Ó»ìÓ«¬Ó»çÓ«ƒÓ»ìÓ«ƒÓ»ü Ó«òÓ«®Ó«┐Ó««Ó«ÖÓ»ìÓ«òÓ«│Ó«¥Ó«òÓ«ÁÓ»üÓ««Ó»ì Ó«òÓ«┐Ó«ƒÓ»êÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü.[3] Ó«ÜÓ«¥Ó«ñÓ«¥Ó«░Ó«ú Ó«¿Ó«┐Ó«▓Ó»êÓ«»Ó«┐Ó«▓Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì, S8 Ó«ÄÓ«®Ó»üÓ««Ó»ì Ó«ÁÓ»çÓ«ñÓ«┐ Ó«ÁÓ«¥Ó«»Ó»ìÓ«¬Ó«¥Ó«ƒÓ»ìÓ«ƒÓ»êÓ«»Ó»üÓ«ƒÓ»êÓ«» Ó«ÄÓ«úÓ»ìÓ«úÓ«úÓ»ü Ó«ÁÓ«│Ó»êÓ«» Ó«ÜÓ»çÓ«░Ó»ìÓ««Ó«ñÓ»ìÓ«ñÓ»ê Ó«ëÓ«úÓ»ìÓ«ƒÓ«¥Ó«òÓ»ìÓ«òÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ëÓ«»Ó«┐Ó«░Ó»ì Ó«ÁÓ«¥Ó«┤Ó»ìÓ«òÓ»ìÓ«òÓ»êÓ«òÓ»ìÓ«òÓ»ü Ó««Ó«┐Ó«òÓ«ÁÓ»üÓ««Ó»ì Ó«çÓ«®Ó»ìÓ«▒Ó«┐Ó«»Ó««Ó»êÓ«»Ó«¥Ó«ñÓ«ñÓ»ü. Ó«àÓ««Ó«┐Ó«®Ó»ï Ó«àÓ««Ó«┐Ó«▓Ó«ÖÓ»ìÓ«òÓ«│Ó«┐Ó«▓Ó»üÓ««Ó»ì Ó«çÓ«ñÓ»ü Ó«òÓ«¥Ó«úÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ñÓ«®Ó«┐Ó««Ó««Ó«¥Ó«ò Ó«ÄÓ«░Ó«┐Ó««Ó«▓Ó»êÓ«òÓ»ì Ó«òÓ»üÓ«┤Ó««Ó»ìÓ«¬Ó»ü Ó«ëÓ«▒Ó»êÓ«¿Ó»ìÓ«ñ Ó«¬Ó«¥Ó«▒Ó»êÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«òÓ«┐Ó«ƒÓ»êÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü.[4] Ó«ÁÓ«┐Ó«»Ó«¥Ó«┤Ó«®Ó«┐Ó«®Ó»ì Ó«ñÓ»üÓ«úÓ»êÓ«òÓ»ì Ó«òÓ»ïÓ«│Ó«¥Ó«® Ó«ÉÓ«ôÓ«ÁÓ«┐Ó«▓Ó»ì (Io) Ó«ÄÓ«░Ó«┐Ó««Ó«▓Ó»êÓ«»Ó«┐Ó«▓Ó«┐Ó«░Ó»üÓ«¿Ó»ìÓ«ñÓ»ü Ó«ÁÓ»åÓ«│Ó«┐Ó«»Ó»çÓ«▒Ó«┐Ó«» Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«¬Ó»ì Ó«¬Ó»èÓ«░Ó»üÓ«ƒÓ»ìÓ«òÓ«│Ó»ì Ó«¬Ó«▓ Ó«¿Ó»éÓ«▒Ó»ü Ó«òÓ«┐Ó«▓Ó»ïÓ««Ó»ÇÓ«ƒÓ»ìÓ«ƒÓ«░Ó»ì Ó«ñÓ»éÓ«░Ó««Ó»ì Ó«ÁÓ«░Ó»ê Ó«ëÓ«▒Ó»êÓ«¿Ó»ìÓ«ñÓ»üÓ«│Ó»ìÓ«│Ó«ñÓ»ü.[5] Ó«àÓ«ñÓ«®Ó«¥Ó«▓Ó»ì Ó«àÓ«ñÓ»ü Ó«¬Ó«┐Ó«░Ó«òÓ«¥Ó«ÜÓ««Ó«¥Ó«® Ó«ÜÓ«┐Ó«ÁÓ«¬Ó»ìÓ«¬Ó»ü, Ó«ÜÓ»åÓ««Ó»ìÓ««Ó«×Ó»ìÓ«ÜÓ«│Ó»ì, Ó««Ó«×Ó»ìÓ«ÜÓ«│Ó»ì Ó«¿Ó«┐Ó«▒Ó«ñÓ»ìÓ«ñÓ«┐Ó«ƒÓ»ìÓ«ƒÓ»üÓ«òÓ»ìÓ«òÓ«│Ó»êÓ«¬Ó»ì Ó«¬Ó»åÓ«▒Ó»ìÓ«▒Ó»üÓ«│Ó»ìÓ«│Ó«ñÓ»ü. Ó«ÁÓ»åÓ«¬Ó»ìÓ«¬ Ó«¿Ó»ÇÓ«░Ó»ì Ó«èÓ«▒Ó»ìÓ«▒Ó»üÓ«òÓ»ìÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ÜÓ»çÓ«░Ó»ìÓ«¿Ó»ìÓ«ñÓ«┐Ó«░Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«¬Ó»åÓ«ƒÓ»ìÓ«░Ó»ïÓ«▓Ó«┐Ó«» Ó«ÄÓ«úÓ»ìÓ«úÓ»åÓ«»Ó»ì Ó««Ó«▒Ó»ìÓ«▒Ó»üÓ««Ó»ì Ó«ÄÓ«░Ó«┐ Ó«ÁÓ«│Ó«┐Ó««Ó«ñÓ»ìÓ«ñÓ»ïÓ«ƒÓ»ü Ó«òÓ«▓Ó«¿Ó»ìÓ«ñÓ«┐Ó«░Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü.[6] Ó«çÓ«ñÓ»ü Ó«ÁÓ«úÓ«┐Ó«ò Ó«¿Ó»ïÓ«òÓ»ìÓ«òÓ«┐Ó«▓Ó»ì, Ó«ëÓ«░Ó««Ó»ì, Ó«ÁÓ»åÓ«ƒÓ«┐Ó««Ó«░Ó»üÓ«¿Ó»ìÓ«ñÓ»ü, Ó«ñÓ»ÇÓ«òÓ»ìÓ«òÓ»üÓ«ÜÓ»ìÓ«ÜÓ«┐, Ó«¬Ó»éÓ«ÜÓ»ìÓ«ÜÓ«┐Ó«òÓ»ìÓ«òÓ»èÓ«▓Ó»ìÓ«▓Ó«┐ Ó«¬Ó»ïÓ«®Ó»ìÓ«▒Ó«ÁÓ«▒Ó»ìÓ«▒Ó«┐Ó«®Ó»ì Ó«ñÓ«»Ó«¥Ó«░Ó«┐Ó«¬Ó»ìÓ«¬Ó«┐Ó«▓Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü.[7][8] Ó«ÁÓ«░Ó«▓Ó«¥Ó«▒Ó»üÓ«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ñÓ«®Ó«┐Ó«ñÓ»ìÓ«ñÓ»üÓ««Ó»ì, Ó«ÜÓ»çÓ«░Ó»ìÓ««Ó««Ó«¥Ó«òÓ«ÁÓ»üÓ««Ó»ì Ó«¬Ó»éÓ««Ó«┐Ó«»Ó«┐Ó«▓Ó»ì Ó«òÓ«┐Ó«ƒÓ»êÓ«¬Ó»ìÓ«¬Ó«ñÓ«¥Ó«▓Ó»ì Ó«çÓ«ñÓ»ê Ó«ÁÓ»çÓ«ñÓ«┐Ó«ñÓ»ì Ó«ñÓ«®Ó«┐Ó««Ó««Ó«¥Ó«ò Ó«àÓ«▒Ó«┐Ó«ÁÓ«ñÓ«▒Ó»ìÓ«òÓ»ü Ó«ÁÓ»åÓ«òÓ»ü Ó«òÓ«¥Ó«▓Ó««Ó»ì Ó««Ó»üÓ«®Ó»ìÓ«¬Ó»ç Ó««Ó«òÓ»ìÓ«òÓ«│Ó»ì Ó«çÓ«ñÓ»êÓ«¬Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«ñÓ»ì Ó«ñÓ»åÓ«░Ó«┐Ó«¿Ó»ìÓ«ñÓ«┐Ó«░Ó»üÓ«¿Ó»ìÓ«ñÓ«®Ó«░Ó»ì. Ó«òÓ«┐Ó«░Ó»çÓ«òÓ»ìÓ«òÓ«░Ó»ìÓ«òÓ«│Ó»üÓ««Ó»ì, Ó«░Ó»ïÓ««Ó«░Ó»ìÓ«òÓ«│Ó»üÓ««Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»ê Ó«¬Ó»üÓ«òÓ»ê Ó«ëÓ«úÓ»ìÓ«ƒÓ«¥Ó«òÓ»ìÓ«òÓ«¬Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó«¥Ó«░Ó»ìÓ«òÓ«│Ó»ì.[9][10] Ó«ÁÓ»ÇÓ«ƒÓ»ìÓ«ƒÓ«┐Ó«▓Ó»ì Ó«ñÓ»èÓ«▒Ó»ìÓ«▒Ó»üÓ«¿Ó»ïÓ«»Ó»ìÓ«òÓ»ì Ó«òÓ«┐Ó«░Ó»üÓ««Ó«┐Ó«òÓ«│Ó»êÓ«òÓ»ì Ó«òÓ»èÓ«▓Ó»ìÓ«▓ Ó«çÓ«¬Ó»ìÓ«¬Ó»üÓ«òÓ»êÓ«»Ó»ê Ó«ÄÓ«┤Ó»üÓ«¬Ó»ìÓ«¬Ó«┐Ó«®Ó«¥Ó«░Ó»ìÓ«òÓ«│Ó»ì.[11][12][13] Ó«òÓ«░Ó«┐Ó««Ó««Ó»ì Ó«¬Ó»ïÓ«▓Ó»ì Ó«ÁÓ«¥Ó«® Ó«ÁÓ»çÓ«ƒÓ«┐Ó«òÓ»ìÓ«òÓ»êÓ«¬Ó»ì Ó«¬Ó»èÓ«░Ó»üÓ«ƒÓ»ìÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«çÓ«ñÓ»êÓ«¬Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«┐Ó«»Ó»üÓ«│Ó»ìÓ«│Ó«®Ó«░Ó»ì. Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì, Ó«òÓ«░Ó«┐Ó«ñÓ»ìÓ«ñÓ»éÓ«│Ó»ì, Ó«ÜÓ«¥Ó«▓Ó»ìÓ«ƒÓ»ìÓ«¬Ó»ÇÓ«ƒÓ»ìÓ«ƒÓ«░Ó»ì (Potassium Nitrate) Ó«çÓ«ÁÓ«▒Ó»ìÓ«▒Ó»ê 1:2 :6 Ó«ÄÓ«®Ó»ìÓ«▒ Ó«ÁÓ«┐Ó«òÓ«┐Ó«ñÓ«ñÓ»ìÓ«ñÓ«┐Ó«▓Ó»ì Ó«òÓ«▓Ó«¿Ó»ìÓ«ñÓ»ü Ó«ñÓ»üÓ«¬Ó»ìÓ«¬Ó«¥Ó«òÓ»ìÓ«òÓ«┐Ó«òÓ«│Ó«┐Ó«▓Ó»ì Ó«ÁÓ»åÓ«ƒÓ«┐Ó««Ó«░Ó»üÓ«¿Ó»ìÓ«ñÓ«¥Ó«òÓ«¬Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó«░Ó»ì. Ó«çÓ«ñÓ»ü Ó«çÓ«®Ó»ìÓ«▒Ó»êÓ«» Ó«ÜÓ»çÓ«░Ó»ìÓ««Ó«¥Ó«® Ó«ÁÓ«┐Ó«òÓ«┐Ó«ñÓ«ñÓ»ìÓ«ñÓ«┐Ó«▓Ó«┐Ó«░Ó»üÓ«¿Ó»ìÓ«ñÓ»ü Ó«ÜÓ«┐Ó«▒Ó«┐Ó«ñÓ»ç Ó««Ó«¥Ó«▒Ó»üÓ«¬Ó«ƒÓ»ìÓ«ƒÓ«ñÓ«¥Ó«òÓ»üÓ««Ó»ì. Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó»ì Ó«ñÓ«®Ó«┐Ó«ñÓ»ì Ó«ñÓ«®Ó»ìÓ««Ó»êÓ«»Ó»ê Ó«àÓ«¿Ó»ìÓ«ñÓ»üÓ«ÁÓ«¥Ó«®Ó»ì Ó«çÓ«▓Ó«ÁÓ«¥Ó«ÜÓ«┐Ó«»Ó»ç Ó«ñÓ»åÓ«░Ó«┐Ó«»Ó«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó«¥Ó«░Ó»ì.[14] Ó«ÜÓ«▓Ó»ìÓ«¬Ó«░Ó»ì[15] Ó«ÄÓ«®Ó»ìÓ«▒ Ó«¬Ó»åÓ«»Ó«░Ó«┐Ó«®Ó»ì Ó««Ó»éÓ«▓Ó««Ó»ì ÔÇÿÓ«ÜÓ»üÓ«▓Ó»ìÓ«ÁÓ«¥Ó«░Ó«┐ÔÇÖ Ó«ÄÓ«®Ó»ìÓ«▒ Ó«ÁÓ«ƒÓ««Ó»èÓ«┤Ó«┐Ó«ÜÓ»ì Ó«ÜÓ»èÓ«▓Ó»ìÓ«▓Ó«¥Ó«òÓ»üÓ««Ó»ì. Ó«ÜÓ»åÓ«¬Ó»ìÓ«¬Ó»êÓ«»Ó»üÓ««Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»êÓ«»Ó»üÓ««Ó»ì Ó«ÜÓ»çÓ«░Ó»ìÓ«ñÓ»ìÓ«ñÓ»ü Ó«ÜÓ»éÓ«ƒÓ»üÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ»üÓ««Ó»ì Ó«¬Ó»ïÓ«ñÓ»ü Ó«ÜÓ»åÓ««Ó»ìÓ«¬Ó»ü Ó«àÓ«┤Ó«┐Ó«òÓ«┐Ó«®Ó»ìÓ«▒ Ó«òÓ«¥Ó«░Ó«úÓ«ñÓ»ìÓ«ñÓ«¥Ó«▓Ó»ì Ó«çÓ«ñÓ«▒Ó»ìÓ«òÓ»üÓ«ÜÓ»ì 'Ó«ÜÓ»åÓ«¬Ó»ìÓ«¬Ó«┐Ó«®Ó»ì Ó«ÄÓ«ñÓ«┐Ó«░Ó«┐ ' Ó«ÄÓ«®Ó»ìÓ«▒Ó»ü Ó«¬Ó»åÓ«»Ó«░Ó»ì Ó«ÁÓ»êÓ«ñÓ»ìÓ«ñÓ«®Ó«░Ó»ì. Ó«çÓ«ñÓ»ü Ó«çÓ«▓Ó«ñÓ»ìÓ«ñÓ»ÇÓ«®Ó»ì Ó««Ó»èÓ«┤Ó«┐Ó«»Ó«┐Ó«▓Ó»ì ÔÇÿÓ«ÜÓ«▓Ó»ìÓ«¬Ó»éÓ«░Ó«┐Ó«»Ó««Ó»ìÔÇÖ Ó«ÄÓ«®Ó«¬Ó»ì Ó«¬Ó»åÓ«»Ó«░Ó»ì Ó««Ó«¥Ó«▒Ó»ìÓ«▒Ó««Ó»ì Ó«¬Ó»åÓ«▒Ó»ìÓ«▒Ó«ñÓ»ü.[16] Ó«¬Ó«úÓ»ìÓ«¬Ó»üÓ«òÓ«│Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì, Ó«ÁÓ»åÓ«│Ó«┐Ó«░Ó»ì Ó««Ó«×Ó»ìÓ«ÜÓ«│Ó»ì Ó«¿Ó«┐Ó«▒Ó««Ó»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒ, Ó««Ó«úÓ««Ó«▒Ó»ìÓ«▒, Ó«ÄÓ«│Ó«┐Ó«ñÓ«┐Ó«▓Ó»ì Ó«ëÓ«ƒÓ»êÓ«¿Ó»ìÓ«ñÓ»ü Ó«¿Ó»èÓ«░Ó»üÓ«ÖÓ»ìÓ«òÓ«òÓ»ì Ó«òÓ»éÓ«ƒÓ«┐Ó«» Ó«ñÓ«┐Ó«úÓ»ìÓ««Ó««Ó«¥Ó«òÓ»üÓ««Ó»ì. Ó«çÓ«ñÓ»ü Ó«¿Ó»ÇÓ«░Ó«┐Ó«▓Ó»ì Ó«òÓ«░Ó»êÓ«ÁÓ«ñÓ«┐Ó«▓Ó»ìÓ«▓Ó»ê Ó«ÄÓ«®Ó»ìÓ«▒Ó«¥Ó«▓Ó»üÓ««Ó»ì Ó«òÓ«¥Ó«░Ó»ìÓ«¬Ó«®Ó»ì Ó«ƒÓ»ê Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ«┐Ó«▓Ó»ì Ó«òÓ«░Ó»êÓ«òÓ«┐Ó«▒Ó«ñÓ»ü.[17] S Ó«ÄÓ«®Ó»ìÓ«▒ Ó«ÁÓ»çÓ«ñÓ«┐Ó«òÓ»ì Ó«òÓ»üÓ«▒Ó«┐Ó«»Ó»ÇÓ«ƒÓ»ìÓ«ƒÓ»üÓ«ƒÓ«®Ó»ì Ó«òÓ»éÓ«ƒÓ«┐Ó«» Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó»ì Ó«àÓ«úÓ»ü Ó«ÄÓ«úÓ»ì 16; Ó«àÓ«úÓ»ü Ó«¿Ó«┐Ó«▒Ó»ê 32.06;Ó«àÓ«ƒÓ«░Ó»ìÓ«ñÓ»ìÓ«ñÓ«┐ 2070 Ó«òÓ«┐Ó«òÓ«┐/Ó«òÓ««Ó»Ç. Ó«çÓ«ñÓ«®Ó»ì Ó«ëÓ«░Ó»üÓ«òÓ»ü Ó«¿Ó«┐Ó«▓Ó»êÓ«»Ó»üÓ««Ó»ì, Ó«òÓ»èÓ«ñÓ«┐ Ó«¿Ó«┐Ó«▓Ó»êÓ«»Ó»üÓ««Ó»ì Ó««Ó»üÓ«▒Ó»êÓ«»Ó»ç 386 K(113 ┬░C), 717.8 K(445 ┬░C) Ó«åÓ«òÓ»üÓ««Ó»ì. Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó««Ó«┐Ó«®Ó»ìÓ«ÜÓ«¥Ó«░Ó«ñÓ»ìÓ«ñÓ»êÓ«»Ó»üÓ««Ó»ì, Ó«ÁÓ»åÓ«¬Ó»ìÓ«¬Ó«ñÓ»ìÓ«ñÓ»êÓ«»Ó»üÓ««Ó»ì Ó««Ó«┐Ó«òÓ«òÓ»ì Ó«òÓ»üÓ«▒Ó»êÓ«ÁÓ«¥Ó«òÓ«òÓ»ì Ó«òÓ«ƒÓ«ñÓ»ìÓ«ñÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«çÓ«ñÓ»ü Ó«òÓ«¥Ó«▒Ó»ìÓ«▒Ó»ü Ó«ÁÓ»åÓ«│Ó«┐Ó«»Ó«┐Ó«▓Ó»ì Ó«¿Ó»ÇÓ«▓ Ó«¿Ó«┐Ó«▒ Ó«ÜÓ»üÓ«ÁÓ«¥Ó«▓Ó»êÓ«»Ó»üÓ«ƒÓ«®Ó»üÓ««Ó»ì Ó«åÓ«òÓ»ìÓ«ÜÓ«┐Ó«£Ó«®Ó»ì Ó«ÁÓ»åÓ«│Ó«┐Ó«»Ó«┐Ó«▓Ó»ì Ó«àÓ«ÁÓ»üÓ«░Ó«┐ Ó«¿Ó»ÇÓ«▓ Ó«¿Ó«┐Ó«▒ Ó«ÜÓ»üÓ«ÁÓ«¥Ó«▓Ó»êÓ«»Ó»üÓ«ƒÓ«®Ó»üÓ««Ó»ì Ó«ÄÓ«░Ó«┐Ó«¿Ó»ìÓ«ñÓ»ü Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«ƒÓ»ê Ó«åÓ«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»ü, Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«ƒÓ»ìÓ«░Ó»ê Ó«åÓ«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»ü Ó«¬Ó»ïÓ«®Ó»ìÓ«▒ Ó«ÁÓ«│Ó«┐Ó««Ó«ÖÓ»ìÓ«òÓ«│Ó»ê Ó«ÁÓ»åÓ«│Ó«┐Ó«»Ó»çÓ«▒Ó»ìÓ«▒Ó»üÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«ñÓ»ü Ó«ÜÓ»éÓ«ƒÓ»ü Ó«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó«¥Ó«▓Ó»ì Ó«ñÓ«ÖÓ»ìÓ«òÓ««Ó»ì, Ó«¬Ó«┐Ó«│Ó«¥Ó«ƒÓ»ìÓ«ƒÓ«┐Ó«®Ó««Ó»ì, Ó«çÓ«░Ó«┐Ó«ƒÓ«┐Ó«»Ó««Ó»ì Ó«ñÓ«ÁÓ«┐Ó«░Ó»ìÓ«ñÓ»ìÓ«ñ Ó«¬Ó«┐Ó«▒ Ó«ëÓ«▓Ó»ïÓ«òÓ«ÖÓ»ìÓ«òÓ«│Ó»üÓ«ƒÓ«®Ó»ì Ó«çÓ«úÓ»êÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«ÜÓ»åÓ«¬Ó»ìÓ«¬Ó»ü, Ó«çÓ«░Ó»üÓ««Ó»ìÓ«¬Ó»üÓ«ƒÓ«®Ó»ì Ó«ÜÓ»çÓ«░Ó»üÓ««Ó»ìÓ«¬Ó»ïÓ«ñÓ»ü Ó«ÜÓ»üÓ«ƒÓ«░Ó»èÓ«│Ó«┐ Ó«ÁÓ»ÇÓ«ÜÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«ñÓ«┐Ó«úÓ»ìÓ««, Ó«¿Ó»ÇÓ«░Ó»ìÓ«« Ó««Ó«▒Ó»ìÓ«▒Ó»üÓ««Ó»ì Ó«ÁÓ«│Ó«┐Ó«« Ó«¿Ó«┐Ó«▓Ó»êÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«ñÓ«®Ó«┐Ó««Ó«òÓ»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«¬Ó«▓ Ó«ÁÓ»çÓ«▒Ó»ìÓ«▒Ó»üÓ«░Ó»üÓ«òÓ»ìÓ«òÓ«│Ó»êÓ«òÓ»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ»üÓ«│Ó»ìÓ«│Ó«ñÓ»ü.[18] Ó«çÓ«ñÓ»ü Ó«àÓ«ñÓ«®Ó»ì Ó«ÁÓ«ƒÓ«┐Ó«ÁÓ«ÖÓ»ìÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«¬Ó«▓Ó»ìÓ«ÁÓ»çÓ«▒Ó»ü Ó««Ó«¥Ó«▒Ó»ìÓ«▒Ó«ÖÓ»ìÓ«òÓ«│Ó»ê Ó«ÅÓ«▒Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ»üÓ«ÁÓ«ñÓ«▒Ó»ìÓ«òÓ»üÓ«òÓ»ì Ó«òÓ«¥Ó«░Ó«úÓ««Ó«¥Ó«ò Ó«çÓ«░Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü.[19] Ó«ÜÓ«¥Ó«»Ó»ì Ó«ÜÓ«ñÓ»üÓ«░Ó««Ó»üÓ«òÓ«┐ Ó«àÓ«▓Ó»ìÓ«▓Ó«ñÓ»ü Ó«ÄÓ«úÓ»ìÓ««Ó»üÓ«òÓ«┐[19] (Rhombic or octohedral) Ó«àÓ«▓Ó»ìÓ«▓Ó«ñÓ»ü Ó«åÓ«▓Ó»ìÓ«¬Ó«¥ Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ÄÓ«®Ó»ìÓ«▒ Ó«ÁÓ»çÓ«▒Ó»ìÓ«▒Ó»üÓ«░Ó»üÓ«ÁÓ»êÓ«¬Ó»ì Ó«¬Ó»åÓ«▒ Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»êÓ«òÓ»ì Ó«òÓ«¥Ó«░Ó»ìÓ«¬Ó«®Ó»ì Ó«ƒÓ»ê Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ«┐Ó«▓Ó»ì Ó«òÓ«░Ó»êÓ«ñÓ»ìÓ«ñÓ»ü Ó«ÁÓ«ƒÓ«┐Ó«òÓ«ƒÓ»ìÓ«ƒÓ«┐ Ó«òÓ«¥Ó«▒Ó»ìÓ«▒Ó«┐Ó«▓Ó»ì Ó«ëÓ«▓Ó«░Ó«ÁÓ»êÓ«ñÓ»ìÓ«ñÓ»üÓ«¬Ó»ì Ó«¬Ó»åÓ«▒Ó»üÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«¥Ó«░Ó»ìÓ«òÓ«│Ó»ì.[17][20] Ó«çÓ«ñÓ»ü Ó«ÁÓ»åÓ«│Ó«┐Ó«░Ó»ì Ó««Ó«×Ó»ìÓ«ÜÓ«│Ó»ì Ó«¿Ó«┐Ó«▒Ó«¬Ó»ì Ó«¬Ó«ƒÓ«┐Ó«òÓ««Ó«¥Ó«òÓ«ÁÓ»üÓ««Ó»ì 2060 Ó«òÓ«┐Ó«òÓ«┐/Ó«òÓ««Ó»Ç Ó«ÄÓ«®Ó»ìÓ«▒ Ó«àÓ«│Ó«ÁÓ«┐Ó«▓Ó»ì Ó«àÓ«ƒÓ«░Ó»ìÓ«ñÓ»ìÓ«ñÓ«┐ Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ«ñÓ«¥Ó«òÓ«ÁÓ»üÓ««Ó»ì 112.8 ┬░C Ó«ëÓ«░Ó»üÓ«òÓ»ü Ó«¿Ó«┐Ó«▓Ó»êÓ«»Ó»üÓ««Ó»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ«┐Ó«░Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«çÓ«ñÓ»ü Ó«àÓ«▒Ó»ê Ó«ÁÓ»åÓ«¬Ó»ìÓ«¬ Ó«¿Ó«┐Ó«▓Ó»êÓ«»Ó«┐Ó«▓Ó»ì Ó«¿Ó«┐Ó«▓Ó»êÓ«»Ó«¥Ó«ò Ó«çÓ«░Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. 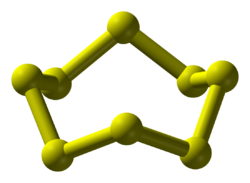 Ó«ÆÓ«▒Ó»ìÓ«▒Ó»êÓ«ÜÓ»ì Ó«ÜÓ«¥Ó«»Ó»ìÓ«ÁÓ»üÓ«ƒÓ»êÓ«» (Monoclinic) Ó«àÓ«▒Ó»üÓ«ÖÓ»ìÓ«òÓ»ïÓ«úÓ««Ó»üÓ«òÓ«┐ (Prismatic) Ó«àÓ«▓Ó»ìÓ«▓Ó«ñÓ»ü Ó«¬Ó»ÇÓ«ƒÓ»ìÓ«ƒÓ«¥ Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ÄÓ«®Ó»ìÓ«▒ Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»ê Ó«àÓ«ñÓ«®Ó»ì Ó«ëÓ«░Ó»üÓ«òÓ»ü Ó«¿Ó«┐Ó«▓Ó»êÓ«»Ó«┐Ó«▓Ó»ì Ó«ëÓ«░Ó»üÓ«òÓ»ìÓ«òÓ«┐ Ó«¬Ó»üÓ«▒Ó«¬Ó»ìÓ«¬Ó«░Ó«¬Ó»ìÓ«¬Ó»ü Ó«ëÓ«▒Ó»êÓ«»Ó»üÓ««Ó«¥Ó«▒Ó»ü Ó«òÓ»üÓ«│Ó«┐Ó«░Ó»ìÓ«ÁÓ«┐Ó«ñÓ»ìÓ«ñÓ»ü Ó«ñÓ«┐Ó«úÓ»ìÓ««Ó««Ó«¥Ó«»Ó»ì Ó«ëÓ«▒Ó»êÓ«¿Ó»ìÓ«ñ Ó«¬Ó«òÓ»üÓ«ñÓ«┐Ó«»Ó«┐Ó«▓Ó»ì Ó«ÆÓ«░Ó»ü Ó«ÜÓ«┐Ó«▒Ó«┐Ó«» Ó«ñÓ»üÓ«│Ó»êÓ«»Ó«┐Ó«ƒ Ó«àÓ«ñÓ«®Ó»ì Ó«ÁÓ«┤Ó«┐Ó«»Ó«¥Ó«ò Ó«ÁÓ»åÓ«│Ó«┐Ó«»Ó»çÓ«▒Ó»üÓ«¬Ó«ƒÓ«┐ Ó«ÜÓ»åÓ«»Ó»ìÓ«ÁÓ«¥Ó«░Ó»ìÓ«òÓ«│Ó»ì. Ó«çÓ«ñÓ»ü Ó«òÓ»èÓ«│Ó»ìÓ«òÓ«▓Ó«®Ó«┐Ó«®Ó»ì Ó«ÜÓ»üÓ«ÁÓ«░Ó»ìÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«èÓ«ÜÓ«┐Ó«¬Ó»ì Ó«¬Ó«ƒÓ«┐Ó«ÁÓ»üÓ«òÓ«│Ó«¥Ó«òÓ«¬Ó»ì Ó«¬Ó«ƒÓ«┐Ó«»Ó»üÓ««Ó»ì. Ó«çÓ«ñÓ«®Ó»ì Ó«¿Ó«┐Ó«▒Ó««Ó»ì Ó«ÜÓ«▒Ó»ìÓ«▒Ó»ü Ó«àÓ«┤Ó»üÓ«ñÓ»ìÓ«ñÓ««Ó«¥Ó«® Ó««Ó«×Ó»ìÓ«ÜÓ«│Ó«¥Ó«ò Ó«ëÓ«│Ó»ìÓ«│Ó«ñÓ»ü. Ó«àÓ«ƒÓ«░Ó»ìÓ«ñÓ»ìÓ«ñÓ«┐ Ó«ÜÓ«▒Ó»ìÓ«▒Ó»ü Ó«òÓ»üÓ«▒Ó»êÓ«¿Ó»ìÓ«ñÓ»ü 1960 Ó«òÓ«┐Ó«òÓ«┐/Ó«òÓ««Ó»Ç Ó«åÓ«òÓ«ÁÓ»üÓ««Ó»ì, Ó«ëÓ«░Ó»üÓ«òÓ»ü Ó«¿Ó«┐Ó«▓Ó»ê Ó«ÜÓ«▒Ó»ìÓ«▒Ó»ü Ó«àÓ«ñÓ«┐Ó«òÓ«░Ó«┐Ó«ñÓ»ìÓ«ñÓ»ü 119.25 ┬░C Ó«åÓ«òÓ«ÁÓ»üÓ««Ó»ì Ó«ëÓ«│Ó»ìÓ«│Ó«ñÓ»ü. Ó«¿Ó»åÓ«òÓ«┐Ó«┤Ó»ìÓ««Ó«òÓ»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«àÓ«▓Ó»ìÓ«▓Ó«ñÓ»ü Ó«òÓ«¥Ó««Ó«¥Ó«òÓ»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«çÓ«░Ó«¬Ó»ìÓ«¬Ó«░Ó»ì Ó«¬Ó»ïÓ«®Ó»ìÓ«▒ Ó«ñÓ«®Ó»ìÓ««Ó»êÓ«»Ó»êÓ«»Ó»üÓ««Ó»ì Ó«ÆÓ«│Ó«┐ Ó«èÓ«ƒÓ»üÓ«░Ó»üÓ«ÁÓ«┐Ó«ÜÓ»ì Ó«ÜÓ»åÓ«▓Ó»ìÓ«▓Ó«òÓ»ì Ó«òÓ»éÓ«ƒÓ«┐Ó«» Ó«ñÓ«®Ó»ìÓ««Ó»êÓ«»Ó»êÓ«»Ó»üÓ««Ó»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ»üÓ«│Ó»ìÓ«│Ó«ñÓ»ü. Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»ê Ó«ëÓ«»Ó«░Ó»ì Ó«ÁÓ»åÓ«¬Ó»ìÓ«¬ Ó«¿Ó«┐Ó«▓Ó»êÓ«òÓ»ìÓ«òÓ»ü Ó«ëÓ«░Ó»üÓ«òÓ»ìÓ«òÓ«┐ Ó«ñÓ«┐Ó«ƒÓ»ÇÓ«░Ó»åÓ«®Ó»ìÓ«▒Ó»ü Ó«òÓ»üÓ«│Ó«┐Ó«░Ó»ì Ó«¿Ó»ÇÓ«░Ó«┐Ó«▓Ó»ì Ó«òÓ»üÓ«│Ó«┐Ó«░Ó»ìÓ«ÁÓ«┐Ó«ñÓ»ìÓ«ñÓ»ü Ó«çÓ«ñÓ»êÓ«¬Ó»ì Ó«¬Ó»åÓ«▒Ó»üÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«¥Ó«░Ó»ìÓ«òÓ«│Ó»ì. Ó«çÓ«ñÓ«®Ó»ì Ó«àÓ«ƒÓ«░Ó»ìÓ«ñÓ»ìÓ«ñÓ«┐ 1920 Ó«òÓ«┐Ó«òÓ«┐/Ó«òÓ««Ó»Ç. Ó«çÓ«ñÓ»ü Ó«¬Ó«┐Ó«▒ Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«ÁÓ»çÓ«▒Ó»ìÓ«▒Ó»üÓ«░Ó»üÓ«òÓ»ìÓ«òÓ«│Ó»êÓ«¬Ó»ì Ó«¬Ó»ïÓ«▓ Ó«òÓ«¥Ó«░Ó»ìÓ«¬Ó«®Ó»ì Ó«ƒÓ»ê Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ«┐Ó«▓Ó»ì Ó«òÓ«░Ó»êÓ«ÁÓ«ñÓ«┐Ó«▓Ó»ìÓ«▓Ó»ê. Ó«¿Ó»ÇÓ«úÓ»ìÓ«ƒ Ó«¿Ó»çÓ«░ Ó«¬Ó«ƒÓ»ü Ó«¿Ó«┐Ó«▓Ó»êÓ«òÓ»ìÓ«òÓ»üÓ«¬Ó»ì Ó«¬Ó«┐Ó«®Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ÆÓ«│Ó«┐Ó«¬Ó»üÓ«òÓ«¥Ó«ñ, Ó«ëÓ«ƒÓ»êÓ«¿Ó»ìÓ«ñÓ»ü Ó«¿Ó»èÓ«░Ó»üÓ«ÖÓ»ìÓ«òÓ«òÓ»ì Ó«òÓ»éÓ«ƒÓ«┐Ó«» Ó«ÁÓ»åÓ«│Ó«┐Ó«░Ó»ì Ó««Ó«×Ó»ìÓ«ÜÓ«│Ó»ì Ó«¿Ó«┐Ó«▒Ó«¬Ó»ì Ó«¬Ó»èÓ«░Ó»üÓ«│Ó«¥Ó«ò Ó««Ó«¥Ó«▒Ó»ìÓ«▒Ó««Ó«ƒÓ»êÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«ñÓ»ü. Ó«¿Ó»åÓ«òÓ«┐Ó«┤Ó»ìÓ««Ó«òÓ»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó»ì Ó«ëÓ«úÓ»ìÓ««Ó»êÓ«»Ó«¥Ó«® Ó«ÁÓ»çÓ«▒Ó»ìÓ«▒Ó»üÓ«░Ó»ü Ó«çÓ«▓Ó»ìÓ«▓Ó»ê Ó«ÄÓ«®Ó»ìÓ«▒Ó»ü Ó«ÜÓ»èÓ«▓Ó»ìÓ«ÁÓ«¥Ó«░Ó»ìÓ«òÓ«│Ó»ì. Ó«¬Ó«ƒÓ«┐Ó«ò Ó«ëÓ«░Ó»üÓ«ÁÓ««Ó«▒Ó»ìÓ«▒Ó«ÁÓ»ê (Amorphous), Ó««Ó«┐Ó«ñÓ««Ó«òÓ»ìÓ«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì (Colloidal) Ó«ÄÓ«®Ó«ÁÓ»üÓ««Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»ê Ó«ÁÓ»çÓ«▒Ó»üÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«┐Ó«»Ó»üÓ«│Ó»ìÓ«│Ó«®Ó«░Ó»ì.  Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó»ì Ó«ÜÓ»çÓ«░Ó»ìÓ««Ó«ÖÓ»ìÓ«òÓ«│Ó»ìÓ«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«¬Ó»èÓ«ñÓ»üÓ«ÁÓ«¥Ó«ò -2 Ó««Ó»üÓ«ñÓ«▓Ó»ì +6 Ó«ÁÓ«░Ó»êÓ«»Ó«┐Ó«▓Ó«¥Ó«® Ó«åÓ«òÓ»ìÓ«ÜÓ«┐Ó«ÜÓ«®Ó»çÓ«▒Ó»ìÓ«▒ Ó«¿Ó«┐Ó«▓Ó»êÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«òÓ«¥Ó«úÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó««Ó«¿Ó»ìÓ«ñ Ó«ÁÓ«¥Ó«»Ó»üÓ«òÓ»ìÓ«òÓ«│Ó»êÓ«ñÓ»ì Ó«ñÓ«ÁÓ«┐Ó«░ Ó««Ó«▒Ó»ìÓ«▒ Ó«àÓ«®Ó»êÓ«ñÓ»ìÓ«ñÓ»ü Ó«ñÓ«®Ó«┐Ó««Ó«ÖÓ»ìÓ«òÓ«│Ó»üÓ«ƒÓ«®Ó»üÓ««Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«¿Ó«┐Ó«▓Ó»êÓ«»Ó«¥Ó«® Ó«ÜÓ»çÓ«░Ó»ìÓ««Ó«ÖÓ»ìÓ«òÓ«│Ó»êÓ«òÓ»ì Ó«òÓ»èÓ«ƒÓ»üÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«çÓ«▓Ó»çÓ«ÜÓ«¥Ó«® Ó«åÓ«òÓ»ìÓ«ÜÓ«┐Ó«ÜÓ«®Ó»çÓ«▒Ó»ìÓ«▒Ó»üÓ««Ó»ì Ó««Ó»üÓ«òÓ«ÁÓ«░Ó»ìÓ«òÓ«│Ó»ì Ó««Ó»üÓ«®Ó»ìÓ«®Ó«┐Ó«▓Ó»êÓ«»Ó«┐Ó«▓Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ÁÓ«▓Ó«┐Ó««Ó»êÓ«»Ó«¥Ó«® Ó«àÓ««Ó«┐Ó«▓Ó«òÓ»ì Ó«òÓ«░Ó»êÓ«ÜÓ«▓Ó»ìÓ«òÓ«│Ó»üÓ«ƒÓ«®Ó»ì Ó«ÁÓ«┐Ó«®Ó»êÓ«¬Ó»üÓ«░Ó«┐Ó«¿Ó»ìÓ«ñÓ»ü Ó«¬Ó«▓ Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«¿Ó»çÓ«░Ó»ìÓ««Ó«┐Ó«®Ó»ì Ó«àÓ«»Ó«®Ó«┐Ó«òÓ«│Ó»ê Ó«ëÓ«▒Ó»ìÓ«¬Ó«ñÓ»ìÓ«ñÓ«┐ Ó«ÜÓ»åÓ«»Ó»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»ê Ó«ÆÓ«▓Ó«┐Ó«»Ó««Ó»ì Ó«ÄÓ«®Ó«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ««Ó»ì Ó«¬Ó»üÓ«òÓ»êÓ«»Ó»üÓ««Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«àÓ««Ó«┐Ó«▓Ó«ñÓ»ìÓ«ñÓ«┐Ó«▓Ó»ì Ó«òÓ«░Ó»êÓ«ñÓ»ìÓ«ñÓ«¥Ó«▓Ó»ì Ó«ÁÓ«úÓ»ìÓ«úÓ«òÓ»ì Ó«òÓ«░Ó»êÓ«ÜÓ«▓Ó»ìÓ«òÓ«│Ó»ì Ó«ñÓ»ïÓ«®Ó»ìÓ«▒Ó»üÓ«ÁÓ«ñÓ»ê 1804 Ó«åÓ««Ó»ì Ó«åÓ«úÓ»ìÓ«ƒÓ«┐Ó«▓Ó»ì Ó«ÜÓ«┐.Ó«ÄÓ«¬Ó»ì. Ó«¬Ó»üÓ«ÜÓ»ìÓ«ÜÓ»ïÓ«▓Ó»ì Ó«òÓ«úÓ»ìÓ«ƒÓ«▒Ó«┐Ó«¿Ó»ìÓ«ñÓ»ü Ó«òÓ»éÓ«▒Ó«┐Ó«®Ó«¥Ó«░Ó»ì. Ó«åÓ«®Ó«¥Ó«▓Ó»ì 1960 Ó«òÓ«│Ó«┐Ó«®Ó»ì Ó«¬Ó«┐Ó«▒Ó»ìÓ«¬Ó«òÓ»üÓ«ñÓ«┐Ó«»Ó«┐Ó«▓Ó»ì Ó««Ó«ƒÓ»ìÓ«ƒÓ»üÓ««Ó»ç Ó«ÜÓ««Ó»ìÓ«¬Ó«¿Ó»ìÓ«ñÓ«¬Ó»ìÓ«¬Ó«ƒÓ»ìÓ«ƒ Ó«¬Ó«¥Ó«▓Ó«┐ Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«¿Ó»çÓ«░Ó»ìÓ««Ó«┐Ó«®Ó»ì Ó«àÓ«»Ó«®Ó«┐Ó«òÓ«│Ó«┐Ó«®Ó»ì Ó«¿Ó«┐Ó«▒Ó«ñÓ»ìÓ«ñÓ«┐Ó«▒Ó»ìÓ«òÓ«¥Ó«® Ó«òÓ«¥Ó«░Ó«úÓ««Ó»ì Ó««Ó«▒Ó»ìÓ«▒Ó»üÓ««Ó»ì Ó«òÓ«ƒÓ»ìÓ«ƒÓ««Ó»êÓ«¬Ó»ìÓ«¬Ó»ü Ó«¬Ó»ïÓ«®Ó»ìÓ«▒Ó«ÁÓ»ê Ó«ñÓ»ÇÓ«░Ó»ìÓ««Ó«¥Ó«®Ó«┐Ó«òÓ»ìÓ«òÓ«¬Ó»ìÓ«¬Ó«ƒÓ»ìÓ«ƒÓ«®. S82 + Ó«åÓ«┤Ó»ìÓ«¿Ó»ìÓ«ñ Ó«¿Ó»ÇÓ«▓Ó««Ó»ì Ó«ÄÓ«®Ó»ìÓ«▒Ó»üÓ««Ó»ì S42 + Ó««Ó«×Ó»ìÓ«ÜÓ«│Ó»ì Ó««Ó«▒Ó»ìÓ«▒Ó»üÓ««Ó»ì S162 + Ó«ÜÓ«┐Ó«ÁÓ«¬Ó»ìÓ«¬Ó»ü Ó«ÄÓ«®Ó»ìÓ«▒Ó»üÓ««Ó»ì Ó«çÓ«▒Ó»üÓ«ñÓ«┐Ó«»Ó«¥Ó«òÓ»ìÓ«òÓ«¬Ó»ìÓ«¬Ó«ƒÓ»ìÓ«ƒÓ«®. Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ»üÓ«òÓ«│Ó»ìÓ«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»üÓ«ƒÓ«®Ó»ì Ó«ÉÓ«ñÓ«░Ó«ÜÓ«®Ó»ê Ó«ÜÓ»çÓ«░Ó»ìÓ«ñÓ»ìÓ«ñÓ»ü Ó«ÁÓ«┐Ó«®Ó»êÓ«¬Ó»üÓ«░Ó«┐Ó«»Ó«ÜÓ»ì Ó«ÜÓ»åÓ«»Ó»ìÓ«ñÓ«¥Ó«▓Ó»ì Ó«ÉÓ«ñÓ«░Ó«ÜÓ«®Ó»ì Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ»ü Ó«ñÓ»ïÓ«®Ó»ìÓ«▒Ó»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«çÓ«ñÓ»ü Ó«ÜÓ«▒Ó»ìÓ«▒Ó»ü Ó«àÓ««Ó«┐Ó«▓Ó«ñÓ»ìÓ«ñÓ«®Ó»ìÓ««Ó»êÓ«»Ó»ê Ó«ÁÓ»åÓ«│Ó«┐Ó«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü.
Ó«ÉÓ«ñÓ«░Ó«ÜÓ«®Ó»ì Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ»ü Ó«ÁÓ«¥Ó«»Ó»üÓ«ÁÓ»üÓ««Ó»ì Ó«ÉÓ«ñÓ«░Ó»ïÓ«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ»ü Ó«ÄÓ«ñÓ«┐Ó«░Ó»ì Ó««Ó«┐Ó«®Ó»ìÓ«®Ó«»Ó«®Ó«┐Ó«»Ó»üÓ««Ó»ì Ó«¬Ó«¥Ó«▓Ó»éÓ«ƒÓ»ìÓ«ƒÓ«┐Ó«òÓ«│Ó»üÓ«òÓ»ìÓ«òÓ»ü Ó«àÓ«ñÓ«┐Ó«ò Ó«¿Ó«ÜÓ»ìÓ«ÜÓ»üÓ«ñÓ»ìÓ«ñÓ«®Ó»ìÓ««Ó»êÓ«»Ó»ê Ó«àÓ«│Ó«┐Ó«¬Ó»ìÓ«¬Ó«®Ó«ÁÓ«¥Ó«ò Ó«ëÓ«│Ó»ìÓ«│Ó«®. Ó«ÅÓ«®Ó»åÓ«®Ó«┐Ó«▓Ó»ì Ó«çÓ«ÁÓ»ê Ó«êÓ««Ó»ïÓ«òÓ»üÓ«│Ó»ïÓ«¬Ó«┐Ó«®Ó«┐Ó«®Ó»ì Ó«åÓ«òÓ»ìÓ«ÜÓ«┐Ó«ÜÓ«®Ó»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ»ü Ó«ÜÓ»åÓ«▓Ó»ìÓ«▓Ó»üÓ««Ó»ì Ó«ñÓ«┐Ó«▒Ó«®Ó»ê Ó«ñÓ«ƒÓ»ê Ó«ÜÓ»åÓ«»Ó»ìÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«®. Ó«çÓ«ñÓ»ç Ó«¬Ó»ïÓ«▓ Ó«ÜÓ«»Ó«®Ó»êÓ«ƒÓ»üÓ«òÓ«│Ó»üÓ««Ó»ì Ó«àÓ«ÜÓ»êÓ«ƒÓ»üÓ«òÓ«│Ó»üÓ««Ó»ì Ó«ÜÓ»êÓ«ƒÓ»ìÓ«ƒÓ»ïÓ«òÓ»üÓ«░Ó»ïÓ««Ó»ìÓ«òÓ«│Ó»êÓ«ñÓ»ì Ó«ñÓ«ƒÓ»ê Ó«ÜÓ»åÓ«»Ó»ìÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«®. Ó«ñÓ«®Ó«┐Ó««Ó«¿Ó«┐Ó«▓Ó»ê Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»ê Ó«ÆÓ«ƒÓ»üÓ«òÓ»ìÓ«òÓ»üÓ«ÁÓ«ñÓ«®Ó»ì Ó««Ó»éÓ«▓Ó««Ó»ì Ó«¬Ó«¥Ó«▓Ó«┐Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ»üÓ«òÓ«│Ó»ì Ó«ëÓ«░Ó»üÓ«ÁÓ«¥Ó«òÓ«┐Ó«®Ó»ìÓ«▒Ó«®. Ó«çÓ«ÁÓ»ê S ÔêÆ Ó««Ó»êÓ«»Ó«ÖÓ»ìÓ«òÓ«│Ó»ì Ó«¿Ó»ÇÓ«òÓ»ìÓ«òÓ«¬Ó»ìÓ«¬Ó«ƒÓ»ìÓ«ƒ Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«àÓ«úÓ»üÓ«òÓ»ìÓ«òÓ«│Ó«┐Ó«®Ó»ì Ó«ÜÓ«ÖÓ»ìÓ«òÓ«┐Ó«▓Ó«┐Ó«òÓ«│Ó»êÓ«òÓ»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ»üÓ«│Ó»ìÓ«│Ó«®.
Ó«çÓ«ÁÓ»ìÓ«ÁÓ«┐Ó«®Ó»ê Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó»ì Ó«ñÓ«®Ó«┐Ó«ÜÓ»ì Ó«ÜÓ«┐Ó«▒Ó«¬Ó»ìÓ«¬Ó»üÓ«¬Ó»ì Ó«¬Ó«úÓ»ìÓ«¬Ó«¥Ó«® Ó«ñÓ«®Ó«òÓ»ìÓ«òÓ»üÓ«│Ó»ì Ó«çÓ«úÓ»êÓ«¿Ó»ìÓ«ñÓ»ü Ó«ÜÓ«ÖÓ»ìÓ«òÓ«┐Ó«▓Ó«┐Ó«»Ó«¥Ó«òÓ»üÓ««Ó»ì Ó«¬Ó«úÓ»ìÓ«¬Ó»ê Ó«ÁÓ»åÓ«│Ó«┐Ó«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«çÓ«¬Ó»ìÓ«¬Ó«¥Ó«▓Ó«┐ Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ»üÓ«òÓ«│Ó»ê Ó«¬Ó»üÓ«░Ó»ïÓ«ƒÓ»ìÓ«ƒÓ«¥Ó«®Ó»çÓ«▒Ó»ìÓ«▒Ó««Ó»ì Ó«ÜÓ»åÓ«»Ó»ìÓ«ÁÓ«ñÓ«¥Ó«▓Ó»ì Ó«¬Ó«¥Ó«▓Ó«┐Ó«ÜÓ«▓Ó»ìÓ«¬Ó»çÓ«®Ó»ìÓ«òÓ«│Ó»ì Ó«ñÓ»ïÓ«®Ó»ìÓ«▒Ó»üÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«®. H2Sx Ó«ÄÓ«®Ó»ìÓ«▒ Ó«ÁÓ«¥Ó«»Ó»ìÓ«¬Ó»ìÓ«¬Ó«¥Ó«ƒÓ»ü Ó«òÓ»èÓ«úÓ»ìÓ«ƒ Ó«çÓ«ÁÓ«▒Ó»ìÓ«▒Ó«┐Ó«▓Ó»ì x = 2, 3, 4 Ó«ÄÓ«®Ó»ìÓ«▒ Ó««Ó«ñÓ«┐Ó«¬Ó»ìÓ«¬Ó»üÓ«òÓ«│Ó»êÓ«òÓ»ì Ó«òÓ»üÓ«▒Ó«┐Ó«òÓ»ìÓ«òÓ»üÓ««Ó»ì. Ó«çÓ«▒Ó»üÓ«ñÓ«┐Ó«»Ó«┐Ó«▓Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ÆÓ«ƒÓ»üÓ«òÓ»ìÓ«òÓ»üÓ««Ó»ì Ó«ÁÓ«┐Ó«®Ó»ê Ó««Ó»éÓ«▓Ó««Ó«¥Ó«ò Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ»ü Ó«ëÓ«¬Ó»ìÓ«¬Ó»üÓ«òÓ«│Ó»êÓ«òÓ»ì Ó«òÓ»èÓ«ƒÓ»üÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü.
Ó«çÓ«¿Ó»ìÓ«ñ Ó«çÓ«®Ó«ÖÓ»ìÓ«òÓ«│Ó«┐Ó«®Ó»ì Ó«çÓ«ƒÓ»êÓ«»Ó»ç Ó«¿Ó«┐Ó«òÓ«┤Ó»üÓ««Ó»ì Ó«çÓ««Ó»ìÓ««Ó«¥Ó«▒Ó»ìÓ«▒Ó««Ó»ì Ó«ÜÓ»ïÓ«ƒÓ«┐Ó«»Ó««Ó»ì-Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó««Ó«┐Ó«®Ó»ìÓ«òÓ«▓Ó«®Ó»ìÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«åÓ«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»üÓ«òÓ«│Ó»ì, Ó«åÓ«òÓ»ìÓ«ÜÓ»ï Ó«àÓ««Ó«┐Ó«▓Ó«ÖÓ»ìÓ«òÓ«│Ó»ì, Ó«åÓ«òÓ»ìÓ«ÜÓ»ï Ó«ÄÓ«ñÓ«┐Ó«░Ó»ìÓ««Ó«┐Ó«®Ó»ì Ó«àÓ«»Ó«®Ó«┐Ó«òÓ«│Ó»ìÓ«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»ê Ó«ÄÓ«░Ó«┐Ó«¬Ó»ìÓ«¬Ó«ñÓ«¥Ó«▓Ó»ì Ó««Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«»Ó««Ó«¥Ó«® Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«åÓ«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»üÓ«òÓ«│Ó»ì Ó«ñÓ»ïÓ«®Ó»ìÓ«▒Ó»üÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«®.
Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó»ì Ó«¬Ó«▓ Ó«åÓ«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»üÓ«òÓ«│Ó»ì Ó«àÓ«▒Ó«┐Ó«»Ó«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«®. Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó««Ó»ïÓ«®Ó«¥Ó«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»ü, Ó«çÓ«░Ó»üÓ«òÓ«¿Ó»ìÓ«ñÓ«ò Ó««Ó»ïÓ«®Ó«¥Ó«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»ü, Ó«çÓ«░Ó»üÓ«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«êÓ«░Ó«¥Ó«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»ü Ó««Ó«▒Ó»ìÓ«▒Ó»üÓ««Ó»ì Ó«ëÓ«»Ó«░Ó»ì Ó«åÓ«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»üÓ«òÓ«│Ó»êÓ«òÓ»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ»üÓ«│Ó»ìÓ«│ Ó«¬Ó»åÓ«░Ó«¥Ó«òÓ»ìÓ«ÜÓ»ï Ó«òÓ»üÓ«┤Ó»üÓ«òÓ»ìÓ«òÓ«│Ó»ì Ó«ëÓ«│Ó»ìÓ«│Ó«┐Ó«ƒÓ»ìÓ«ƒÓ«ÁÓ»ê Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»ê Ó««Ó«┐Ó«òÓ»üÓ«ñÓ«┐Ó«»Ó«¥Ó«òÓ«òÓ»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒ Ó«åÓ«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»üÓ«òÓ«│Ó»ì Ó«åÓ«òÓ»üÓ««Ó»ì. Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«åÓ«òÓ»ìÓ«ÜÓ»ï Ó«àÓ««Ó«┐Ó«▓Ó«ÖÓ»ìÓ«òÓ«│Ó«¥Ó«òÓ«ÁÓ»üÓ««Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ëÓ«░Ó»üÓ«ÁÓ«¥Ó«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«çÓ«ÁÓ«▒Ó»ìÓ«▒Ó«┐Ó«▓Ó»ì Ó«ÜÓ«┐Ó«▓ Ó«àÓ««Ó«┐Ó«▓Ó«ÖÓ»ìÓ«òÓ«│Ó»ê Ó«ñÓ«®Ó«┐Ó«ñÓ»ìÓ«ñÓ»üÓ«¬Ó»ì Ó«¬Ó«┐Ó«░Ó«┐Ó«òÓ»ìÓ«ò Ó«çÓ«»Ó«▓Ó«ÁÓ«┐Ó«▓Ó»ìÓ«▓Ó»ê. Ó«àÓ«ÁÓ«▒Ó»ìÓ«▒Ó»ê Ó«ëÓ«¬Ó»ìÓ«¬Ó»üÓ«òÓ«│Ó«┐Ó«®Ó»ì Ó«ÁÓ«┤Ó«┐Ó«»Ó«¥Ó«ò Ó««Ó«ƒÓ»ìÓ«ƒÓ»üÓ««Ó»ç Ó«àÓ«▒Ó«┐Ó«»Ó««Ó»üÓ«ƒÓ«┐Ó«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«ƒÓ»ê Ó«åÓ«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»üÓ««Ó»ì Ó«ÜÓ«▓Ó»ìÓ«¬Ó»çÓ«ƒÓ»ìÓ«ƒÓ»üÓ«òÓ«│Ó»üÓ««Ó»ì (SO2ÔêÆ3) Ó«òÓ«¿Ó»ìÓ«ñÓ«Ü Ó«àÓ««Ó«┐Ó«▓Ó«ñÓ»ìÓ«ñÓ»üÓ«ƒÓ«®Ó»ì Ó«ñÓ»èÓ«ƒÓ«░Ó»ìÓ«¬Ó»ü Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ»üÓ«│Ó»ìÓ«│Ó«®. Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«ƒÓ«┐Ó«░Ó»ê Ó«åÓ«òÓ»ìÓ«ÜÓ»êÓ«ƒÓ»üÓ««Ó»ì Ó«ÜÓ«▓Ó»ìÓ«¬Ó»çÓ«ƒÓ»ìÓ«ƒÓ»üÓ«òÓ«│Ó»üÓ««Ó»ì (SO2ÔêÆ4) Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«àÓ««Ó«┐Ó«▓Ó«ñÓ»ìÓ«ñÓ»üÓ«ƒÓ«®Ó»ì Ó«ñÓ»èÓ«ƒÓ«░Ó»ìÓ«¬Ó»ü Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ»üÓ«│Ó»ìÓ«│Ó«®. SO3 Ó«ëÓ«ƒÓ«®Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«àÓ««Ó«┐Ó«▓Ó««Ó»ì Ó«ÜÓ»çÓ«░Ó»ìÓ«¿Ó»ìÓ«ñÓ»ü Ó«ÆÓ«▓Ó«┐Ó«»Ó««Ó»ì Ó«ÄÓ«®Ó»ìÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ««Ó»ì Ó«¬Ó»üÓ«òÓ»êÓ«»Ó«┐Ó««Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«àÓ««Ó«┐Ó«▓Ó««Ó»ì Ó«ëÓ«░Ó»üÓ«ÁÓ«¥Ó«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«çÓ«ñÓ»ü Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«àÓ««Ó«┐Ó«▓Ó«ñÓ»ìÓ«ñÓ«┐Ó«▓Ó»ì Ó«¬Ó»êÓ«░Ó»ïÓ«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«àÓ««Ó«┐Ó«▓Ó««Ó»ì (H2S2O7) Ó«òÓ«▓Ó«¿Ó»ìÓ«ñ Ó«òÓ«░Ó»êÓ«ÜÓ«▓Ó«¥Ó«òÓ»üÓ««Ó»ì. Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«çÓ«░Ó«úÓ»ìÓ«ƒÓ»ü Ó«åÓ«òÓ»ìÓ«ÜÓ«┐Ó«ÜÓ«®Ó»çÓ«▒Ó»ìÓ«▒ Ó«¿Ó«┐Ó«▓Ó»êÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«òÓ«¥Ó«úÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ««Ó»ì Ó«ñÓ«»Ó»ï Ó«ÜÓ«▓Ó»ìÓ«¬Ó»çÓ«ƒÓ»ìÓ«ƒÓ»ü Ó«ëÓ«¬Ó»ìÓ«¬Ó»üÓ«òÓ«│Ó»ì Ó«ÜÓ«┐Ó«▓ Ó«ÜÓ««Ó«»Ó«ÖÓ»ìÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«ÉÓ«¬Ó»ìÓ«¬Ó»ïÓ«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ»ìÓ«ƒÓ»üÓ«òÓ«│Ó»ì Ó«ÄÓ«®Ó«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«®. Ó«çÓ«ÁÓ»ê Ó«¬Ó»üÓ«òÓ»êÓ«¬Ó»ìÓ«¬Ó«ƒÓ«ñÓ»ì Ó«ñÓ»èÓ«┤Ó«┐Ó«▓Ó«┐Ó«▓Ó»ì Ó«¿Ó«┐Ó«▓Ó»êÓ«¿Ó«┐Ó«▒Ó»üÓ«ñÓ»ìÓ«ñÓ«┐Ó«òÓ«│Ó«¥Ó«òÓ«¬Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«®. Ó«ÜÓ»ïÓ«ƒÓ«┐Ó«»Ó««Ó»ìÓ«ƒÓ»êÓ«ñÓ«»Ó»ïÓ«®Ó»çÓ«ƒÓ»ìÓ«ƒÓ«┐Ó«▓Ó»ì (Na2S2O4) Ó«àÓ«ñÓ«┐Ó«òÓ««Ó«¥Ó«ò Ó«ÆÓ«ƒÓ»üÓ«òÓ»ìÓ«òÓ»üÓ«òÓ«┐Ó«®Ó»ìÓ«▒ Ó«ƒÓ»ê Ó«ñÓ«»Ó»ïÓ«®Ó»êÓ«ƒÓ»ìÓ«ƒÓ»ü (S2O2ÔêÆ4) Ó«ÄÓ«ñÓ«┐Ó«░Ó»ìÓ««Ó«┐Ó«®Ó»ì Ó«àÓ«»Ó«®Ó«┐ Ó«çÓ«ƒÓ««Ó»ìÓ«¬Ó»åÓ«▒Ó»ìÓ«▒Ó»üÓ«│Ó»ìÓ«│Ó«ñÓ»ü. Ó«åÓ«▓Ó»êÓ«ƒÓ»üÓ«òÓ«│Ó»üÓ««Ó»ì Ó«åÓ«òÓ»ìÓ«ÜÓ«┐ Ó«åÓ«▓Ó»êÓ«ƒÓ»üÓ«òÓ«│Ó»üÓ««Ó»ìÓ«¿Ó«ÁÓ»ÇÓ«® Ó«ñÓ»èÓ«┤Ó«┐Ó«▒Ó»ìÓ«ÜÓ«¥Ó«▓Ó»êÓ«òÓ«│Ó»üÓ«òÓ»ìÓ«òÓ»ü Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«åÓ«▓Ó»êÓ«ƒÓ»üÓ«òÓ«│Ó»ì Ó««Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«»Ó««Ó«¥Ó«®Ó«ÁÓ»êÓ«»Ó«¥Ó«ò Ó«ëÓ«│Ó»ìÓ«│Ó«®. Ó«ëÓ«»Ó«░Ó»ì Ó«àÓ«┤Ó»üÓ«ñÓ»ìÓ«ñ Ó««Ó«┐Ó«®Ó»ìÓ««Ó«¥Ó«▒Ó»ìÓ«▒Ó«┐Ó«òÓ«│Ó«┐Ó«▓Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«ÄÓ«òÓ»ìÓ«ÜÓ«¥Ó«¬Ó»üÓ«│Ó»ïÓ«░Ó»êÓ«ƒÓ»ü Ó««Ó«┐Ó«®Ó»ìÓ«òÓ«ƒÓ«ñÓ»ìÓ«ñÓ«¥ Ó«ÁÓ«¥Ó«»Ó»üÓ«ÁÓ«¥Ó«òÓ«¬Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó««Ó»çÓ«▓Ó»üÓ««Ó»ì, Ó«àÓ«┤Ó»üÓ«ñÓ»ìÓ«ñÓ«òÓ»ì Ó«òÓ»èÓ«│Ó»ìÓ«òÓ«▓Ó«®Ó»ìÓ«òÓ«│Ó«┐Ó«▓Ó»üÓ««Ó»ì Ó«çÓ«ñÓ»ü Ó«ÁÓ«┐Ó«®Ó»êÓ«¬Ó»üÓ«░Ó«┐Ó«»Ó«¥Ó«¬Ó»ì Ó«¬Ó»èÓ«░Ó»üÓ«│Ó«¥Ó«òÓ«ÁÓ»üÓ««Ó»ì Ó«¿Ó«ÜÓ»ìÓ«ÜÓ»üÓ«ñÓ»ì Ó«ñÓ«®Ó»ìÓ««Ó»ê Ó«àÓ«▒Ó»ìÓ«▒ Ó«ëÓ«¿Ó»ìÓ«ñÓ»ü Ó«¬Ó»èÓ«░Ó»üÓ«│Ó«¥Ó«òÓ«ÁÓ»üÓ««Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«ƒÓ»åÓ«ƒÓ»ìÓ«░Ó«¥ Ó«¬Ó»üÓ«│Ó»ïÓ«░Ó»êÓ«ƒÓ»ü Ó«ÄÓ«®Ó«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ««Ó»ì Ó«ëÓ«»Ó«░Ó»ì Ó«¿Ó«ÜÓ»ìÓ«ÜÓ»ü Ó«àÓ«░Ó«┐Ó«ñÓ«¥Ó«òÓ«¬Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ««Ó»ì Ó«ÆÓ«░Ó»ü Ó«òÓ«░Ó«┐Ó«« Ó««Ó»üÓ«òÓ«ÁÓ«░Ó«¥Ó«òÓ»üÓ««Ó»ì. Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«ƒÓ»ê Ó«òÓ»üÓ«│Ó»ïÓ«░Ó»êÓ«ƒÓ»üÓ««Ó»ì Ó«çÓ«░Ó»üÓ«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«çÓ«░Ó»üÓ«òÓ»üÓ«│Ó»ïÓ«░Ó»êÓ«ƒÓ»üÓ««Ó»ì Ó««Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«»Ó««Ó«¥Ó«® Ó«ñÓ»èÓ«┤Ó«┐Ó«▒Ó»ìÓ«ÜÓ«¥Ó«▓Ó»ê Ó«ÁÓ»çÓ«ñÓ«┐Ó«¬Ó»ì Ó«¬Ó»èÓ«░Ó»üÓ«ƒÓ»ìÓ«òÓ«│Ó«¥Ó«òÓ»üÓ««Ó»ì. Ó«ÜÓ«▓Ó»ìÓ«¬Ó«┐Ó«»Ó»éÓ«░Ó»êÓ«▓Ó»ì Ó«òÓ»üÓ«│Ó»ïÓ«░Ó»êÓ«ƒÓ»üÓ««Ó»ì Ó«òÓ»üÓ«│Ó»ïÓ«░Ó»ïÓ«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«àÓ««Ó«┐Ó«▓Ó««Ó»üÓ««Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«àÓ««Ó«┐Ó«▓Ó«ñÓ»ìÓ«ñÓ«┐Ó«®Ó»üÓ«ƒÓ»êÓ«» Ó«ÁÓ«┤Ó«┐Ó«¬Ó»ìÓ«¬Ó»èÓ«░Ó»üÓ«ƒÓ»ìÓ«òÓ«│Ó«¥Ó«òÓ»üÓ««Ó»ì. Ó«ñÓ«»Ó»ïÓ«®Ó»êÓ«▓Ó»ì Ó«òÓ»üÓ«│Ó»ïÓ«░Ó»êÓ«ƒÓ»ü (SOCl2) Ó«òÓ«░Ó«┐Ó««Ó«ñÓ»ì Ó«ñÓ»èÓ«òÓ»üÓ«¬Ó»ìÓ«¬Ó»ü Ó«ÁÓ«┐Ó«®Ó»êÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«ÆÓ«░Ó»ü Ó«¬Ó»èÓ«ñÓ»ü Ó««Ó»üÓ«òÓ«ÁÓ«░Ó«¥Ó«òÓ«¬Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«¿Ó«┐Ó«òÓ»ìÓ«¿Ó»êÓ«ƒÓ»ìÓ«ƒÓ»üÓ«òÓ«│Ó»ìÓ««Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«»Ó««Ó«¥Ó«® SÔÇôN Ó«ÜÓ»çÓ«░Ó»ìÓ««Ó«ÖÓ»ìÓ«òÓ«│Ó«┐Ó«▓Ó»ì Ó«ÆÓ«®Ó»ìÓ«▒Ó»ü Ó«ƒÓ»åÓ«ƒÓ»ìÓ«░Ó«¥Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«ƒÓ»åÓ«ƒÓ»ìÓ«░Ó«¥ Ó«¿Ó»êÓ«ƒÓ»ìÓ«░Ó»êÓ«ƒÓ»ü (S4N4) Ó«åÓ«òÓ»üÓ««Ó»ì. Ó«çÓ«ÜÓ»ìÓ«ÜÓ»çÓ«░Ó»ìÓ««Ó«ñÓ»ìÓ«ñÓ»ê Ó«ÜÓ»éÓ«ƒÓ«¥Ó«òÓ»ìÓ«òÓ»üÓ«ÁÓ«ñÓ«¥Ó«▓Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«¿Ó»êÓ«ƒÓ»ìÓ«░Ó»êÓ«ƒÓ»ü ((SN)x) Ó«¬Ó«▓Ó«¬Ó«ƒÓ«┐ Ó«ñÓ»ïÓ«®Ó»ìÓ«▒Ó»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«ÄÓ«¿Ó»ìÓ«ñ Ó«ëÓ«▓Ó»ïÓ«ò Ó«àÓ«úÓ»üÓ«òÓ»ìÓ«òÓ«│Ó»êÓ«»Ó»üÓ««Ó»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ«┐Ó«░Ó»üÓ«òÓ»ìÓ«òÓ«¥Ó«ÁÓ«┐Ó«ƒÓ»ìÓ«ƒÓ«¥Ó«▓Ó»üÓ««Ó»ì Ó«òÓ»éÓ«ƒ Ó«çÓ«ñÓ»ü Ó«ëÓ«▓Ó»ïÓ«òÓ«¬Ó»ì Ó«¬Ó«úÓ»ìÓ«¬Ó»üÓ«òÓ«│Ó»êÓ«òÓ»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ»üÓ«│Ó»ìÓ«│Ó«ñÓ»ü. Ó«ñÓ«»Ó»ïÓ«ÜÓ«»Ó«®Ó»çÓ«ƒÓ»ìÓ«ƒÓ»üÓ«òÓ«│Ó»ì SCNÔêÆ Ó«òÓ»üÓ«┤Ó»üÓ«ÁÓ»êÓ«òÓ»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ»üÓ«│Ó»ìÓ«│Ó«®. Ó«ñÓ«»Ó»ïÓ«ÜÓ«»Ó«®Ó»çÓ«ƒÓ»ìÓ«ƒÓ»ê Ó«åÓ«òÓ»ìÓ«ÜÓ«┐Ó«ÜÓ«®Ó»çÓ«▒Ó»ìÓ«▒Ó««Ó»ì Ó«ÜÓ»åÓ«»Ó»ìÓ«ñÓ«¥Ó«▓Ó»ì NCS-SCN Ó«çÓ«úÓ»êÓ«¬Ó»ìÓ«¬Ó»üÓ«ƒÓ«®Ó«¥Ó«® Ó«ñÓ«»Ó»ïÓ«ÜÓ«»Ó«®Ó»ïÓ«ÜÓ«®Ó»ì (SCN)2 Ó«ëÓ«░Ó»üÓ«ÁÓ«¥Ó«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«¬Ó«¥Ó«ÜÓ»üÓ«¬Ó«░Ó«ÜÓ»ü Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ»üÓ«òÓ«│Ó»üÓ««Ó»ì Ó«ÄÓ«úÓ»ìÓ«úÓ«▒Ó»ìÓ«▒ Ó«àÓ«│Ó«ÁÓ«┐Ó«▓Ó»ì Ó«òÓ«¥Ó«úÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«®. P4S10 Ó««Ó«▒Ó»ìÓ«▒Ó»üÓ««Ó»ì P4S3 Ó«ÄÓ«®Ó»ìÓ«¬Ó«ÁÓ»ê Ó«çÓ«░Ó«úÓ»ìÓ«ƒÓ»üÓ««Ó»ì Ó«ÁÓ«úÓ«┐Ó«ò Ó««Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«»Ó«ñÓ»ìÓ«ñÓ»üÓ«ÁÓ««Ó»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ«ÁÓ»êÓ«»Ó«¥Ó«òÓ»üÓ««Ó»ì. Ó«¬Ó«»Ó«®Ó»ìÓ«òÓ«│Ó»ì  Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ñÓ»üÓ«¬Ó»ìÓ«¬Ó«¥Ó«òÓ»ìÓ«òÓ«┐ Ó«ÁÓ»åÓ«ƒÓ«┐ Ó««Ó«░Ó»üÓ«¿Ó»ìÓ«ñÓ«¥Ó«òÓ«ÁÓ»üÓ««Ó»ì, Ó«çÓ«»Ó«▒Ó»ìÓ«òÓ»ê Ó«çÓ«░Ó«¬Ó»ìÓ«¬Ó«░Ó»êÓ«òÓ»ì Ó«òÓ«ƒÓ«┐Ó«®Ó«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ»üÓ««Ó»ì Ó«ÁÓ«┤Ó«┐ Ó««Ó»üÓ«▒Ó»êÓ«»Ó«┐Ó«▓Ó»ì Ó«ÆÓ«░Ó»ü Ó«ÁÓ»çÓ«ñÓ«┐Ó«¬Ó»ì Ó«¬Ó»èÓ«░Ó»üÓ«│Ó«¥Ó«òÓ«ÁÓ»üÓ««Ó»ì, Ó«¬Ó»üÓ«òÓ»êÓ«¬Ó»ì Ó«¬Ó«ƒÓ«▓Ó«ñÓ»ìÓ«ñÓ»ê Ó«ÅÓ«▒Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ«┐ Ó«¬Ó»ïÓ«░Ó«¥Ó«ƒÓ»ìÓ«ƒÓ«òÓ»ì Ó«òÓ»üÓ««Ó»ìÓ«¬Ó«▓Ó»êÓ«òÓ»ì Ó«òÓ«▓Ó»êÓ«òÓ»ìÓ«òÓ«ÁÓ»üÓ««Ó»ì Ó«¬Ó«»Ó«®Ó»ì Ó«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«®Ó»ìÓ«▒Ó«ñÓ»ü. Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«àÓ««Ó«┐Ó«▓Ó««Ó»ì, Ó«ÜÓ«▓Ó»ìÓ«¬Ó»çÓ«ƒÓ»ì Ó«ëÓ«░Ó«ÖÓ»ìÓ«òÓ«│Ó»ì Ó«ñÓ«»Ó«¥Ó«░Ó«┐Ó«¬Ó»ìÓ«¬Ó«┐Ó«▓Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó»ì Ó«¬Ó«ÖÓ»ìÓ«òÓ«│Ó«┐Ó«¬Ó»ìÓ«¬Ó»ü Ó«òÓ»üÓ«▒Ó«┐Ó«¬Ó»ìÓ«¬Ó«┐Ó«ƒÓ«ñÓ»ìÓ«ñÓ«òÓ»ìÓ«òÓ«ñÓ»ü.[21][22] Ó«ÁÓ«▒Ó«úÓ»ìÓ«ƒ Ó«¬Ó«┤Ó«ÖÓ»ìÓ«òÓ«│Ó»ê Ó«ÁÓ»åÓ«úÓ»ìÓ««Ó»êÓ«»Ó»éÓ«ƒÓ»ìÓ«ƒÓ»üÓ«ÁÓ«ñÓ«▒Ó»ìÓ«òÓ»üÓ««Ó»ì, Ó«ÁÓ«¥Ó«®Ó«ÁÓ»çÓ«ƒÓ«┐Ó«òÓ»ìÓ«òÓ»êÓ«òÓ»ìÓ«òÓ«¥Ó«® Ó«ÁÓ»åÓ«ƒÓ«┐ Ó«¬Ó»èÓ«░Ó»üÓ«ƒÓ»ìÓ«òÓ«│Ó»êÓ«ñÓ»ì Ó«ñÓ«»Ó«¥Ó«░Ó«┐Ó«¬Ó»ìÓ«¬Ó«ñÓ«▒Ó»ìÓ«òÓ»üÓ««Ó»ì, Ó«ñÓ»ÇÓ«òÓ»ìÓ«òÓ»üÓ«ÜÓ»ìÓ«ÜÓ«┐Ó«òÓ«│Ó»ê Ó«ëÓ«▒Ó»ìÓ«¬Ó«ñÓ»ìÓ«ñÓ«┐ Ó«ÜÓ»åÓ«»Ó»ìÓ«ÁÓ«ñÓ«▒Ó»ìÓ«òÓ»üÓ««Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«òÓ«¥Ó«▓Ó»ìÓ«ÜÓ«┐Ó«»Ó««Ó»ì Ó«¬Ó»ê Ó«ÜÓ«▓Ó»ìÓ«¬Ó»êÓ«ƒÓ»ìÓ«ƒÓ»ê Ó««Ó«░Ó«òÓ»ì Ó«òÓ»éÓ«┤Ó»ìÓ«òÓ«│Ó»ê Ó«ÁÓ»åÓ«úÓ»ìÓ««Ó»êÓ«»Ó»éÓ«ƒÓ»ìÓ«ƒÓ»üÓ«ÁÓ«ñÓ«▒Ó»ìÓ«òÓ»üÓ«¬Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ»üÓ«òÓ«┐Ó«▒Ó«¥Ó«░Ó»ìÓ«òÓ«│Ó»ì. Ó«¬Ó»éÓ«×Ó»ìÓ«ÜÓ«®Ó««Ó»ì Ó«¬Ó«ƒÓ«░Ó»ìÓ«ÁÓ«ñÓ»ê Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó««Ó«ƒÓ»ìÓ«ƒÓ»üÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«àÓ«ñÓ«®Ó«¥Ó«▓Ó»ì Ó««Ó«░Ó»üÓ«¿Ó»ìÓ«ñÓ»ü Ó«ñÓ«»Ó«¥Ó«░Ó«┐Ó«òÓ»ìÓ«òÓ»üÓ««Ó»ì Ó«ÁÓ«┤Ó«┐ Ó««Ó»üÓ«▒Ó»êÓ«»Ó«┐Ó«▓Ó»ì Ó«çÓ«ñÓ»ü Ó«¬Ó»åÓ«░Ó«┐Ó«ñÓ»üÓ««Ó»ì Ó«¿Ó«®Ó»ìÓ««Ó»ê Ó«¬Ó«»Ó«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü.[23] Ó««Ó«░Ó«ñÓ»ìÓ«ñÓ«¥Ó«▓Ó«¥Ó«® Ó«¬Ó»èÓ«░Ó»üÓ«ƒÓ»ìÓ«òÓ«│Ó»êÓ«¬Ó»ì Ó«¬Ó«¥Ó«ñÓ»üÓ«òÓ«¥Ó«òÓ»ìÓ«ò Ó««Ó«▓Ó«┐Ó«ÁÓ«¥Ó«® Ó«ÜÓ«¥Ó«»Ó«ÖÓ»ìÓ«òÓ«│Ó»ê Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»êÓ«òÓ»ì Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ»ü Ó«ñÓ«»Ó«¥Ó«░Ó«┐Ó«ñÓ»ìÓ«ñÓ»ü Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«ñÓ»ìÓ«ñÓ»üÓ«òÓ«┐Ó«▒Ó«¥Ó«░Ó»ìÓ«òÓ«│Ó»ì. Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ëÓ«»Ó«┐Ó«░Ó»ìÓ«¬Ó»ì Ó«¬Ó»èÓ«░Ó»üÓ«ƒÓ»ìÓ«òÓ«│Ó«┐Ó«®Ó»ì Ó«ÁÓ«│Ó«░Ó»ìÓ«ÜÓ»ìÓ«ÜÓ«┐Ó«òÓ»ìÓ«òÓ»üÓ«ñÓ»ì Ó«ñÓ»çÓ«ÁÓ»êÓ«»Ó«¥Ó«®Ó«ñÓ«¥Ó«ò Ó«ëÓ«│Ó»ìÓ«│Ó«ñÓ»ü.[24] Ó«ÆÓ«ÁÓ»ìÓ«ÁÓ»èÓ«░Ó»ü Ó«ëÓ«»Ó«┐Ó«░Ó»ìÓ«ÜÓ»ì Ó«ÜÓ»åÓ«▓Ó»ìÓ«▓Ó«┐Ó«▓Ó»üÓ««Ó»ì Ó«òÓ»üÓ«▒Ó«┐Ó«¬Ó»ìÓ«¬Ó«¥Ó«ò Ó«ñÓ»ïÓ«▓Ó»ì, Ó«¿Ó«òÓ««Ó»ì Ó««Ó«▒Ó»ìÓ«▒Ó»üÓ««Ó»ì Ó««Ó»üÓ«ƒÓ«┐Ó«òÓ«│Ó«┐Ó«▓Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ëÓ«│Ó»ìÓ«│Ó«ñÓ»ü Ó«ÜÓ»êÓ«©Ó»ìÓ«ƒÓ»êÓ«®Ó»ì (Cysteine) Ó««Ó«▒Ó»ìÓ«▒Ó»üÓ««Ó»ì Ó««Ó»åÓ«ñÓ»ìÓ«ñÓ«┐Ó«»Ó»ïÓ«®Ó»êÓ«®Ó»ì (Methionine) Ó«¬Ó»ïÓ«®Ó»ìÓ«▒ Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«àÓ«ƒÓ«ÖÓ»ìÓ«òÓ«┐Ó«» Ó«àÓ««Ó«┐Ó«®Ó»ï Ó«àÓ««Ó«┐Ó«▓Ó«ÖÓ»ìÓ«òÓ«│Ó»ì Ó««Ó»éÓ«▓Ó««Ó«¥Ó«ò Ó«¬Ó»üÓ«░Ó«ñ Ó«ëÓ«úÓ«ÁÓ»üÓ«¬Ó»ì Ó«¬Ó»èÓ«░Ó»üÓ«ƒÓ»ìÓ«òÓ«│Ó«┐Ó«▓Ó«┐Ó«░Ó»üÓ«¿Ó»ìÓ«ñÓ»ü Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ»ê Ó«ëÓ«ƒÓ«▓Ó»ì Ó«¬Ó»åÓ«▒Ó»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«¬Ó«┐ Ó«ÁÓ»êÓ«ƒÓ»ìÓ«ƒÓ««Ó«┐Ó«®Ó»ìÓ«òÓ«│Ó«┐Ó«▓Ó»ì (Ó«ñÓ»êÓ«»Ó««Ó«┐Ó«®Ó»ì, Ó«¬Ó«úÓ»ìÓ«ƒÓ»ïÓ«ñÓ«┐Ó«®Ó«┐Ó«òÓ»ì Ó««Ó«▒Ó»ìÓ«▒Ó»üÓ««Ó»ì Ó«¬Ó«»Ó»ïÓ«ƒÓ»ìÓ«ƒÓ«┐Ó«®Ó»ì) Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ëÓ«│Ó»ìÓ«│Ó«ƒÓ«ÖÓ»ìÓ«òÓ«┐ Ó«çÓ«░Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«ÁÓ»åÓ«ÖÓ»ìÓ«òÓ«¥Ó«»Ó««Ó»ì, Ó«ÁÓ»åÓ«│Ó»ìÓ«│Ó»êÓ«¬Ó»ìÓ«¬Ó»éÓ«úÓ»ìÓ«ƒÓ«┐Ó«▓Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ««Ó»ì Ó«ôÓ«░Ó«│Ó«ÁÓ»ü Ó«àÓ«ƒÓ«ÖÓ»ìÓ«òÓ«┐ Ó«çÓ«░Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó»ì Ó««Ó»üÓ«òÓ»ìÓ«òÓ«┐Ó«»Ó««Ó«¥Ó«®Ó«ñÓ»èÓ«░Ó»ü Ó«ÁÓ«░Ó»ìÓ«ñÓ»ìÓ«ñÓ«òÓ«¬Ó»ì Ó«¬Ó«»Ó«®Ó»ì Ó«çÓ«░Ó«¬Ó»ìÓ«¬Ó«░Ó»ê Ó«ÁÓ«▓Ó»üÓ«ÁÓ»éÓ«ƒÓ»ìÓ«ƒÓ»üÓ«ÁÓ«ñÓ«¥Ó«òÓ»üÓ««Ó»ì (Vulcanization). Ó«çÓ«░Ó«¬Ó»ìÓ«¬Ó«░Ó»ì Ó««Ó»éÓ«▓Ó«òÓ»ìÓ«òÓ»éÓ«▒Ó»üÓ«òÓ«│Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«ò Ó«àÓ«úÓ»üÓ«òÓ»ìÓ«òÓ«│Ó»êÓ«òÓ»ì Ó«òÓ«ÁÓ«░Ó»üÓ««Ó»ì Ó«ñÓ«®Ó»ìÓ««Ó»ê Ó«òÓ»èÓ«úÓ»ìÓ«ƒÓ«®. Ó«çÓ«░Ó«¬Ó»ìÓ«¬Ó«░Ó«┐Ó«®Ó»ì Ó«òÓ«ƒÓ«┐Ó«®Ó«ñÓ»ì Ó«ñÓ«®Ó»ìÓ««Ó»ê Ó«àÓ«ñÓ«┐Ó«▓Ó»ì Ó«ÜÓ»çÓ«░Ó»ìÓ«òÓ»ìÓ«òÓ«¬Ó»ìÓ«¬Ó«ƒÓ»üÓ««Ó»ì Ó«òÓ«¿Ó»ìÓ«ñÓ«òÓ«ñÓ»ìÓ«ñÓ«┐Ó«®Ó»ì Ó«àÓ«│Ó«ÁÓ»êÓ«¬Ó»ì Ó«¬Ó»èÓ«▒Ó»üÓ«ñÓ»ìÓ«ñÓ«ñÓ»ü. Ó«òÓ»éÓ«ƒÓ»üÓ«ñÓ«▓Ó»ì Ó«ÁÓ«▓Ó«┐Ó««Ó»êÓ«»Ó»üÓ«ƒÓ»êÓ«» Ó«çÓ«░Ó«¬Ó»ìÓ«¬Ó«░Ó»ì Ó««Ó»ÇÓ«│Ó»ìÓ«ñÓ«┐Ó«▒Ó«®Ó»ì Ó««Ó«┐Ó«òÓ»ìÓ«òÓ«ñÓ«¥Ó«ò Ó«çÓ«░Ó»üÓ«¬Ó»ìÓ«¬Ó«ñÓ«¥Ó«▓Ó»ì Ó«¬Ó»çÓ«░Ó»üÓ«¿Ó»ìÓ«ñÓ»ü, Ó««Ó«òÓ«┐Ó«┤Ó»üÓ«¿Ó»ìÓ«ñÓ»ü, Ó«ÁÓ«┐Ó««Ó«¥Ó«®Ó««Ó»ì, Ó«çÓ«░Ó«¥Ó«úÓ»üÓ«Á Ó«ÁÓ«úÓ»ìÓ«ƒÓ«┐Ó«òÓ«│Ó»ì, Ó«òÓ«®Ó«░Ó«ò Ó«ÁÓ«úÓ»ìÓ«ƒÓ«┐Ó«òÓ«│Ó»ì Ó«çÓ«ÁÓ«▒Ó»ìÓ«▒Ó«┐Ó«▒Ó»ìÓ«òÓ«¥Ó«® Ó«ÜÓ«òÓ»ìÓ«òÓ«░Ó«ÖÓ»ìÓ«òÓ«│Ó»ì Ó«ÜÓ»åÓ«»Ó»ìÓ«»Ó«¬Ó»ì Ó«¬Ó«»Ó«®Ó»ìÓ«¬Ó«ƒÓ»üÓ«òÓ«┐Ó«▒Ó«ñÓ»ü. Ó««Ó»çÓ«▒Ó»ìÓ«òÓ»ïÓ«│Ó»ìÓ«òÓ«│Ó»üÓ««Ó»ì Ó«òÓ»üÓ«▒Ó«┐Ó«¬Ó»ìÓ«¬Ó»üÓ«òÓ«│Ó»üÓ««Ó»ì
Ó«¬Ó»üÓ«▒ Ó«çÓ«úÓ»êÓ«¬Ó»ìÓ«¬Ó»üÓ«òÓ«│Ó»ì
|
Portal di Ensiklopedia Dunia
















