இசுக்காண்டியம்(III) ஆக்சைடு
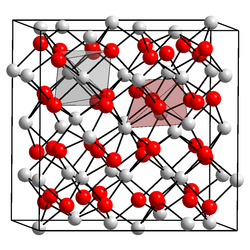
இசுக்காண்டியம்(III) ஆக்சைடு (Scandium(III) oxide) என்பது Sc அமைப்புஆறு ஒருங்கிணைவு உலோக மையங்களைக் கொண்ட ஒரு கனசதுர படிக அமைப்பை இசுக்காண்டியம் (III) ஆக்சைடு ஏற்றுள்ளது[1]. (சமச்சீர் புள்ளிக் குழு: நான்முகம் (Th) , இடக்குழு: Ia3) இசுக்காண்டியம் – ஆக்சிசன் பிணைப்புகளின் இடைவெளி 2.159-2.071Å அளவில் இருப்பதாக தூட்கோணல் பகுப்பாய்வு முடிவுகள் தெரிவிக்கின்றன.[2] தயாரிப்புசுரங்கத் தொழிற்துறையால் தயாரிக்கப்படும் இசுக்காண்டியம் ஆக்சைடுதான் தூய்மித்த வடிவ இசுக்காண்டியம் ஆகும். தோர்ட்வெய்டைட்டு (Sc,Y)2(Si2O7) மற்றும் கோல்பெக்கைட் ScPO4·2H2O போன்ற இசுக்காண்டியத் தாதுக்கள் அரிதாகவே கிடைக்கின்றன. மற்ற பல கனிமங்களில் சுவடளவிலான இசுக்காண்டியமே காணப்படுகிறது. எனவே இசுக்காண்டியம் ஆக்சைடு பெரும்பாலும் மற்ற தனிமங்களைப் பிரித்தெடுக்கும் போது உடன் விளை பொருளாகவே தயாரிக்கப்படுகிறது. இயற்பியல் பண்புகள்இசுக்காண்டியம்(III) ஆக்சைடு ,6.0 எலக்ட்ரான் வோல்ட் ஆற்றல் இடைவெளி அல்லது பட்டை இடைவெளியைக் கொண்ட மின்கடத்தாப் பொருளாகும்[3] வேதி வினைகள்இசுக்காண்டியத்தின் வேதிப்பண்புகள் அனைத்தும் இசுக்காண்டியம்(III) ஆக்சைடில் இருந்தே தொடங்குகின்றன. இசுக்காண்டியம்(III) ஆக்சைடை சூடுபடுத்தினால் பெரும்பாலான அமிலங்களுடன் வினைபுரிந்து நீரேற்றப் பொருட்களைக் கொடுக்கிறது. உதாரணமாக அதிகளவு ஐதரோ குளோரிக் நீர்க்கரைசலுடன் சேர்த்து சூடாக்கினால் ScCl3•nH2O என்ற வாய்ப்பாடு கொண்ட இசுக்காண்டியம்(III) குளோரைடைத் தருகிறது. அமோனியம் குளோரைடு முன்னிலையில் இதை ஆவியாக்கி உலர்த்துவதன் மூலம் நீரிலி வடிவத்தைப் பெறமுடியும். பின்னர் 300 முதல் 500 பாகை செல்சியசு வெப்பநிலைக்கு கலவையைச் சூடுபடுத்துவதால் அமோனியம் குளோரைடு பதங்கமாகி வெளியேறுகிறது.[4] அமோனியம் குளோரைடு சேர்க்கப்படாவிட்டால் கலவை உலர்ந்த பிறகு நீரேறிய ScCl3•nH2O , கலப்பு ஆக்சிகுளோரைடாக மாறிவிடும். இவ்வாறே இசுக்காண்டியம்(III) முப்புளோரோமெத்தேன் சல்போனேட்டும் (திரிப்ளேட்டு) இதனுடன் தொடர்புடைய முப்புளோரோமெத்தேன் சல்போனிக் அமிலத்தில் (திரிப்ளிக் அமிலம்) இருந்து தயாரிக்கப்படுகிறது.[5] இசுக்காண்டியம்(III) ஆக்சைடை ஒடுக்க வினைக்கு உட்படுத்துவதன் மூலமாக உலோகநிலை இசுக்காண்டியம் தயாரிக்க முடியும். முதலில் இசுக்காண்டியம்(III) ஆக்சைடை இசுக்காண்டியம் புளோரைடாக மாற்றி பின்னர் இதனுடன் உலோக கால்சியம் சேர்த்தால் மேற்கண்ட ஒடுக்க வினை நிகழும். இச்செயல்முறை கிட்டத்தட்ட உலோக தைட்டானியம் தயாரிக்கப் பயன்படும் கிரோல் செயல்முறை போன்றதொரு முறையாகும். உயர் ஒரினவரிசை ஆக்சைடுகளான இட்ரியம் ஆக்சைடு மற்றும் இலந்தனம் ஆக்சைடுகள் போலல்லாமல், காரங்களுடன் சேர்ந்து இசுக்காண்டியம்(III) ஆக்சைடு இசுக்காண்டேட்டு உப்புகளை உருவாக்குகிறது. உதாரணம்: பொட்டாசியம் ஐதராக்சைடுடன் சேர்ந்து K மேற்கோள்கள்
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia