செலீனியம் டையாக்சைடு
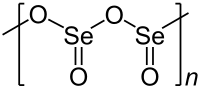
செலீனியம் டையாக்சைடு (Selenium dioxide) என்பது SeO2 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். செலீனியத்தின் அதிகம் கிடைக்கும் மிகமுக்கியமான சேர்மங்களில் இதுவும் ஒன்றாகும். செலீனியம் டையாக்சைடு நிறமற்ற ஒரு திண்மமாகும். பண்புகள்திண்ம செலீனியம் டையாக்சைடு ஒரு-பரிமாண பலபடியாகும். செலீனியம் மற்றும் ஆக்சிசன் அணுக்கள் ஒன்று விட்டு ஒன்றாக இப்பலபடிச் சங்கிலியில் இணைந்துள்ளன. ஒவ்வொரு செலீனியக் கூர்நுனி கோபுரமும் ஒரு விளிம்புநிலை ஆக்சைடு குழுவைப் பெற்றிருக்கின்றன. Se-O பிணைப்பு பாலங்கள் 179 பைக்கோ மீட்டர் நீளம் கொண்டவையாகவும் விளிம்பிலுள்ள Se-O பிணைப்பு 162 பைக்கோ மீட்டர் நீளம் கொண்டதாகவும் அமைந்துள்ளன [3]. பலபடி சங்கிலி முழுவதும் செலீனியம் மையங்கள் ஒன்றுவிட்டு ஒன்றாக அமைந்துள்ளன. வாயு நிலையில் செலீனியம் டையாக்சைடு இருமங்களாகவும் மற்றும் பிற சில்படிமங்களில் அதிக வெப்பநிலையில் இது ஒருமங்களாகவும் காணப்படுகிறது [4]. ஓருறுப்பு வடிவம் கந்தக டை ஆக்சைடின் கட்டமைப்பை போலவே 161 பைக்கோ மீட்டர் நீளம் கொண்ட வளைந்த கட்டமைப்பை ஏற்றுக் கொண்டுள்ளது [4]. இதேபோல ஈருறுப்பு வடிவம் குறைந்த வெப்பநிலை ஆர்கான் அணிக்குழுவில் தனிமைப்படுத்தப்பட்டுள்ளது. இது மையச்சமச்சீர் நாற்காலி வடிவத்தைக் கொண்டிருப்பதாக அதிர்வு நிறமாலை குறிப்பிடுகிறது [3]. செலீனியம் டையாக்சைடை செலீனியம் ஆக்சிடைகுளோரைடில் கரைப்பதால் அதன் முப்படி கிடைக்கிறது [4]. ஓருறுப்பு செலீனியம் டையாக்சைடு என்பது 2.62 டி இருமுனை திருப்புத் திறன் மதிப்பு கொண்ட ஒரு முனைவு மூலக்கூறாகும் [5]. இத்திருப்புத்திறன் இரு ஆக்சிசன் அணுக்களின் நடுப்பகுதியிலிருந்து செலீனியம் அணு வரையுள்ள பகுதியில் சுட்டிக்காட்டப்படுகிறது. இத்திண்மம் உடனடியாக பதங்கமாகிறது. மிகக் குறைந்த செறிவுகளில் அருவருப்பான அழுகிய முள்ளங்கி வாசனையைக் கொண்டுள்ளது, அதிக செறிவுகளில் இதன் நீராவி முள்ளங்கி சாற்றை ஒத்த ஒரு வாசனையைக் கொண்டுள்ளது மற்றும் உள்ளிழுக்கும்போது மூக்கு மற்றும் தொண்டையில் எரிச்சலை கொடுக்கும் SO2 மூலக்கூறு மற்றும் SeO2 ஒரு பரிமாண சங்கிலி என்றாலும், TeO2 ஒரு குறுக்கு-இணைக்கப்பட்ட பலபடியாகும் [3]. SeO2 ஒரு அமில ஆக்சைடாகக் கருதப்படுகிறது. இது தண்ணீரில் கரைந்து செலீனசு அமிலத்தைக் கொடுக்கிறது[4]. செலீனசு அமிலம் என்ற பெயரும் செலீனியம் டையாக்சைடு என்ற பெயரும் பெரும்பாலும் இதற்கு பதில் அதுவாக மாற்றி மாற்றி பயன்படுத்தப்படுகின்றன. காரங்களுடன் செலீனசு அமிலம் வினைபுரிந்து SeO2−3 எதிர்மின் அயனிகளாலான செலீனைட்டு உப்புகள் உருவாகின்றன. சோடியம் ஐதராக்சைடுடன் வினைபுரிந்து சோடியம் செலீனைட்டு உருவாகும் வினையை இதற்கு உதாரணமாகக் கூறலாம்.
தயாரிப்புஎரியும் காற்றில் செலீனியத்தை ஆக்சிசனேற்றம் செய்தால் செலீனியம் டையாக்சைடு உருவாகிறது. நைட்ரிக் அமிலம் அல்லது ஐதரசன் பெராக்சைடுடன் செலீனியத்தை வினைபுரியச் செய்தும் இதை தயாரிக்கலாம். செலீனசு அமிலத்தை நீர் நீக்கம் செய்து தயாரிக்கும் முறையே வசதியான தயாரிப்பு முறையாகும்.
தோற்றம்தௌனியைட்டு என்ற கனிமம் செலீனியம் டையாக்சைடின் இயற்கை தோற்றமாகும். மிகவும் அரிய வகை கனிமமான இது எரியும் நிலக்கரி குவியல்களில் மட்டும் அரிதாகக் காணப்படுகிறது:[6]. பயன்கள்கரிமத் தொகுப்பு வினைகள்செலீனியம் டையாக்சைடு கரிமத் தொகுப்பு வினைகளில் ஒரு முக்கியமான வினையாக்கியாகும். அசிட்டால்டிகைடின் முப்படியான பாரால்டிகைடின் ஆக்சிசனேற்ற வினையில் செலீனியம் டையாக்சைடு கிளையாக்சாலைக் கொடுக்கிறது[7]. வளையயெக்சனோனுடன் சேர்த்து ஆக்சிசனேற்றம் செய்தால் வளையயெக்சேன்-1,2-டையோன் சேர்மம் உருவாகிறது[8]. வினையின் தொடக்கப்பொருளான செலீனியம் சேர்மம் ஒடுக்கப்பட்டு செலீனியமாகிறது. இது சிவப்பு நிற படிகவடிவமற்ற திண்மமாக வீழ்படிவாகிறது. இதை எளிதாக வடிகட்டி பிரித்துக்கொள்ள முடியும்[8]. இவ்வகை வினை ரிலே ஆக்சிசனேற்றம் என்ற பெயரால் அழைக்கப்படுகிறது. அல்லைலிக் வகை ஆக்சிசனேற்ற வினையிலும் செலீனியம் டையாக்சைடு வினையாக்கியாகச் செயல்படுகிறது[9].  பொதுவாக இவ்வினையை கீழ்கண்டவாரு விவரிக்கலாம்.
இங்குள்ள R, R', R" என்பவை ஆல்க்கைல் அல்லது அரைல் பதிலிடுகளாகும். ஒரு நிறமூட்டியாகசெலினியம் டை ஆக்சைடு கண்ணாடிக்கு சிவப்பு நிறத்தை அளிக்கிறது. இரும்பு அசுத்தங்கள் காரணமாக நிறத்தை எதிர்த்து நிற்கவும், அதனால் வெளிப்படையான நிறமற்ற கண்ணாடிகளை உருவாக்கவும் இது சிறிய அளவில் பயன்படுத்தப்படுகிறது. அதிக அளவில் பயன்படுத்தினால் செலீனியம் டையாக்சைடு மாணிக்கச் சிவப்பு நிறத்தை அளிக்கிறது. செலினியம் டை ஆக்சைடு சில குளிர்-புளூயிங் தீர்வுகளில் செயலில் உள்ள மூலப்பொருள் ஆகும். எஃகை நீலமாக்கும் சிலவகை கரைசல்களில் செலீனியம் டையாக்சைடு ஒரு செயல்திறன் கொண்ட உட்கூறாக கலந்துள்ளது. புகைப்படத் தொழிலில் அச்சு மைப்பொடியாகவும் செலீனியம் டையாக்சைடு பயன்படுத்தப்படுகிறது. பாதுகாப்புசெலினியம் ஒரு முக்கியமான உலோகம் என்றாலும் ஒரு நாளைக்கு 5 மி.கி.க்கு மேல் உட்கொள்ள நேரிட்டால் குறிப்பிடப்படாத அறிகுறிகள் தோன்றுகின்றன [10]. மேற்கோள்கள்
புற இணைப்புகள் |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia