சோடியம் டைதயோனைட்டு
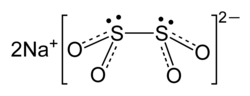
சோடியம் டைதயோனைட்டு (Sodium dithionite) என்பது Na2S2O4 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும்.சோடியம் ஐதரோசல்பைட்டு என்ற பெயராலும் இது அழைக்கப்படுகிறது. கந்தக வாசனையுடன் வெண்மை நிறங்கொண்டு படிகத் தூளாக சோடியம் டைதயோனைட்டு காணப்படுகிறது. காற்று இல்லாத நிலையில் இது நிலையானது என்றாலும், அது சூடான நீரிலும் அமிலக் கரைசல்களிலும் சிதைகிறது . கட்டமைப்புராமன் நிறமாலையியல் மற்றும் ஒற்றை-படிக எக்சுகதிர் விளிம்புவளைவு ஆய்வுகள், டைதயோனைட்டு அயனியின் வடிவியல் நெகிழ்வானது என்பதை வெளிப்படுத்துகின்றன. டைதயோனைட்டு ஈரெதிர்மின் அயனி C2 சமச்சீர் ஒழுங்கில் 16° முறுக்குக் கோணத்தில் கிட்டத்தட்ட நேரெதிராக உள்ள O-S-S-O பிணைப்புடன் காணப்படுகிறது. நீரேற்று வடிவத்தில் (Na2S2O4•2H2O) டைதயோனைட்டு எதிர்மின் அயனி பிணைப்பு நீளம் குறைவாகக் கொண்டு 56° முறுக்குக் கோணத்தில் O-S-S-O பிணைப்புக் கோணத்துடன் காணப்படுகிறது[1]. S-S பிணைப்பின் பலவீனத்தை S-S பிணைப்பு நீளம் 239 பைக்கோமீட்டர் மூலம் அடையாளப்படுத்தப்படுகிறது. இந்த பிணைப்பு உடையக்கூடியதாக இருப்பதால் டைதயோனைட்டு எதிர்மின் அயனி கரைசலில் [SO2]− என்ற இயங்குறுப்பு அயனியாக பிரிகையடைகிறது. எலக்ட்ரான் பாராகாந்த ஒத்ததிர்வு நிறமாலையியல் முடிவுகளும் இதை உறுதிபடுத்துகின்றன. 35S ஆனது நடுநிலை அல்லது அமிலக் கரைசலில் S2O42− மற்றும் SO2 அயனிகளுக்கு இடையில் விரைவான பரிமாற்றத்திற்கு உட்பட்டு பலவீனமான எதிர்மின் அயனியிலுள்ள S-S பிணைப்புடன் ஒத்துப்போகிறது[2]. தயாரிப்புகந்தக டை ஆக்சைடை ஒடுக்குவதன் மூலம் சோடியம் டைதயோனைட்டு தொழில்துறை ரீதியாக உற்பத்தி செய்யப்படுகிறது. துத்தநாக தூள், சோடியம் போரோ ஐதரைடு மற்றும் பார்மேட்டு ஆகியவற்றுடன் சேர்த்து ஒடுக்குதல் உட்பட பல தயாரிப்பு முறைகள் பயன்படுத்தப்படுகின்றன. 1990 ஆம் ஆண்டில் சுமார் 300,000 டன் சோடியம் டைதயோனைட்டு உற்பத்தி செய்யப்பட்டது [3]. பண்புகள் மற்றும் வினைகள்நீராற்பகுப்புஉலர் நிலையில் சோடியம் டைதயோனைட்டு நிலையானதாக உள்ளது. ஆனால் பின்வரும் வினை காரணமாக நீரிய கரைசல்கள் சிதைகின்றன.
இந்த பண்பு டைதயோனசு அமிலத்தின் நிலையற்ற தன்மையுடன் ஒத்துப்போகிறது . இதனால், சோடியம் டைதயோனைட்டு கரைசல்களை நீண்ட காலத்திற்கு சேமிக்க முடியாது [2]. காற்றில் 90 பாகை செல்சியசு வெப்பநிலைக்கு மேல் சூடாக்கினால் நீரற்ற சோடியம் டைதயோனைட்டு சோடியம் சல்பேட்டு மற்றும் கந்தக டை ஆக்சைடுகளாக சிதைகிறது. காற்று இல்லாத நிலையில், இது 150 பாகை செல்சியசு வெப்பநிலைக்கு மேல் விரைவாக சோடியம் சல்பைட்டு, சோடியம் தயோசல்பேட்டு கந்தக டை ஆக்சைடு மற்றும் சுவடு அளவு கந்தகம் போன்றவைகளாக சிதைகிறது. ஏற்ற ஒடுக்க வினைகள்சோடியம் டைதயோனைட்டு ஓர் ஒடுக்கும் முகவராகும். pH=7 ஆக இருக்கும்போது இதன் ஒடுக்கும் திறன் சாதாரண ஐதரசன் மின்வாயில் -0.66 வோல்ட்டு ஆகும். சல்பைட்டு உருவாகும்போது ஒடுக்கம் நிகழ்கிறது:[4]
சோடியம் டைதயோனைட்டு ஆக்சிசனுடன் வினைபுரிகிறது.
இந்த வினைகள் பைசல்பைட்,டு தயோசல்பேட்டு மற்றும் கந்தக டை ஆக்சைடு சம்பந்தப்பட்ட சிக்கலான pH- சார்ந்த சமநிலையை வெளிப்படுத்துகின்றன. கரிமக் கார்பனைல்களுடன்ஆல்டிகைடுகளின் முன்னிலையில், சோடியம் டைதயோனைட்டு வினைபுரிந்து அறை வெப்பநிலையில் α- ஐதராக்சி - சல்பினேட்டுகளை உருவாக்குகிறது அல்லது 85 பாகை செல்சியசுக்கு மேற்பட்ட வெப்பநிலையில் ஆல்டிகைடை தொடர்புடைய ஆல்ககாலாக ஒடுக்குகிறது [5][6]. இதேபோன்ற நிலைமைகளின் கீழ் சில கீட்டோன்களும் குறைக்கப்படுகின்றன. பயன்பாடுகள்தொழிற்துறைஇந்த சேர்மம் நீரில் கரையக்கூடிய ஓர் உப்பாகும்., மேலும் இதை நீரிய கரைசல்களில் ஒடுக்கும் முகவராகப் பயன்படுத்தப்படலாம். கந்தக சாயங்கள், தொட்டி சாயங்கள் தொடர்பான தொழில்துறை சாயமிடுதல் செயல்முறைகள் சிலவற்றில் இது பயன்படுத்தப்படுகிறது. நீரில் கரையாத சாயங்களை நீரில் கரையக்கூடிய கார உலோக உப்புகளாக மாற்ற இது பயன்படுகிறது. உதாரணம் இண்டிகோ சாயம் [7]. சோடியம் டைதயோனைட்டின் ஒடுக்கும் பண்புகள் அதிகப்படியான சாயம், மீதமுள்ள ஆக்சைடு மற்றும் திட்டமிடப்படாத நிறமிகளை நீக்குகிறது, இதனால் ஒட்டுமொத்த வண்ணத் தரமும் மேம்படுகிறது. நீர் சுத்திகரிப்பு, வாயு சுத்திகரிப்பு, சுத்தம் செய்தல் மற்றும் அகற்றுதல் ஆகிய செயல்பாடுகளுக்கும் சோடியம் டைதையோனைட்டை பயன்படுத்தப்படலாம்.. தொழில்துறை செயல்முறைகளில் சல்போனேற்றும் முகவராக அல்லது சோடியம் அயனியின் மூலமாகவும் பயன்படுத்தப்படலாம். நெசவுத் தொழில் பயன்பாட்டுடன் கூடுதலாக, தோல், உணவுகள், பலபடிகள், , புகைப்படம் எடுத்தல் மற்றும் பல தொடர்புடைய தொழில்களில் இந்த சேர்மம் பயன்படுத்தப்படுகிறது. சோடியம் டைதயோனைட்டின் உயிர்கொல்லும் அளவு கிலோகிராமுக்கு 5 கிராம் மட்டுமே என்பதால் இது அதன் பரந்த அளவில் பயன்பாடுகளை கொண்டுள்ளது. கரிம வினைகளில் டிகோலூரைசிங் முகவராகவும் நிறம் நீக்கும் முகவராகவும் இது பயன்படுத்தப்படுகிறது. உயிரியலில்சோடியம் டைதயோனைட்டு பெரும்பாலும் உடலியல் சோதனைகளில் கரைசல்களின் ஒடுக்கும் திறனைக் குறைப்பதற்கான வழிமுறையாகப் பயன்படுத்தப்படுகிறது. பொட்டாசியம் பெர்ரிசயனைடு இச்சோதனைகளில் ஆக்சிசனேற்றும் வேதிப்பொருளாகப் பயன்படுத்தப்படுகிறது. கூடுதலாக, முதன்மை சிலிக்கேட்டு தாதுக்களில் இணைக்கப்படாத இரும்பின் அளவை தீர்மானிக்க சோடியம் டைதயோனைட்டு பெரும்பாலும் மண் வேதியியல் சோதனைகளில் பயன்படுத்தப்படுகிறது. எனவே, சோடியம் டைதயோனைட்டு மூலம் பிரித்தெடுக்கப்படும் இரும்பு தூய்மையான இரும்பு என்றும் குறிப்பிடப்படுகிறது. டைதயோனைட்டு அயனியின் இரண்டு மற்றும் மூன்று இணைதிறன் உலோக நேர்மின் அயனிகளின் தீவிரமான நாட்டம் இரும்பின் கரைதிறனை அதிகரிக்க அனுமதிக்கிறது, எனவே டைதயோனைட்டு ஒரு பயனுள்ள இடுக்கி இணைப்பு முகவராகும். ஆய்வகப் பயன்பாடுவாயு ஓட்டத்திலிருந்து ஆக்சிசனை அகற்றுவதற்காக பயன்படுத்தப்பட்ட பிசர் கரைசலை தயாரிக்க சோடியம் டைதயோனைட்டு கரைசல்கள் ஒரு காலத்தில் பயன்படுத்தப்பட்டன [8]. பைரித்தியோன் சேர்மத்தை இரண்டு படி தொகுப்பாக்கத்தில் இருந்து தயாரிக்க முடியும். இதற்காக 2-புரோமோபிரிடினை ஒரு பொருத்தமான பெர் அமிலம் மூலம் ஆக்சிசனேற்றம் செய்து தொடர்ந்து தயோல் குழுவை அறிமுகம் செய்ய சோடியம் டைதயோனைட்டு பயன்படுத்தப்படுகிறது. மேற்கோள்கள்
புற இணைப்புகள்
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia