சோடியம் சல்பேட்டு
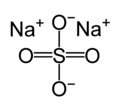
சோடியம் சல்பேட்டு (Sodium sulfate) என்பது Na2SO4 என்ற மூலக்கூறு வாய்ப்பாட்டை உடைய கனிமச் சேர்மம் ஆகும். இது சோடாவின் சல்பேட்டு (sulfate of soda) எனவும் அழைக்கப்படுகிறது. மேலும் பல்வேறு ஐதரேட்டுகளையும் கொண்டுள்ளது. அனைத்து வடிவங்களும் நீரில் எளிதில் கரையக்கூடிய வெண்மை நிறத் திண்மங்கள் ஆகும். டெக்காஐதரேட்டானது, அதிகமாக உற்பத்தி செய்யக்கூடிய, அதாவது ஆண்டொன்றுக்கு 6 மில்லியன் டன்கள் உற்பத்தியாகக் கூடிய வேதிச்சேர்மமாக உள்ளது. இந்தச் சேர்மமானது அதிக அளவில் துாய்மையாக்கிகள் தயாரிப்பிலும், காகிதத்தை தூய்மை செய்யும் கிராப்ட்டு முறையிலும் பயன்படுகிறது.[2] வடிவங்கள்
வரலாறுசோடியம் சல்பேட்டின் டெகாஐதரேட்டானது, டச்சு/செருமனி நாட்டைச் சேர்ந்த வேதியியலாளரும், மருந்தியலாளருமான யோகான் ரூடால்ப் கிளாபர் (1604–1670) என்பவரால் ஆசுதிரிய நாட்டின் நீரூற்றுகளில் காணப்படும் நீரில் இருந்து கண்டுபிடிக்கப்பட்டது. இதன் காரணமாக இந்த உப்பானது கிளாபரின் உப்பு என அழைக்கப்படுகிறது. யோகான் கிளாபர் இந்த உப்பிற்கு இதன் மருத்துவப் பண்புகள் காரணமாக சால் மிராபிலிசு (அதிசய உப்பு) எனப் பெயரிட்டார். 1900 ஆண்டுகளில், வேறு திறன் படைத்த மலமிளக்கிகள் உபயோகத்திற்கு வருவதற்கு முன்னதாக, சோடியம் சல்பேட்டானது பொதுவான மலமிளக்கியாகப் பயன்படுத்தப்பட்டு வந்தது.[3][4] 18 ஆம் நுாற்றாண்டில், வேதித் தொழிற்துறையில் சோடியம் கார்பனேட்டு தயாரிப்பில் கிளாபரின் உப்பு அதிக அளவில் பயன்படுத்தப்பட்டது. பொட்டாசியம் கார்பனேட்டுடன் இந்த உப்பினை வினைப்படுத்தி சோடியம் கார்பனேட்டுத் தயாரிக்கப்பட்டது. சோடா சாம்பலின் (சோடியம் கார்பனேட்டு) தேவை அதிகரிக்க, அதிகரிக்க சோடியம் சல்பேட்டின் உற்பத்தி அளவும் அதிகரித்தது. பத்தொன்பதாம் நுாற்றாண்டில், லெப்லாங்கு முறை அதிக அளவில் சோடா சாம்பலைத் தயாரிக்கும் முறையாக மாறியது. இந்த முறையில் முக்கிய இடைவினைபொருளாக சோடியம் சல்பேட்டானது தொகுப்பு முறையில் தயாரிக்கப்பட்டது.[5] இயற்பியல் மற்றும் வேதிப்பண்புகள்சாதாரண வெப்பநிலைகளில் சோடியம் சல்பேட்டானது ஆக்சிசனேற்றி அல்லது ஒடுக்க வினைபொருட்களுடன் வினைபுரியும் தன்மையற்று நிலையான சேர்மமாக உள்ளது. உயர் வெப்பநிலைகளில் உயர்வெப்பக்கார்பன் வினைகளின் மூலமாக சோடியம் சல்பைடாக மாற்றமடைகிறது.[6]
அமில-கார வினைகள்சோடியம் சல்பேட்டானது நடுநிலைத்தன்மையுடைய உப்பாகும். இதன் நீரிய கரைசலின் pH மதிப்பு 7 ஆக உள்ளது. இத்தகைய கரைசல்களின் நடுநிலைத்தன்மையிலிருந்து சல்பேட்டானது வலிமை மிக்க கந்தக அமிலத்திலிருந்து பெறப்பட்டிருக்கலாம் என்பதை உறுதி செய்கிறது. மேலும், Na+ அயனியானது, உலோக அயனிகள் நீர்க்கரைசல்களில் இருக்கும் நிலையில், ஒரே ஒரு நேர்மின் சுமையுடன் ஈனி நீர் மூலக்கூறுகளை மிகவும் பலவீனமாக முனைவுறுத்துகிறது. சோடியம் சல்பேட்டானது கந்தக அமிலத்துடன் வினைபுரிந்து சோடியம் பைசல்பேட்டு எனும் அமில உப்பைத் தருகிறது.[7][8]
இந்த வினைக்கான சமநிலை மாறிலியானது செறிவு மற்றும் வெப்பநிலையைச் சார்ந்தே உள்ளது. கரைதிறன் மற்றும் அயனிப்பரிமாற்றம்சோடியம் சல்பேட்டானது வழக்கத்திற்கு மாறான நீரில் கரைதிறன் பண்புகளைக் கொண்டுள்ளது.[9] நீரில் இதனுடைய கரைதிறனானது 0 °C முதல் 32.384 °C வரையிலான வெப்பநிலையில் பத்து மடங்குக்கும் மேலாக அதிகரிக்கிறது. இது அதிகபட்சநிலையை 49.7 g/100 mL இல் அதிகரிக்கிறது. இந்த வெப்பநிலையில் கரைதிறன் வளைவின் சாய்வு மாறுகிறது. மேலும், இந்த நிலையில் கரைதிறனானது, வெப்பநிலையைப் பொறுத்து மாறாத நிலையைப் பெறுகிறது. 32.384 °C யில் வெப்பநிலையானது படிகத்தில் உள்ள நீரானது வெளியேறக்கூடிய, நீரேற்றப்பட்ட உப்பு உருகக்கூடிய வெப்பநிலையாகும். இந்த வெப்பநிலை வெப்பமானிகளில் அளவுகள் குறிப்பதற்கு மிகத் துல்லியமான ஒரு நிலையாகப் பயன்படுகிறது. சோடியம் சல்பேட்டானது, நிலைமின்னியல் கவர்ச்சியை அடிப்படையாகக் கொண்ட, சோடியம் Na+ அயனியையும், சல்பேட் SO42− அயனியையும் கொண்ட அயனிப்பிணைப்பு சேர்மமாகும். சல்பேட் அயனிகளின் இருப்பினை பேரியம் Ba2+ மற்றும் காரீய அயனிகளின் Pb2+ உப்புக்களோடு வினைபுரியும் போது கரையாத சல்பேட்டுகள் உருவாவதிலிருந்து உறுதிப்படுத்தப்படலாம்.
 சோடியம் சல்பேட்டானது இரட்டை உப்புக்களை உருவாக்குவதற்கான போக்கினை மிதமாகவே காட்டுகிறது. பல நிலையான படிகார இரட்டை உப்புக்களை உருவாக்கக்கூடிய பொட்டாசியம் சல்பேட்டு மற்றும் அம்மோனியம் சல்பேட்டு போல இல்லாமல் சோடியம் சல்பேட்டானது, NaAl(SO4)2 ( 39 °C வெப்பநிலைக்கு மேல் நிலையற்றது) மற்றும் NaCr(SO4)2 ஆகிய படிகார உப்புக்களை மட்டுமே பொதுவான மும்மை இணைதிறன் கொண்ட உலோகங்களுடன் உருவாக்குகின்றது.[10] இயற்கையில் கிளாசரைட்டு Na2SO4•3K2SO4 போன்ற கனிமத்தையும் உள்ளடக்கி வேறு கார உலோகங்களின் சல்பேட்டுகளுடன் இணைந்த இரட்டை உப்புகள் அறியப்படுகின்றன. பொட்டாசியம் குளோரைடுடன் சோடியம் சல்பேட்டின் வினையின் காரணமாக கிளாசரைட்டு உருவாதலானது, பொட்டாசியம் சல்பேட்டு என்ற உரத்தயாரிப்புக்கான அடிப்படையாக உள்ளது.[11] சோடியம் சல்பேட்டின் மேலும் சில இரட்டை உப்புக்கள் பின்வருமாறு 3Na2SO4•CaSO4, 3Na2SO4•MgSO4 (வேன்தோபைட்டு) மற்றும் NaF•Na2SO4.[12] அமைப்புபடிகங்கள் எண்முக மூலக்கூறு அமைப்பைக் கொண்ட [Na(OH2)6]+ அயனிகளைக் கொண்டுள்ளன. எண்முகியின் விளிம்புகளில் மொத்தமுள்ள பத்து நீர் மூலக்கூறுகளில் சோடியம் அணுவால் பிணைக்கப்பட்ட எட்டு மூலக்கூறுகளை பகிர்ந்து கொள்கின்றன. சல்பேட்டுடன் ஐதரசன் பிணைப்பால் இணைக்கப்பட்ட இரண்டு மூலக்கூறுகள் இடைவெளிகளுக்குள் காணப்படுகின்றன. இந்த [Na(OH2)6]+ நேர்மின் அயனிகள் சல்பேட்டு எதிர்மின் அயனிகளுடன் ஐதரசன் பிணைப்பால் பிணைக்கப்பட்டுள்ளன. Na-O தொலைவானது 240 pm ஆக உள்ளது.[13] படிக சோடியம் சல்பேட்டு டெகாஐதரேட்டானது நீரேற்றம் செய்யப்பட்ட உப்புக்களில் வழக்கமான பண்புகளிலிருந்து அளந்தறியக்கூடிய மீதியான வெந்திரப்பியைக் கொண்டுள்ள வகையில் வித்தியாசப்படுகிறது. (தனிச்சுழி வெப்பநிலையில் வெந்திரப்பி மதிப்பு 6.32 J•K−1•mol−1. மற்ற ஐதரேட்டுகளுடன் ஒப்பிடும் போது, மிக மிக வேகமாக நீர் மூலக்கூறுகளை பங்கிட்டுக்கொள்ளும் திறனே இந்த வேறுபாட்டிற்கான காரணமாக இருக்கலாம்.[14] தயாரிப்புஉலக அளவிலான தனிப்பட்ட டெக்காஐதரேட்டு வகை சோடியம் சல்பேட்டின் உற்பத்தியானது ஆண்டொன்றுக்கு தோராயமாக 5.5 முதல் 6 மில்லியன் டன்கள் (Mt/a) ஆகும். 1985 ஆம் ஆண்டில் இதனுடைய உற்பத்தி 4.5 மில்லியன் டன்களாக (Mt/a) இருந்தது. இந்த உற்பத்தி இயற்கை மூலங்களிலிருந்து பாதியளவும், வேதித்தொழிற்சாலைகளிலிருந்து பாதியளவும் கிடைக்கப்பெற்றது. 2000 ஆண்டுக்குப் பிறகு 2006 ஆம் ஆண்டு வரை இயற்கை மூலங்களிலிருந்து கிடைக்கப்பெற்ற உற்பத்தி ஆண்டொன்றுக்கு 4 மில்லியன் டன்கள் (Mt/a) அளவுக்கு உயர்ந்தும், வேதிமுறைகளிலான தயாரிப்பு ஆண்டொன்றுக்கு 1.5 முதல் 2 மில்லியன் டன்கள் (Mt/a) அளவுக்கு குறைந்தும் இருந்தது.[15][16][17][18] எல்லாவிதமான பயன்பாடுகளுக்கும் இயற்கை மூலங்களிலிருந்து தயாரிக்கப்பட்ட சோடியம் சல்பேட்டாக இருந்தாலும், வேதி முறைகளிலிருந்து தயாரிக்கப்பட்ட சோடியம் சல்பேட்டாக இருந்தாலும் ஒன்றுக்கொன்று மாற்றாக பயன்படுத்தக்கூடியவையே. இயற்கை மூலங்களிலிருந்து தயாரிப்புடெக்காஐதரேட்டின் (கிளாபரின் உப்பு) உலக உற்பத்தியில் மூன்றில் இரண்டு பங்கு இயற்கையில் தெற்கு சசுகாச்சுவானின் ஏரிப்படுகைகளிலிருந்து கிடைக்கும் மிராபிலைட்டு போன்ற கனிமங்களிலிருந்து கிடைக்கிறது. 1990 ஆம் ஆண்டில், மெக்சிகோ மற்றும் இசுபெயின் (ஒவ்வொரு நாட்டிலும் ஏறத்தாழ 500,000 டன்கள்) ஆகிய நாடுகளே உலகின் இயற்கை மூலங்களிலிருந்து பெறப்படும் சோடியம் சல்பேட்டின் முக்கிய உற்பத்தி இடங்களாக இருந்தன. உருசியா, அமெரிக்க ஐக்கிய நாடுகள், கனடா ஆகிய நாடுகள் ஒவ்வொன்றும் ஏறத்தாழ 350,000 டன்களை உற்பத்தி செய்வனவாக இருந்தன.[16] ஒட்டுமொத்த இயற்கை மூலங்கள் 1 பில்லியன் டன்களுக்கும் மேலாக இருக்கும் என்று மதிப்பிடப்பட்டுள்ளது.[15][16] சியர்லெசு வேலி மினரல்சு (கலிபோர்னியா, ஐக்கிய அமெரிக்க நாடுகள்), ஏர்பார்ன் இண்டசுட்ரியல் மினரல்சு, (சசுகாட்சேவான், கனடா), குயிமிகா டெல் ரே (கோகுயிலா, மெக்சிகோ), மினரா டி சான்டா மார்டா மற்றும் கிரியாடெராசு மினரல்சு டெரிவடாசு குருபோ கிரிமிடெசா (பர்கோசு, இசுபெயின்), மினரா டி சான்டா மார்டா (டொலேடோ, இசுபெயின்), சல்குயிசா (மேட்ரிட், இசுபெயின்), செங்டு சன்லியன் டியான்குவான் கெமிகல் (சிசுவான், சீனா), ஹாங்சே யின்சு கெமிகல் க்ரூப் (ஜியாங்சு, சீனா), நஃபைன் கெமிகல் இண்டசுட்ரி குரூப் (சாங்சி, சீனா), சிசுவான் புரோவின்சு சௌன்மி மிராபிலைட் (சிசுவான், சீனா), மற்றும் குச்சுக்சுல்பட் ஜேஎஸ்சி (அல்டாய் கிராய், சைபீரியா, இருசியா) ஆகியவை ஆண்டொன்றுக்கு இரண்டு இலட்சம் டன்கள் முதல் 15 இலட்சம் டன்கள் வரை உற்பத்தி செய்யும் முக்கிய உற்பத்தியாளா்கள் ஆவர்.[15][17] உலர்ந்த சுற்றுப்புறத்தில் நீரற்ற சோடியம் சல்பேட்டு தெனார்டைட்டு கனிமமாக காணப்படுகிறது. ஈரப்பதமான காற்றுள்ள சூழ்நிலையில் நீரற்ற சோடியம் சல்பேட்டானது மிராபிலைட்டாக மாறுகிறது. சோடியம் சல்பேட்டானது கால்சியம் சோடியம் சல்பேட்டு கனிமமான கிளாபரைட்டு ஆகவும் கிடைக்கிறது. வேதித்தொழில்துறை மூலமான தயாரிப்புஉலகில் உற்பத்தியாகும் சோடியம் சல்பேட்டின் மூன்றில் ஒரு பகுதியானது வேதித்தொழிற்சாலைகளின் செயல்முறைகளில் உபவிளைபொருளாகத் தயாரிக்கப்படுகிறது. இத்தகைய தயாரிப்பு முறைகள் அனைத்துமே முதன்மை செயல்முறையின் உள்ளார்ந்ததாகவே உள்ளன. ஓரளவுக்குத் தான் சிக்கனமான முறையாக கருதப்படுகிறது. ஆகவே, வேதித் தொழில் துறையில் ஒரு உப விளை பொருளாக சோடியம் சல்பேட்டைத் தயாரிக்கும் முறை தொடர்ந்து சரிவடைந்து வருகிறது. சோடியம் குளோரைடு (உப்பு) மற்றும் சல்பூரிக் அமிலம் ஆகியவற்றிலிருந்து ஐதரோகுளோரிக் அமிலம் தயாரிக்கப் பயன்படும் மான்கீம் செயல்முறை அல்லது கந்தக டை ஆக்சைடிலிருந்து ஐதரோகுளோரிக் அமிலம் தயாரிக்கப் பயன்படும் ஜேம்சு ஹர்கிரீவ்சு முறை ஆகிய முறைகளே சோடியம் சல்பேட்டைத் தயாரிக்கப் பயன்படும் மிக முக்கியமான வேதியியல் முறைகளாகும்.[19][20] இந்தச் செயல்முறையில் தயாரிக்கப்படும் சோடியம் சல்பேட்டானது உப்புக் கட்டி என அழைக்கப்படுகிறது.
இரண்டாவது முக்கியமான தயாரிப்பு முறையானது, அதிக அளவில் ரேயான் தயாரிக்கப் பயன்படுகின்ற அதிக அளவிலான சோடியம் ஐதராக்சைடு கொண்டு கந்தக அமிலத்தை நடுநிலையாக்கல் செய்யும் வினையாகும். இந்த முறையானது தொடர்ச்சியாக பயன்படுத்தப்படுகின்ற மற்றும் ஆய்வகத்தில் எளிதில் கையாளக்கூடிய முறையாகும்.: 2 NaOH(aq) + H2SO4(aq) → Na2SO4(aq) + 2 H2O(l) ஆய்வகத்தில் சோடியம் பை கார்பனேட்டு மற்றும் மெக்னீசியம் சல்பேட்டு ஆகியவற்றுக்கிடையேயான வினையினைப் பயன்படுத்தி தொகுப்பு முறையில் சோடியம் சல்பேட்டானது தயாரிக்கப்படலாம்.
முன்னதாக, கந்தக அமிலத்தை சோடியம் குரோமேட்டுக் கரைசலுடன் வினைபுரிய வைத்து சோடியம் டை குரோமேட்டு தயாரிக்கப் பயன்படும் வினையில் சோடியம் சல்பேட்டானது ஓர் உப விளைபொருளாக கிடைத்தது. மாற்று முறையாக, சோடியம் சல்பேட்டானது லித்தியம் கார்பனேட்டு, கொடுக்கிணைப்புக் காரணிகள், ரெசார்சினால், அசுகார்பிக் காடி, சிலிகா , நைட்ரிக் காடி மற்றும் பீனால் ஆகியவற்றின் தயாரிப்பில் உப விளைபொருளாகக் கிடைக்கிறது.[15] சான்றுகள்
புற இணைப்புகள்
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia