வெள்ளீயம்(IV) ஆக்சைடு
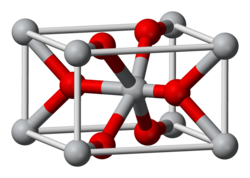
வெள்ளீயம்(IV) ஆக்சைடு (Tin(IV) oxide) என்பது SnO2 என்ற மூலக்கூற்று வாய்ப்பாட்டால் விவரிக்கப்படும் ஒரு கனிம வேதியியல் சேர்மமாகும். சிடானிக் ஆக்சைடு என்ற பெயராலும் இச்சேர்மம் அழைக்கப்படுகிறது. வெள்ளீய(IV) ஆக்சைடின் கனிமவியல் பெயர் கேசிட்டரைட்டு என்பதாகும். இதுவே வெள்ளீயத்தினுடைய முக்கியமான தாதுவுமாகும் [9]. பல்வேறு வகையான பெயர்களுடன் வெள்ளீயத்தின் இந்த ஆக்சைடு சேர்மம் வேதியியலில் ஒரு முக்கியமான பொருளாகக் கருதப்படுகிறது. நிறமற்றும் டையா காந்தப் பண்பும் ஈரியல்பு நிலை கொண்ட ஆக்சைடு திண்மமாகவும் இது வகைப்படுத்தப்படுகிறது.  உரூட்டைக் கட்டமைப்பில் வெள்ளீய(IV) ஆக்சைடு சேர்மம் படிகமாகிறது. இதன்படி வெள்ளீயம் அணுக்கள் ஆறு ஒருங்கிணைப்புகளும் ஆக்சிசன் அணுக்கள் மூன்று ஒருங்கிணைப்புகளும் கொண்டுள்ளன [9]. SnO2 பொதுவாக ஆக்சிசன் குறைபாடுள்ள என்- வகை குறைக்கடத்தியாகக் கருதப்படுகிறது [10]. இதன் உருகுநிலை 1630 பாகை செல்சியசு வெப்பநிலையாகும்[4] வெள்ளீய(IV) ஆக்சைடின் நீரேற்ற வடிவம் வெள்ளீய அமிலம் அல்லது சிடானிக் அமிலம் என்று விவரிக்கப்படுகிறது. இத்தகைய பொருள்கள் வெள்ளீய(IV) ஆக்சைடின் நீரேறிய துகள்கள் போல தோன்றுகின்றன. இந்த உள்ளடக்கம் துகள்களின் அளவிலும் பிரதிபலிக்கிறது [11]. தயாரிப்புவெள்ளீய(IV) ஆக்சைடு இயற்கையாகத் தோன்றுகிறது. செயற்கை முறை வெள்ளீய(IV) ஆக்சைடை வெள்ளீயம் உலோகத்தை காற்றில் எரிப்பதன் மூலம் தயாரிக்கலாம்[11]. 10 கிலோடன் அளவுக்கு வெள்ளீய(IV) ஆக்சைடு ஆண்டுதோறும் தயாரிக்கப்படுகிறது [11]. SnO2 சேர்மத்தை தொழிற்சாலை முறையில் ஒலியதிர்வு உலையில் கார்பனுடன் சேர்த்து 1200 முதல் 1300 பாகை செல்சியசு வெப்பநிலையில் ஒடுக்கும் போது வெள்ளீயம் உலோகம் கிடைக்கிறது [12]. ஈரியல்பு நிலைSnO2 நீரில் கரையாது என்றாலும் ஈரியல்பு நிலையைக் கொண்டதாகும். காரம் மற்றும் அமிலம் இரண்டிலும் இது கரைகிறது[13]. சிடானிக் அமிலம் நீரேறிய வெள்ளீய(IV) ஆக்சைடு என விவரிக்கப்படுகிறது (SnO2), இச்சேர்மம் சிடானிக் ஐதராக்சைடு அல்லது வெள்ளீய ஐதராக்சைடு என்ற பெயர்களாலும் அழைக்கப்படுகிறது. வெள்ளீய ஆக்சைடுகள் அமிலங்களில் கரைகின்றன. ஆலசன் அமிலங்கள் SnO2 சேர்மத்தை தாக்கி [SnI6]2− உள்ளிட்ட எக்சா ஆலோசிடானேட்டுகளைக் கொடுக்கின்றன[14] வெள்ளீய ஆக்சைடின் ஒரு மாதிரி உப்பு ஐதரயோடிக் அமிலத்துடன் பலமணி நேரம் வினைபுரிகிறது என்று ஓர் அறிக்கை தெரிவிக்கிறது[15]
இதேபோல, SnO2 கந்தக அமிலத்தில் கரைந்து வெள்ளீய சல்பேட்டைக் கொடுக்கிறது:[11]
SnO2 வலிமையான காரங்களில் கரைந்து சிடானேட்டுகளை கொடுக்கிறது. சோடியம் சிடானேட்டின் முறையான மூலக்கூறு வாய்ப்பாடு Na2SnO3]].ஆகும்[11]. திண்மமான SnO2/NaOH உருகலை நீரில் கரைத்தால் Na2[Sn(OH)6]2 உருவாகிறது. இது சாயத் தொழிற்சாலையில் பயன்படுகிறது[11]. பயன்கள்அரோமாட்டிக் சேர்மங்களான கார்பாக்சிலிக் அமிலங்களையும் அமில நீரிலிகளையும் தயாரிக்கும் வினைகளில் வனேடியம் ஆக்சைடுடன் இதை சேர்த்து வினையூக்கியாகப் பயன்படுத்தப்படுகிறது [9]. பீங்கான் மெருகூட்டல்கள்வெள்ளீய(IV) ஆக்சைடு நீண்ட காலமாக பீங்கான் மெருகூட்டலில் ஒரு ஒளிபுகாப் பொருளாகப் பயன்படுத்தப்படுகிறது. பீங்கான் மெருகூட்டல்களில் வெள்ளை நிறமாக நீறமூட்டவும் இது பயன்படுத்தப்படுகிறது [16]. அநேகமாக இச்சேர்மம் ஈயம்-வெள்ளீயம்-மஞ்சள் நிறமியை கண்டுபிடிக்க வழிவகுத்தது, வெள்ளீயம்(IV) ஆக்சைடை ஒரு சேர்மமாகப் பயன்படுத்தி இது தயாரிக்கப்பட்டது [17]. குறிப்பாக மட்பாண்டங்கள், சுகாதாரப் பொருட்கள் மற்றும் சுவர் ஓடுகளுக்கான மெருகூட்டல்களில் வெள்ளீயம்(IV) ஆக்சைடின் பயன்பாடு பொதுவானதாகும். எரியூட்டும் வெப்பநிலைக்கேற்ப கலைப்பு அளவு அதிகரிக்கிறது, எனவே ஒளிபுகாநிலையின் அளவு குறைகிறது [18]. மெருகூட்டல் உருகலில் வெள்ளீயம் ஆக்சைடின் கரைதிறன் பொதுவாக குறைவாகும். Na2O, K2O மற்றும் B2O3 சேர்ப்பதன் மூலம் இதை அதிகரிக்கலாம். CaO, BaO, ZnO, Al2O3 மற்றும் சிறிதளவு PbO சேர்ப்பதன் மூலம் குறைக்கலாம். SnO2 சேர்மத்தை ஒரு நிறமியாக கண்ணாடி தயாரித்தல், கண்ணாடி போன்ற மிளிரிகள், பீங்கான் மெருகூட்டல்களில் SnO2 சேர்மம் ஒரு நிறமியாகப் பயன்படுத்தப்படுகிறது. தூய SnO2 சேர்மம் பால் வெண்மை நிறத்தை தருகிறது. பிற உலோக ஆக்சைடுகளுடன் இதை கலக்கும்போது பிற வண்ணங்கள் அடையப்படுகின்றன. எடுத்துக்காட்டுகள்: V2O5 மஞ்சள்; Cr2O3 இளஞ்சிவப்பு; Sb2O5 சாம்பல் நீலம் [11]. பளபளபாக்குதல்வெள்ளீய(IV) ஆக்சைடை மெருகூட்டல் தூளாகப் பயன்படுத்தலாம்[11]. சில சமயம் கலவைகளிலும் ஈய ஆக்சைடுடன் சேர்த்தும் கண்ணாடி, அணிகலன்கள், பளிங்குகற்கள், வெள்ளி போன்றவற்றை பளபளபாக்க இது பயன்படுகிறது[1]. கண்ணாடி மேற்பூச்சுகள்வேதியியல் நீராவி படிவு முறையில் வெள்ளீயம் ஆக்சைடை மேற்பூச்சுகளை கண்ணாடியின் மேல் பூசமுடியும். இதற்கு SnCl4 சேர்மம் அல்லது கரிமவெள்ளீய டிரை ஆலைடுகள் பயன்படுகின்றன. பியூட்டைல் வெள்ளீயம் டிரைகுளோரைடு ஓர் ஆவியாகும் முகவராகும். இந்த நுட்பம் கண்ணாடி புட்டிகளின் மேலாக SnO2 இன் மெல்லிய (<0.1 μm) அடுக்குகளைப் பூசுவதற்குப் பயன்படுகிறது, பாதுகாப்பிற்காக அடுத்தடுத்து பூசப்படும் பலபடி பூச்சு போன்ற பாலியெத்திலீன்கள் கண்ணாடி மேல் பூசுவதற்கு உதவுகிறது. ஆண்டிமனி அல்லது புளோரின் அயனி கலப்பு செய்யப்பட்ட தடிமனான அடுக்குகள் மின்சாரத்தைக் கடதுகின்றன. எனவே மின்னொளிர் கர்ருவிகளில் பயன்படுத்தப்படுகின்றன. === வாயு உணரிகள் ===. கார்பன் மோனாக்சைடு உணரிகள் உள்ளிட்ட எரியக்கூடிய வாயு உணரிகளில் SnO 2 பயன்படுத்தப்படுகிறது. இவற்றில் உணரிப் பகுதி எரியக்கூடிய வாயு முன்னிலையில் ஒரு நிலையான சில நூறு ° செல்சியசு வெப்பநிலைக்கு வெப்பப்படுத்தப்படுகிறது. இதனால் மின் தடை குறைகிறது[19]). பல்வேறு சேர்மங்களுடன் கலப்பாக குறிப்பாக . CuO உடன் சேர்ப்பது தொடர்பான கருத்து ஆராயப்பட்டது. கோபால்ட்டு மற்றும் மாங்கனீசை கலப்பு செய்வதன் மூலம் உயர் மின்னழுத்த மாறுபாடுகளில் பயன்படுத்தக்கூடிய ஒரு பொருள் கிடைக்கிறது. இரும்பு அல்லது மாங்கனீஸின் ஆக்சைடுகளுடன் வெள்ளீய ஆக்சைடை கலப்பு செய்து வெள்ளீய(IV) ஆக்சைடை அளவிடலாம் [20]. மேற்கோள்கள்
மேலும் வாசிக்க
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia