Діоксид селену
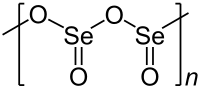
Діоксид селену — хімічна сполука з формулою SeO2. Ця безбарвна тверда речовина є однією з найбільш частих сполук селену. БудоваТвердий діоксид селену є одновимірним полімером, ланцюг якого складається з атомів селену та кисню, що чергуються. Кожен атом селену є пірамідальним і має кінцеву оксидну групу. Довжина мостового зв’язку Селен-Оксиген становить 179 пм, а кінцева відстань — 162 пм.[3] Відносна стереохімія селену чергується вздовж полімерного ланцюга (синдіотактичність). У газовому стані діоксид селену присутній у вигляді димерів та інших олігомерних форм, при більш високих температурах він є мономерним. Мономерна форма має зігнуту структуру, дуже схожу на структуру діоксиду сірки з довжиною зв’язку 161 пм.[4] Димерна форма була виділена в низькотемпературній аргоновій матриці, і вібраційні спектри вказують на те, що вона має центросиметричну форму крісла.[3] Мономерний діоксид селену є полярною молекулою з дипольним моментом 2,62 D[5], направленим від середини двох атомів кисню до атома селену. Розчинення SeO2 в оксидихлориді селену SeOCL2 дає тример [Se(O)O]3.[4] У той час як діоксид сірки (SO2) має тенденцію бути молекулярним, SeO2 є одновимірним ланцюгом, TeO2 є зшитим полімером.[3] Фізичні властивостіТверда речовина легко сублімується. При дуже низьких концентраціях пари мають огидний запах, що нагадує гнилий хрін. При більш високих концентраціях пари мають запах, що нагадує соус з хрону, і можуть обпалити ніс і горло при вдиханні. Хімічні властивостіДіоксид селену вважається кислотним оксидом: він розчиняється у воді з утворенням селенистої кислоти. Часто терміни селениста кислота та діоксид селену використовуються як синоніми. Він реагує з основами із утворенням солей селенітів, що містять аніон SeO2−
ОтриманняДіоксид селену отримують за допомогою окиснення селену шляхом спалювання на повітрі або реакції з азотною кислотою чи перекисом водню, але, мабуть, найзручнішим способом є отримання шляхом дегідратації селенистої кислоти.
ПоширеністьПриродна форма діоксиду селену, давніїт, є дуже рідкісним мінералом. Він зустрічається лише в невеликій кількості вугільних резервуарів, де він формується навколо вентиляційних отворів, утворених газами, що виходять.[6] ВикористанняОрганічний синтезSeO2 є важливим реагентом в органічному синтезі. Окиснення паральдегіду (тример ацетальдегіду) за допомогою SeO2 дає гліоксаль, а окиснення циклогексанону дає 1,2-циклогександіон. Вихідний матеріал відновлюється до селену та випадає у вигляді осаду червоної аморфної твердої речовини, яку можна легко відфільтрувати.[7] Цей тип реакції називається окисненням Райлі. Він також відомий як реагент для «алілового» окиснення, реакції, яка виглядає наступним чином: Інакше можна описати більш звично як:
Діоксид селену також можна використовувати для синтезу 1,2,3-селендіазолів з ацильованих похідних гідразону.[8] Як барвникДіоксид селену надає склу червоний колір. Він використовується в невеликих кількостях для протидії кольору через домішки заліза і таким чином для створення (очевидно) безбарвного скла. У великих кількостях він дає насичений рубіново-червоний колір. Діоксид селену є активним інгредієнтом деяких розчинів холодного воронування. Він також використовувався як тонер у фотопроявці. БезпекаСелен є незамінним елементом, але при прийомі всередину більше 5 мг/день призводить до неспецифічних симптомів.[9] Примітки
ПосиланняВікісховище має мультимедійні дані за темою: Діоксид селену |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia