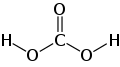
–ö–∞—Ä–±–æ–Ω–∞—Ç–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞
–ö–∞—Ä–±–æ–Ω–∞ÃÅ—Ç–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞ÃÅ, —Ç–∞–∫–æ–∂ –≤—ÉÃÅ–≥—ñ–ª—å–Ω–∞, –≤—É–≥–ª–µ—Ü–µ–≤–∞ –∫–∏—Å–ª–æ—Ç–∞ÃÅ (–≤—É–≥–ª–µ–∫–∏—Å–ª–æ—Ç–∞) ‚Äî —Å–ª–∞–±–∫–∞ –¥–≤–æ–æ—Å–Ω–æ–≤–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞ –∑ —Ö—ñ–º—ñ—á–Ω–æ—é —Ñ–æ—Ä–º—É–ª–æ—é H2CO3. –£ —á–∏—Å—Ç–æ–º—É –≤–∏–≥–ª—è–¥—ñ –Ω–µ—Å—Ç—ñ–π–∫–∞[1]. –£—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –≤ –º–∞–ª–∏—Ö –∫—ñ–ª—å–∫–æ—Å—Ç—è—Ö –ø—Ä–∏ —Ä–æ–∑—á–∏–Ω–µ–Ω–Ω—ñ –≤—É–≥–ª–µ–∫–∏—Å–ª–æ–≥–æ –≥–∞–∑—É —É –≤–æ–¥—ñ, –≤ —Ç–æ–º—É —á–∏—Å–ª—ñ —ñ –≤—É–≥–ª–µ–∫–∏—Å–ª–æ–≥–æ –≥–∞–∑—É –∑ –ø–æ–≤—ñ—Ç—Ä—è. –£—Ç–≤–æ—Ä—é—î —Ä—è–¥ —Å—Ç—ñ–π–∫–∏—Ö –Ω–µ–æ—Ä–≥–∞–Ω—ñ—á–Ω–∏—Ö —Ç–∞ –æ—Ä–≥–∞–Ω—ñ—á–Ω–∏—Ö –ø–æ—Ö—ñ–¥–Ω–∏—Ö: —Å–æ–ª—ñ (–∫–∞—Ä–±–æ–Ω–∞—Ç–∏ —Ç–∞ –≥—ñ–¥—Ä–æ–∫–∞—Ä–±–æ–Ω–∞—Ç–∏), –µ—Å—Ç–µ—Ä–∏, –∞–º—ñ–¥–∏ —Ç–∞ —ñ–Ω –§—ñ–∑–∏—á–Ω—ñ –≤–ª–∞—Å—Ç–∏–≤–æ—Å—Ç—ñ–ú–æ–ª–µ–∫—É–ª–∞ –≤—É–≥—ñ–ª—å–Ω–æ—ó –∫–∏—Å–ª–æ—Ç–∏ –º–∞—î –ø–ª–æ—Å–∫—É –±—É–¥–æ–≤—É. –¶–µ–Ω—Ç—Ä–∞–ª—å–Ω–∏–π –≤—É–≥–ª–µ—Ü–µ–≤–∏–π –∞—Ç–æ–º –º–∞—î sp¬≤-–≥—ñ–±—Ä–∏–¥–∏–∑–∞—Ü—ñ—é. –£ –≥—ñ–¥—Ä–æ–∫–∞—Ä–±–æ–Ω–∞—Ç- –∫–∞—Ä–±–æ–Ω–∞—Ç-–∞–Ω—ñ–æ–Ω—ñ–≤ –≤—ñ–¥–±—É–≤–∞—î—Ç—å—Å—è –¥–µ–ª–æ–∫–∞–ª—ñ–∑–∞—Ü—ñ—è œÄ-–∑–≤'—è–∑–∫—É. –î–æ–≤–∂–∏–Ω–∞ –∑–≤'—è–∑–∫—É C‚ÄîO –≤ –∫–∞—Ä–±–æ–Ω–∞—Ç-—ñ–æ–Ω—ñ —Å—Ç–∞–Ω–æ–≤–∏—Ç—å 129 –ø–º. –•—ñ–º—ñ—á–Ω—ñ –≤–ª–∞—Å—Ç–∏–≤–æ—Å—Ç—ñ–Ý—ñ–≤–Ω–æ–≤–∞–≥–∞ —É –≤–æ–¥–Ω–∏—Ö —Ä–æ–∑—á–∏–Ω–∞—Ö —Ç–∞ –∫–∏—Å–ª–æ—Ç–Ω—ñ—Å—Ç—å–í—É–≥—ñ–ª—å–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞ —ñ—Å–Ω—É—î —É –≤–æ–¥–Ω–∏—Ö —Ä–æ–∑—á–∏–Ω–∞—Ö –≤ —Å—Ç–∞–Ω—ñ —Ä—ñ–≤–Ω–æ–≤–∞–≥–∏ –∑ –≥—ñ–¥—Ä–∞—Ç–æ–º –¥—ñ–æ–∫—Å–∏–¥—É –≤—É–≥–ª–µ—Ü—é:
Швидкість прямої реакції 0,039 с−1, зворотної — 23 с−1. У свою чергу розчинений гідрат діоксиду вуглецю знаходиться в рівновазі з газоподібним діоксидом вуглецю:
Дана рівновагу при підвищенні температури зсувається вправо, а при підвищенні тиску — вліво (докладніше див. Абсорбція газів). Вугільна кислота піддається оборотньому гідролізу, створюючи при цьому кисле середовище:
–û–¥–Ω–∞–∫, –¥–ª—è –ø—Ä–∞–∫—Ç–∏—á–Ω–∏—Ö —Ä–æ–∑—Ä–∞—Ö—É–Ω–∫—ñ–≤ —á–∞—Å—Ç—ñ—à–µ –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—é—Ç—å —É—è–≤–Ω—É –∫–æ–Ω—Å—Ç–∞–Ω—Ç—É –∫–∏—Å–ª–æ—Ç–Ω–æ—Å—Ç—ñ, —â–æ –≤—Ä–∞—Ö–æ–≤—É—î —Ä—ñ–≤–Ω–æ–≤–∞–≥—É –≤—É–≥—ñ–ª—å–Ω–æ—ó –∫–∏—Å–ª–æ—Ç–∏ –∑ –≥—ñ–¥—Ä–∞—Ç–æ–º –¥—ñ–æ–∫—Å–∏–¥—É –≤—É–≥–ª–µ—Ü—é: –≥—ñ–¥—Ä–æ–∫–∞—Ä–±–æ–Ω–∞—Ç-—ñ–æ–Ω –ø—ñ–¥–¥–∞—î—Ç—å—Å—è –ø–æ–¥–∞–ª—å—à–æ–º—É –≥—ñ–¥—Ä–æ–ª—ñ–∑—É –ø–æ —Ä–µ–∞–∫—Ü—ñ—ó
Таким чином, в розчинах, що містять вугільну кислоту, створюється складна рівноважна система, яку можна зобразити у загальному вигляді таким чином: Значення pH в такій системі, яке відповідає насиченому розчину діоксиду вуглецю в воді при 25 °C і тиску 760 мм рт. ст., можна розрахувати по формулі:
–Ý–æ–∑–∫–ª–∞–¥–∞–Ω–Ω—è–ü—Ä–∏ –∑–±–æ–≤—Ç—É–≤–∞–Ω–Ω—ñ, –ø—ñ–¥–≤–∏—â–µ–Ω–Ω—ñ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ —Ä–æ–∑—á–∏–Ω—É —ñ/–∞–±–æ –ø–æ–Ω–∏–∂–µ–Ω–Ω—ñ –ø–∞—Ä—Ü—ñ–∞–ª—å–Ω–æ–≥–æ —Ç–∏—Å–∫—É –¥—ñ–æ–∫—Å–∏–¥—É –≤—É–≥–ª–µ—Ü—é —Ä—ñ–≤–Ω–æ–≤–∞–≥—É –≤ —Å–∏—Å—Ç–µ–º—ñ –∑–º—ñ—â—É—î—Ç—å—Å—è –≤–ª—ñ–≤–æ, —â–æ –ø—Ä–∏–∑–≤–æ–¥–∏—Ç—å –¥–æ —Ä–æ–∑–∫–ª–∞–¥–∞–Ω–Ω—è —á–∞—Å—Ç–∏–Ω–∏ –≤—É–≥—ñ–ª—å–Ω–æ—ó –∫–∏—Å–ª–æ—Ç–∏ –Ω–∞ –≤–æ–¥—É —ñ –¥—ñ–æ–∫—Å–∏–¥ –≤—É–≥–ª–µ—Ü—é. –ü—Ä–∏ –∫–∏–ø—ñ–Ω–Ω—ñ —Ä–æ–∑—á–∏–Ω—É –≤—É–≥—ñ–ª—å–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞ —Ä–æ–∑–∫–ª–∞–¥–∞—î—Ç—å—Å—è –ø–æ–≤–Ω—ñ—Å—Ç—é: –í–∑–∞—î–º–æ–¥—ñ—è –∑ –æ—Å–Ω–æ–≤–∞–º–∏ —Ç–∞ —Å–æ–ª—è–º–∏–í—É–≥—ñ–ª—å–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞ –≤—Å—Ç—É–ø–∞—î –≤ —Ä–µ–∞–∫—Ü—ñ—ó –Ω–µ–π—Ç—Ä–∞–ª—ñ–∑–∞—Ü—ñ—ó –∑ —Ä–æ–∑—á–∏–Ω–∞–º–∏ –æ—Å–Ω–æ–≤, —É—Ç–≤–æ—Ä—é—é—á–∏ —Å–µ—Ä–µ–¥–Ω—ñ —Ç–∞ –∫–∏—Å–ª—ñ —Å–æ–ª—ñ (—Ö—ñ–º—ñ—è) ‚Äî –∫–∞—Ä–±–æ–Ω–∞—Ç–∏ —Ç–∞ –≥—ñ–¥—Ä–æ–∫–∞—Ä–±–æ–Ω–∞—Ç–∏ –≤—ñ–¥–ø–æ–≤—ñ–¥–Ω–æ:
–ü—Ä–∏ –≤–∑–∞—î–º–æ–¥—ñ—ó –≤—É–≥—ñ–ª—å–Ω–æ—ó –∫–∏—Å–ª–æ—Ç–∏ –∑ –∫–∞—Ä–±–æ–Ω–∞—Ç–∞–º–∏ —É—Ç–≤–æ—Ä—é—é—Ç—å—Å—è –≥—ñ–¥—Ä–æ–∫–∞—Ä–±–æ–Ω–∞—Ç–∏: –û—Ç—Ä–∏–º–∞–Ω–Ω—è–í—É–≥—ñ–ª—å–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞ —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –ø—Ä–∏ —Ä–æ–∑—á–∏–Ω–µ–Ω–Ω—ñ —É –≤–æ–¥—ñ –¥—ñ–æ–∫—Å–∏–¥—É –≤—É–≥–ª–µ—Ü—é: –í–º—ñ—Å—Ç –≤—É–≥—ñ–ª—å–Ω–æ—ó –∫–∏—Å–ª–æ—Ç–∏ –≤ —Ä–æ–∑—á–∏–Ω—ñ –∑–±—ñ–ª—å—à—É—î—Ç—å—Å—è –ø—Ä–∏ –∑–Ω–∏–∂–µ–Ω–Ω—ñ —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∏ —Ä–æ–∑—á–∏–Ω—É —Ç–∞ –∑–±—ñ–ª—å—à–µ–Ω–Ω—ñ —Ç–∏—Å–∫—É –≤—É–≥–ª–µ–∫–∏—Å–ª–æ–≥–æ –≥–∞–∑—É. –¢–∞–∫–æ–∂ –≤—É–≥—ñ–ª—å–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞ —É—Ç–≤–æ—Ä—é—î—Ç—å—Å—è –ø—Ä–∏ –≤–∑–∞—î–º–æ–¥—ñ—ó —ó—ó —Å–æ–ª–µ–π (–∫–∞—Ä–±–æ–Ω–∞—Ç—ñ–≤ —Ç–∞ –≥—ñ–¥—Ä–æ–∫–∞—Ä–±–æ–Ω–∞—Ç—ñ–≤) –∑ –±—ñ–ª—å—à —Å–∏–ª—å–Ω–æ—é –∫–∏—Å–ª–æ—Ç–æ—é. –ü—Ä–∏ —Ü—å–æ–º—É –≤–µ–ª–∏–∫–∞ —á–∞—Å—Ç–∏–Ω–∞ —É—Ç–≤–æ—Ä–∏–ª–∞—Å—è –≤—É–≥—ñ–ª—å–Ω–æ—ó –∫–∏—Å–ª–æ—Ç–∏, —è–∫ –ø—Ä–∞–≤–∏–ª–æ, —Ä–æ–∑–∫–ª–∞–¥–∞—î—Ç—å—Å—è –Ω–∞ –≤–æ–¥—É —ñ –¥—ñ–æ–∫—Å–∏–¥ –≤—É–≥–ª–µ—Ü—é: –ó–∞—Å—Ç–æ—Å—É–≤–∞–Ω–Ω—è–í—É–≥—ñ–ª—å–Ω–∞ –∫–∏—Å–ª–æ—Ç–∞ –∑–∞–≤–∂–¥–∏ –ø—Ä–∏—Å—É—Ç–Ω—è —É –≤–æ–¥–Ω–∏—Ö —Ä–æ–∑—á–∏–Ω–∞—Ö –≤—É–≥–ª–µ–∫–∏—Å–ª–æ–≥–æ –≥–∞–∑—É (–¥–∏–≤. –ì–∞–∑–æ–≤–∞–Ω–∞ –≤–æ–¥–∞). –í –±—ñ–æ—Ö—ñ–º—ñ—ó –≤–∏–∫–æ—Ä–∏—Å—Ç–æ–≤—É—î—Ç—å—Å—è –≤–ª–∞—Å—Ç–∏–≤—ñ—Å—Ç—å —Ä—ñ–≤–Ω–æ–≤–∞–∂–Ω–æ—ó —Å–∏—Å—Ç–µ–º–∏ –∑–º—ñ–Ω—é–≤–∞—Ç–∏ —Ç–∏—Å–∫ –≥–∞–∑—É –ø—Ä–æ–ø–æ—Ä—Ü—ñ–π–Ω–æ –∑–º—ñ–Ω—ñ –∑–º—ñ—Å—Ç—É —ñ–æ–Ω—ñ–≤ –æ–∫—Å–æ–Ω—ñ—é (–∫–∏—Å–ª–æ—Ç–Ω–æ—Å—Ç—ñ) –ø—Ä–∏ –ø–æ—Å—Ç—ñ–π–Ω—ñ–π —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä—ñ. –¶–µ –¥–æ–∑–≤–æ–ª—è—î —Ä–µ—î—Å—Ç—Ä—É–≤–∞—Ç–∏ –≤ —Ä–µ–∞–ª—å–Ω–æ–º—É —á–∞—Å—ñ —Ö—ñ–¥ —Ñ–µ—Ä–º–µ–Ω—Ç–∞—Ç–∏–≤–Ω–∏—Ö —Ä–µ–∞–∫—Ü—ñ–π, —â–æ –ø—Ä–æ—Ç—ñ–∫–∞—é—Ç—å —ñ–∑ –∑–º—ñ–Ω–æ—é pH —Ä–æ–∑—á–∏–Ω—É. –û—Ä–≥–∞–Ω—ñ—á–Ω—ñ –ø–æ—Ö—ñ–¥–Ω—ñ–í—É–≥—ñ–ª—å–Ω—É –∫–∏—Å–ª–æ—Ç—É —Ñ–æ—Ä–º–∞–ª—å–Ω–æ –º–æ–∂–Ω–∞ —Ä–æ–∑–≥–ª—è–¥–∞—Ç–∏ —è–∫ –∫–∞—Ä–±–æ–Ω–æ–≤—É –∫–∏—Å–ª–æ—Ç—É –∑ –≥—ñ–¥—Ä–æ–∫—Å–∏–ª—å–Ω–æ—é –≥—Ä—É–ø–æ—é –∑–∞–º—ñ—Å—Ç—å –≤—É–≥–ª–µ–≤–æ–¥–Ω–µ–≤–æ—ó –∑–∞–ª–∏—à–∫—É. –£ —Ü—ñ–π —è–∫–æ—Å—Ç—ñ –≤–æ–Ω–∞ –º–æ–∂–µ —É—Ç–≤–æ—Ä—é–≤–∞—Ç–∏ –≤—Å—ñ –ø–æ—Ö—ñ–¥–Ω—ñ, —Ö–∞—Ä–∞–∫—Ç–µ—Ä–Ω—ñ –¥–ª—è –∫–∞—Ä–±–æ–Ω–æ–≤–∏—Ö –∫–∏—Å–ª–æ—Ç[2]. –î–µ—è–∫—ñ –ø—Ä–µ–¥—Å—Ç–∞–≤–Ω–∏–∫–∏ –ø–æ–¥—ñ–±–Ω–∏—Ö —Å–ø–æ–ª—É–∫ –ø–µ—Ä–µ—Ä–∞—Ö–æ–≤–∞–Ω—ñ –≤ —Ç–∞–±–ª–∏—Ü—ñ.
–î–∏–≤. —Ç–∞–∫–æ–∂
–ü—Ä–∏–º—ñ—Ç–∫–∏
–õ—ñ—Ç–µ—Ä–∞—Ç—É—Ä–∞
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia


![{\displaystyle K_{p}=\ {\frac {\ \mathrm {[H_{2}CO_{3}]} }{\ \mathrm {[CO_{2}\ \cdot H_{2}O]} }}=1,70\ \cdot 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ef6f8727b849294458faf393c418c372521c01f)


![{\displaystyle K_{a1}=\ {\frac {\ \mathrm {[HCO_{3}^{-}]\ \cdot [H_{3}O^{+}]} }{\ \mathrm {[H_{2}CO_{3}]} }}=2,5\ \cdot 10^{-4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6950909768e276a9790eade365511107494b0390)
![{\displaystyle K_{a}'=\ {\frac {\ \mathrm {[HCO_{3}^{-}]\ \cdot [H_{3}O^{+}]} }{\ \mathrm {[CO_{2}\ \cdot H_{2}O]} }}=4,27\ \cdot 10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b537959bb11038695c186d772b65ff7029b8922e)

![{\displaystyle K_{a2}=\ {\frac {\ \mathrm {[CO_{3}^{2-}]\ \cdot [H_{3}O^{+}]} }{\ \mathrm {[HCO_{3}^{-}]} }}=4,68\ \cdot 10^{-11}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9f9bb2249f016de9f77dcf87227f72e9ac4eb424)



























