Нирково-клітинна карцинома
Нирково-клітинна карцинома (НКК), англ. Renal Cell Carcinoma (RCC) — це злоякісна пухлина нирки, яка виникає в слизовій оболонці проксимального звивистого канальця, частини дуже маленьких трубок у нирці, які транспортують первинну сечу. НКК є найпоширенішим типом раку нирки у дорослих, відповідальним за приблизно 90–95% випадків.[7] Частіше зустрічається у чоловіків (співвідношення чоловіків і жінок становить до 2:1).[8] Найчастіше діагностується у людей похилого віку (особливо у людей старше 75 років).[9] Початкове лікування найчастіше полягає в частковому або повному видаленні ураженої нирки.[10] Якщо пухлина не має метастазів (не поширилася на інші органи) або не проникла глибше в тканини нирки, п’ятирічна виживаність становить 65–90%,[11] але вона значно знижується при поширенні пухлини. Симптоми з'являються пізно і люди з НКК часто мають пізні стадії захворювання на момент встановлення діагнозу.[12] Початкові симптоми НКК часто включають кров у сечі (у 40% пацієнтів під час першого звернення до лікаря), біль у боці (40%), новоутворення в животі чи у боці (25%), втрату ваги (33%), гарячку (20%), високий кров’яний тиск (20%), нічну пітливість і погане загальне самопочуття.[7] При метастазуванні НКК найчастіше поширюється на лімфатичні вузли, легені, печінку, надниркові залози, мозок або кістки.[13] Імунотерапія та таргетна терапія покращили перспективи пацієнтів з метастатичною НКК.[14][15] НКК також асоціюється з низкою паранеопластичних синдромів (ПНС), які є станами, спричиненими або гормонами, що виробляються пухлиною, або атакою імунної системи на пухлину, і присутні приблизно у 20% пацієнтів з НКК.[7] Найпоширенішими ПНС, які спостерігаються у людей з НКК, є: високий рівень кальцію в крові, високий рівень еритроцитів, високий рівень тромбоцитів і вторинний амілоїдоз.[13] Ознаки та симптомиІсторично вважалося, що пацієнт матиме класичну тріаду: 1 - гематурію, коли в сечі є кров, 2 - біль у боці, між стегном і ребрами, і 3 - новоутворення в животі, схоже на здуття, але більше. Зараз відомо, що ця класична тріада симптомів виникає лише в 10–15% випадків і зазвичай свідчить про те, що нирково-клітинна карцинома (НКК) знаходиться на пізній стадії. Сьогодні НКК часто протікає безсимптомно і зазвичай виявляється випадково під час обстеження з приводу інших патологій. Відсоток безсимптомних і випадково діагностованих випадків НКК, в останні роки продовжує зростати.[16] Інші ознаки та симптоми можуть включати відчуття нездужання, втрату ваги та/або апетиту, анемію внаслідок пригнічення еритропоетину; еритроцитоз (підвищене утворення еритроцитів) внаслідок підвищеної секреції еритропоетину; варикоцеле, яке спостерігається у чоловіків як розширення сплетення вен, що дренують яєчко (частіше ліве); гіпертензію (високий кров'яний тиск), що виникає внаслідок секреції реніну пухлиною; гіперкальціємію; порушення сну або нічна пітливість; рецидивні підвищення температури тіла і хронічну втому. Фактори ризикуСпосіб життяНайбільші фактори ризику НКК пов’язані зі способом життя: куріння, ожиріння та гіпертензія, які за оцінками, присутні у до 50% випадків.[17] Професійний вплив деяких хімічних речовин, таких як асбест, кадмій, свинець, хлоровані розчинники, нафтохімічні речовини та поліциклічні ароматичні вуглеводні, розглядалися в багатьох дослідженнях з непереконливими результатами.[18][19][20] Іншим підозрюваним фактором ризику є тривале застосування нестероїдних протизапальних препаратів.[21] Також дослідження показали, що перенесена гістеректомія пов'язана із більш ніж удвічі збільшенням ризику НКК.[22] Помірне споживання алкоголю, з іншого боку, має захисний ефект.[23] Генетичні чинникиСпадкові фактори мають незначний вплив на індивідуальну уразливість, причому у найближчих родичів людей з НКК ризик розвитку цього захворювання підвищується в 2-4 рази. Інші генетично пов’язані захворювання також підвищують ризик НКК, включаючи спадкову папілярну карциному нирки, спадковий лейоміоматоз, синдром Бірта–Хогга–Дюбе, синдром гіперпаратиреоїдної пухлини щелепи, сімейну папілярну карциному щитовидної залози, хворобу фон Гіппеля–Ліндау і серпоподібноклітинну анемію. Проте найбільш значний ризик захворювання не пов’язаний з генетикою – пацієнти з набутою кістозною хворобою нирок, які потребують діалізу, мають у 30 разів більше шансів на розвиток НКК, ніж у загальній популяції. ПатофізіологіяЦя пухлина виникає з клітин епітелію проксимальних ниркових канальців.[7] Вважається аденокарциномою.[13] Розрізняють два підтипи: спорадичний (тобто неспадковий) і спадковий.[7] Обидва такі підтипи пов’язані з мутаціями в короткому плечі хромосоми 3, причому залученими генами є або гени-супресори пухлин (VHL і TSC), або онкогени (наприклад , c-Met).[7] ДіагностикаПершими кроками для діагностики цього захворювання є розгляд ознак і симптомів, а також анамнез (детальний медичний огляд минулого стану здоров’я) для оцінки будь-яких факторів ризику. На підставі представлених симптомів низка біохімічних тестів (з використанням зразків крові та/або сечі) також можна розглядати як частину процесу скринінгу, щоб забезпечити достатній кількісний аналіз будь-яких відмінностей в електролітах, функції нирок і печінки, а також показників згортання крові. Під час фізичного огляду пальпація живота може виявити наявність пухлини або збільшення органу.[24] Хоча цьому захворюванню не вистачає характеристик на ранніх стадіях, важливі міркування, засновані на різноманітних клінічних проявах, а також резистентності до опромінення та хіміотерапії. Основними діагностичними засобами для виявлення нирково-клітинної карциноми є УЗД, комп’ютерна томографія (КТ) та магнітно-резонансна томографія (МРТ) нирок.[25] КласифікаціяНирково-клітинна карцинома (НКК) — це не єдине ціле, а скоріше сукупність різних типів пухлин, кожна з яких походить з різних частин нефрону (епітелію або ниркових канальців) і має певні генетичні характеристики, гістологічні особливості та, певною мірою, клінічні фенотипи.
Для виявлення характерних хромосомних аберацій у пухлинах нирок зі складною морфологією можна використовувати матричне каріотипування.[31][32] Воно добре працює на залитих парафіном пухлинах [33] і можливе у звичайному клінічному використанні. Класифікація пухлин сечостатевої системи Всесвітньої організації охорони здоров’я (ВООЗ) 2004 року визнає понад 40 підтипів новоутворень нирок. З моменту публікації останньої версії класифікації було описано декілька нових підтипів:[34]
Лабораторні дослідженняЛабораторні дослідження зазвичай проводяться, коли у пацієнта є ознаки та симптоми, які можуть бути характерними для порушення функції нирок. Вони в основному не використовуються для діагностики раку нирки через його безсимптомний характер і зазвичай виявляються випадково під час аналізів на інші захворювання, такі як захворювання жовчного міхура.[36] Іншими словами, ці види раку зазвичай не виявляються, тому що вони не викликають болю чи дискомфорту. Лабораторний аналіз може дати оцінку загального стану здоров’я пацієнта та надати інформацію для визначення стадії та ступеня метастазування в інші частини тіла (якщо виявлено ураження нирок) до призначення лікування. Аналіз сечіНаявність крові в сечі є типовою ознакою нирково-клітинного раку. Через гемоглобін крові сеча стає іржавою, коричневою або червоною. Крім того, аналіз сечі може виявити цукор, білок і бактерії, які також можуть служити індикаторами раку. Повний аналіз крові також може надати додаткову інформацію щодо тяжкості та поширення раку.[37] Загальний аналіз кровіЗагальною ознакою НКК є дефіцит еритроцитів (анемія).[38] Загальний аналіз крові життєво важливий як скринінговий інструмент для обстеження здоров’я пацієнта перед операцією. Невідповідності кількості тромбоцитів також є поширеними серед таких хворих, тому слід розглянути можливість проведення додаткових тестів коагуляції, включаючи швидкість осідання еритроцитів (ШОЕ), протромбіновий час (ПЧ), активований частковий тромбопластиновий час (АЧТЧ). Біохімічний аналіз кровіБіохімічний аналіз крові проводяться, якщо є підозра на НКК, оскільки може підвищуватись рівень певних хімічних речовин у крові. Наприклад, печінкові ферменти, такі як аспартатамінотрансфераза (АсТ) і аланінамінотрансфераза (АлТ), виявляються на аномально високому рівні.[39] Стадію НКК також можна визначити за аномально підвищеним рівнем кальцію, що свідчить про можливі метастази в кістки.[40] У цьому випадку необхідно звернутися до лікаря для проведення КТ. Хімічні аналізи крові також оцінюють загальну функцію нирок і можуть дозволити лікареві прийняти рішення щодо подальших рентгенологічних досліджень. РадіологіяХарактерний вигляд НКК — це солідне (тверде) утворення нирки, яке порушує нирковий контур. Воно часто має нерівний або часточковий край і може розглядатися як шишка в нижній частині тазу або в ділянці живота. Від 85 до 90% солідних ниркових утворень є НКК, але також вони можуть бути кістозними нирковими утвореннями.[41] Прогрес у діагностичних методах дозволяє випадково діагностувати велику кількість пацієнтів із нирковими ураженнями, які можуть бути невеликими за розміром і доброякісними. У 10% НКК міститиме кальцинати, а деякі містять велику кількість жиру (ймовірно, через інвазію та капсуляцію навколониркового жиру).[42] Вирішення питання про доброякісну чи злоякісну природу ниркової пухлини на основі її розміру є проблемою, оскільки нирковоклітинна карцинома також може бути кістозною. Оскільки існує декілька доброякісних кістозних утворень нирок (проста кіста нирки, геморагічна кіста нирки, мультилокулярна кістозна нефрома, полікістоз нирок), інколи радіологу може бути важко диференціювати доброякісну кістозну пухлину від злоякісної.[43] Боснійська система класифікації кістозних уражень нирок ділить їх на групи доброякісних і тих, що потребують хірургічної резекції, на основі специфічних особливостей зображення.[44] Основними візуалізаційними дослідженнями, які проводяться для виявлення НКК, є КТ таза та черевної порожнини, УЗД нирок, МРТ, внутрішньовенна пієлограма або ниркова ангіографія.[45] Серед цих основних діагностичних тестів інші радіологічні дослідження, такі як екскреторна урографія, позитронно-емісійна томографія (ПЕТ), артеріографія, венографія та сканування кісток, також можуть бути використані для допомоги в оцінці стадії ниркових новоутворень і для диференціації доброякісних пухлин від злоякісних пухлин. Комп'ютерна томографіяКомп’ютерна томографія (КТ) з контрастуванням зазвичай використовується для визначення стадії НКК в черевній порожнині та тазових ділянках. КТ дозволяє відрізнити солідні утворення від кістозних і надати інформацію про локалізацію, стадію або поширення раку на інші органи пацієнта. Ключові частини людського тіла, які обстежуються на наявність метастатичного ураження нирково-клітинної карциноми, можуть включати ниркову вену, лімфатичний вузол і ураження нижньої порожнистої вени.[46] УЗДУльтразвукове дослідження може бути корисним для оцінки сумнівних безсимптомних пухлин нирок і кістозних уражень нирок, якщо комп’ютерна томографія не дає остаточних результатів. Зображення, створене за допомогою ультразвуку, може допомогти діагностувати НКК на основі відмінностей звукових відбитків на поверхні органів і аномальних утворень тканини. По суті, ультразвукове дослідження може визначити, чи ниркова маса є переважно твердою або наповненою рідиною.[45] Рентгенолог може провести черезшкірну біопсію за допомогою ультразвуку або комп’ютерної томографії для отримання зразка пухлини. Однак ця процедура не є звичайною, оскільки за наявності типових ознак візуалізації НКК вона не має переваг з точки зору співвідношення ризик-зиск.[47] Молекулярний аналіз біоптату має дослідницький інтерес, щоб відрізнити доброякісні пухлини нирок від злоякісних.[47] Магнітно-резонансна томографіяМагнітно-резонансна томографія (МРТ) забезпечує зображення м’яких тканин тіла за допомогою радіохвиль і сильних магнітів. МРТ можна використовувати замість КТ, якщо у пацієнта є алергія на контрастну речовину, яку вводять для дослідження.[48][49] Іноді, щоб отримати більш детальне зображення, перед МРТ внутрішньовенно вводять контрастний матеріал під назвою гадоліній. У пацієнтів, які перебувають на діалізі, або мають ниркову недостатність слід уникати його використання, оскільки він може викликати рідкісний, але серйозний побічний ефект, відомий як нефрогенний системний фіброз.[50] Сканування кісток або візуалізація головного мозку зазвичай не виконується, якщо ознаки або симптоми не вказують на можливе метастатичне ураження цих ділянок. Слід також розглянути можливість проведення МРТ, щоб оцінити поширення пухлини в основні оточуючі кровоносні судини, включаючи порожнисту вену. За наявності відповідних симптомів МРТ можна використовувати для спостереження за можливим поширенням раку в головний або спинний мозок. Внутрішньовенна пієлографіяВнутрішньовенна пієлографія дозволяє виявити аномальну ниркову масу в сечовивідних шляхах. Ця процедура передбачає введення контрастного барвника в вену руки пацієнта звідки він потрапляє в нирки, і, з часом, у сечовий міхур. Цей тест не є необхідним, якщо було проведено КТ або МРТ.[51] Ниркова ангіографіяНиркова ангіографія використовує той самий принцип, що й внутрішньовенна пієлографія, оскільки також використовується контрастний барвник. Це дослідження важливе для діагностики НКК як допоміжний засіб для дослідження кровоносних судин у нирках. Контрастна речовина вводиться в ниркову артерію.[52] Метод забезпечує чіткішу візуалізацію контуру аномально орієнтованих кровоносних судин, які, як вважають, пов’язані з пухлиною. Це вкрай необхідно для хірургів, оскільки дає змогу відобразити кровоносні судини пацієнта перед операцією.[46] СтадіюванняСтадіювання НКК є найважливішим фактором у його прогнозі.[53] Визначення стадії може відповідати системі TNM, де розмір і ступінь пухлини (T), ураження лімфатичних вузлів (N) і метастази (M) класифікуються окремо. Крім того, може використовуватися загальна класифікація стадій I–IV, з переглядом AJCC 1997 року, описаним нижче:[53]
На момент встановлення діагнозу 30% НКК поширювалися на іпсилатеральну (тобто з тієї ж сторони) ниркову вену, а 5–10% - у нижню порожнисту вену.[54] Гістопатологія 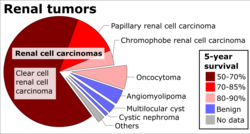  Макро- і мікроскопічний вигляд НКК дуже різноманітний. Вона може представляти собою почервонілі ділянки, де кровоточать кровоносні судини, і кісти, що містять рідину.[55] На тілі пухлини видно великі кровоносні судини, стінки яких складаються з ракових клітин. Загальний огляд часто виявляє жовтувату багаточасткову пухлину в корковій речовині нирки, яка часто містить зони некрозу, крововиливів і рубців. При мікроскопії виділяють чотири основні гістологічні підтипи НКК: світлоклітинна (звичайна НКК, 75%), папілярна (15%), хромофобна (5%) і пухлина збірної протоки (2%). Саркоматоїдні зміни (морфологія, що імітує саркому, веретеноподібні клітини) можуть спостерігатися в будь-якому підтипі НКК і пов’язані з більш агресивним клінічним перебігом і гіршим прогнозом. При світловій мікроскопії ці пухлинні клітини можуть мати сосочки, канальці або гнізда, вони досить великі, нетипові та багатокутні. Останні дослідження привернули увагу до тісного зв’язку між типом ракових клітин і їх агресивністю. Ракові клітини накопичують глікоген і ліпіди, їхня цитоплазма виглядає «прозорою» або "світлою", ядра залишаються в середині клітин, а клітинна мембрана добре помітна.[56] Деякі клітини можуть бути меншими, з еозинофільною цитоплазмою, схожою на нормальні трубчасті клітини. Строма зменшена, але добре васкуляризована. Пухлина стискає навколишню паренхіму, утворюючи псевдокапсулу.[57] Найбільш поширеним типом клітин нирково-клітинної карциноми є світлі клітини, які отримали назву через розчинення високого вмісту ліпідів клітин у цитоплазмі. Вважається, що світлі клітини мають найменшу ймовірність поширення та зазвичай сприятливіше реагують на лікування. Однак більшість пухлин містять суміш клітин. Вважається, що найбільш агресивною формою раку нирки є змішана пухлина, яка містить як світлі, так і зернисті клітини.[58] Рекомендованою схемою гістологічної класифікації НКК є система Фурмана (1982), яка є оцінкою на основі мікроскопічної морфології новоутворення з гематоксиліном і еозином (фарбування H&E). Ця система класифікує нирково-клітинну карциному за ступенями 1, 2, 3, 4 на основі ядерних характеристик. Деталі системи оцінювання Фурмана для НКК наведені нижче:[59]
Ядерний клас вважається одним з найважливіших прогностичних факторів у пацієнтів з НКК. Однак дослідження Delahunt та ін. (2007) показали, що класифікація за Фурманом є ідеальною для світлоклітинної НКК, але може бути непридатною для хромофобних НКК, і що визначення стадії раку (за допомогою КТ) є більш сприятливим предиктором прогнозу цього захворювання.[60] Гейдельберзька система класифікації пухлин нирок була введена в 1976 році як засіб більш повного співвіднесення гістопатологічних особливостей з виявленими генетичними дефектами.[61] ПрофілактикаРизик нирково-клітинної карциноми можна знизити, підтримуючи нормальну масу тіла.[62] Ведення пацієнтів Вибір лікування залежить від багатьох факторів та індивідуальних особливостей, деякі з яких включають стадію НКК (уражені / неуражені органи), тип НКК, наявні супутні захворювання, загальний стан здоров’я та вік людини.[63] Кожна форма лікування має як ризики, так і переваги. Якщо пухлина поширилася за межі нирок, в лімфатичні вузли, легені або основну вену нирки, тоді використовуються декілька методів лікування, включаючи хірургічне втручання та фармакотерапія. НКК у більшості випадків є стійкою до хіміотерапії та променевої терапії, але добре реагує на імунотерапію інтерлейкіном-2 або інтерфероном-альфа, біологічну або таргетну терапію. На ранніх стадіях кращими варіантами є кріотерапія та хірургічне втручання. Активне спостереженняАктивне спостереження або «пильне очікування» стає все більш поширеним у міру виявлення невеликих ниркових новоутворень, а також серед старшого покоління, коли операція не завжди показана.[64] Активне спостереження передбачає виконання різноманітних діагностичних процедур, аналізів і візуалізації для моніторингу прогресування НКК перед тим, як приступати до більш ризикованого варіанту лікування, наприклад хірургічного втручання.[64] Це особливо корисно для літніх людей, пацієнтів із супутніми захворюваннями та поганих кандидатів на хірургічне втручання. ХірургіяЗалежно від обставин найбільш підходящими можуть бути різні процедури. Рекомендованим лікуванням НКК може бути нефректомія, хірургічне видалення всієї нирки або її частини.[10] Воно може включати деякі навколишні органи або тканини, такі як лімфатичні вузли. Якщо пухлина присутня лише в нирках, а це приблизно 60% пацієнтів, приблизно в 90% випадків його можна вилікувати хірургічним шляхом. Коли це можливо, малі пухлини нирок (<4 см) все частіше лікують шляхом часткової нефректомії.[65][66][67] Більшість цих невеликих ниркових утворень ростуть повільно і мають відмінний прогноз.[68] Органозберігаючу часткову нефректомію застосовують, коли пухлина невелика (менше 4 см в діаметрі) або коли у пацієнта є інші медичні проблеми, такі як діабет або гіпертензія. Часткова нефректомія передбачає видалення лише ураженої тканини, зберігаючи решту нирки, фасцію Герота та регіонарні лімфатичні вузли. Це дає змогу зберегти нирку порівняно з радикальною нефректомією, і може мати позитивні довгострокові переваги для здоров’я.[69] Спеціалісти з великим досвідом у хірургії нирок також можуть лікувати більші та складніші пухлини за допомогою часткової нефректомії.[70] Нефректомія може бути «радикальною», якщо під час операції одночасно видаляється вся уражена нирка, включаючи фасцію Герота, надниркову залозу з того самого боку, що й уражена нирка, і регіонарні заочеревинні лімфатичні вузли. Цей спосіб хоч і травмуючий, але ефективний. Але він не завжди доцільний, оскільки це велика операція, яка містить ризик ускладнень як під час, так і після операції та може потребувати довшого часу відновлення.[71] Важливо відзначити, що друга нирка має бути повністю функціональною, і цей метод найчастіше використовується, коли велика пухлина присутня лише в одній нирці.  У випадках, коли пухлина поширилася на ниркову вену, нижню порожнисту вену і, можливо, праве передсердя, її також можна видалити хірургічним шляхом. Коли пухлина уражає нижню порожнисту вену, важливо класифікувати, які частини порожнистої вени залучено, і відповідним чином спланувати операцію, оскільки іноді повна резекція передбачає розріз і грудної клітки що може ускладнити операцію. З цієї причини д-р Гаетано Чіанчіо адаптував методи мобілізації печінки після її трансплантації для лікування ретрогепатичних або навіть надпечінкових тромбів нижньої порожнистої вени, пов’язаних із пухлинами нирок.[72] За допомогою цієї методики можна мобілізувати всю нижню порожнисту вену. Це полегшує пальцьове видалення пухлини нижче великих печінкових вен, обходячи потребу в торакоабдомінальному розрізі або у серцево-легеневому шунтуванні.[73] У випадках наявності метастазів хірургічна резекція нирки («циторедуктивна нефректомія») і видалення одиничного метастазу може покращити виживаність [74]. Іноді перед операцією нирки емболізують, щоб мінімізувати крововтрату.[75] Хірургічне втручання все частіше виконується за допомогою лапароскопічних методів. Ця операція, яку зазвичай називають операцією "крізь замкову скважину", не потребує великих розрізів, як під час класичної нефректомії, але дозволяє успішно видалити всю нирку або потрібну частину. Лапароскопічна хірургія пов’язана з коротшим перебуванням у лікарні та швидшим часом відновлення. Вона має перевагу в тому, що несе менше наслідків для пацієнта, а виживаність без захворювання порівнянна з такою при відкритому способі.[10] Для невеликих екзофітних уражень, які не зачіпають великі судини або сечовидільну систему, можна виконати часткову нефректомію (також відому як «нефронозберігаюча операція»). На час видалення пухлини може застосовуватися зупинка кровотоку в нирці, а також її охолодження крижаною кашею. Також для обмеження пошкодження нирок можуть вводити манітол. При невеликих пухлинах також можна застосовувати лапароскопічну кріотерапію. Як правило, під час операції проводять біопсію нирки. Для правильного розташування зондів для заморожування може бути використане інтраопераційне ультразвукове дослідження. Для знищення пухлинних клітин проводяться два цикли заморожування / розморожування. Оскільки пухлина фізично не видаляється з тіла, подальше спостереження за пацієнтом є більш складним, і загальні показники відсутності захворювання не такі високі, як після хірургічного видалення. Хірургія метастазів: якщо присутні метастази, хірургічне лікування все ще може бути варіантом лікування. Радикальна та часткова нефректомія все ще може бути виконана, а в деяких випадках, якщо метастази невеликі, їх також можна видалити хірургічним шляхом. Все залежить від того, на якій стадії росту і наскільки далеко поширилася хвороба. Черезшкірна абляційна терапіяЯкщо хірургічне втручання вважається недоцільним може бути проведена черезшкірна абляційна терапія, при якій використовуються рентгенологічні методи візуалізації пухлини. Незважаючи на те, що використання лапароскопії для повної нефректомії зменшило деякі ризики, пов’язані із операцією, будь-яке хірургічне втручання в деяких випадках все одно буде неможливим. Наприклад, у пацієнтів похилого віку, із серйозною нирковою дисфункцією або із кількома супутніми захворюваннями операція будь-якого типу не є виправданою. В режимі реального часу, орієнтуючись на візуалізацію поля втручання (за допомогою комп’ютерної томографії, ультразвуку або навіть магнітно-резонансної томографії) через шкіру в пухлину вводять зонд. Пухлину руйнують теплом (радіочастотна абляція) або холодом (кріотерапія). Ефективність цих методів нижче, порівняно з традиційною хірургією, оскільки патогістологічне підтвердження повного руйнування пухлини неможливо. Тому вирішальне значення для оцінки повноти видалення пухлини має тривале спостереження за пацієнтом.[76][77] В ідеалі використання черезшкірної абляції обмежується пухлинами розміром менше 3,5 см. Однак в деяких випадках абляція може бути використана для більших пухлин. При радіочастотній абляції використовується електродний зонд, який вставляється в уражену тканину. Зонд надсилає радіохвилі, які нагрівають пухлину через тертя молекул води, що призводить до її загибелі зазвичай протягом декількох хвилин після впливу температури вище 50 °C. Кріоабляція також передбачає введення зонда в уражену ділянку, однак для знищення пухлини замість тепла використовується холод. Зонд охолоджується спеціальними рідинами. Низькі температури спричиняють загибель пухлинних клітин, викликаючи їх осмотичну дегідратацію, руйнуючи ферменти, органели, клітинну мембрану та заморожуючи цитоплазму. Таргетні лікіПухлина здатна активно рости пригнічуючи імунну систему.[15] Імунотерапія – це метод, який активує імунну систему людини та використовує її для ураження пухлин.[15] Цей метод було розроблено після спостереження, що в деяких випадках спостерігалася спонтанна регресія пухлин.[78] Імунотерапія використовує це явище та спрямована на формування імунної відповіді людини на ракові клітини.[78] Інші засоби таргетної терапії пригнічують фактори росту, які, як було показано, сприяють росту та поширенню пухлин.[79][80] Більшість із цих ліків було схвалено протягом останніх десяти років.[81] Ці методи лікування включають:[82]
У пацієнтів із метастатичним раком сунітініб, ймовірно, призводить до більшого прогресування раку, ніж пембролізумаб, акситиніб і авелумаб.[83] Порівняно з пембролізумабом і акситинібом, він, ймовірно, призводить до більшої смертності, але може трохи зменшити серйозні небажані ефекти.[83] У порівнянні з комбінаціями імунотерапії (ніволумаб та іпілімумаб) сунітініб може призвести до більшого прогресування та серйозних наслідків.[83] Між пазопанібом і сунітібом різниця в прогресуванні, виживаності та серйозних наслідках може бути незначною або взагалі відсутній.[83] Також повідомлялося про активність іпілімумабу [84] але він не є схваленим засобом для лікування раку нирок.[85] Очікується, що найближчим часом стануть доступними більше ліків, оскільки наразі проводяться клінічні випробування нових цільових методів лікування [86], зокрема: атезолізумаб, варлілумаб, дурвалумаб, авелумаб, LAG525, MBG453, TRC105 і саволітиніб. ХіміотерапіяХіміотерапія та променева терапія не такі ефективні у випадку НКК. У більшості випадків НКК є резистентною, показник успіху лікування становить приблизно 4–5%, відповідь на лікування є короткочасною, згодом з’являється більше новоутворень. Ад'ювантна та неоад'ювантна терапіяАд'ювантна терапія - терапія після первинної операції, протягом тривалого часу не була визнана корисною для НКК. Однак у 2021 році пембролізумаб був схвалений для ад’ювантного лікування після того, як він продемонстрував багатообіцяюче покращення виживаності без рецидиву.[87] Навпаки, неоад'ювантна терапія проводиться перед основним лікуванням. У деяких випадках було показано, що неоад’ювантна терапія зменшує розмір і стадію НКК, що потім дозволяє її хірургічне видалення.[80] Це нова форма лікування, і ефективність цього підходу все ще оцінюється під час клінічних випробувань. МетастазиМетастатична нирково-клітинна карцинома (мНКК) — це поширення первинної пухлини з нирки в інші органи. Приблизно 25–30% пацієнтів мають метастази на момент встановлення діагнозу.[88] Така висока частота пояснюється тим фактом, що клінічні ознаки, як правило, слабкі, доки хвороба не прогресує до більш важкого стану.[89] Найбільш поширеними місцями метастазування є лімфатичні вузли, легені, кістки, печінка та мозок. Метастатична форма має поганий прогноз порівняно з іншими видами раку, хоча середній час виживання збільшився за останні кілька років завдяки прогресу в лікуванні. Середній час виживання в 2008 році для метастатичної форми становив менше року,[90], до 2013 року цей показник покращився в середньому до 22 місяців.[91] Незважаючи на це, п’ятирічна виживаність при мНКК залишається нижче 10% [92], а 20–25% пацієнтів не реагують на жодне лікування, і в цих випадках хвороба швидко прогресує.[91] Раніше згадані методи лікування НКК актуальні і для метастатичної форми захворювання. Варіанти включають використання інтерлейкіну-2, який є стандартною терапією для прогресуючої нирково-клітинної карциноми. З 2007 по 2013 рік було схвалено сім нових препаратів для лікування мНКК (сунітініб, темсіролімус, бевацизумаб, сорафеніб, еверолімус, пазопаніб і акситиніб).[14] Ці нові методи лікування базуються на тому, що НКК є "дуже судинною" пухлиною – вона містить велику кількість кровоносних судин. Ці ліки спрямовані на пригнічення росту нових кровоносних судин у пухлинах, уповільнюючи ріст і в деяких випадках зменшуючи розміри пухлин.[93] При цьму, на жаль, поширені несприятливі ефекти, які включають:[94]
При метастатичній формі НКК для лікування вторинних пухлин в кістках, печінці, мозку та інших органах частіше використовуються радіотерапія та хіміотерапія. Хоча ці методи лікування не є радикальними, вони полегшують симптоми, пов’язані з поширенням пухлин (паліативне лікування).[91] ПрогнозНа прогноз впливає декілька факторів, у тому числі розмір пухлини, ступінь інвазії та метастазування, гістологічний тип і ядерний клас. Стадіювання є найважливішим фактором прогнозу результату НКК. Наступні цифри базуються на даних пацієнтів, у яких НКК вперше було діагностовано в 2001 і 2002 роках:[95]
Корейське дослідження показало, що п’ятирічна виживаність становить 85%.[96] У цілому, якщо хвороба обмежена ниркою, лише у 20–30% після нефректомії розвиваються метастази.[97] Більш конкретні підгрупи пацієнтів показують п’ятирічну виживаність приблизно 90–95% для пухлин менше 4 см. Для більших пухлин, обмежених ниркою без венозної інвазії, виживання все ще є відносно хорошим і становить 80–85%. Для пухлин, які виходять за межу ниркової капсули та за межі локальних фасціальних утворень, виживаність знижується майже до 60%. Такі фактори, як загальний стан здоров’я та фізична форма або тяжкість симптомів, впливають на рівень виживання. Наприклад, молоді люди (віком 20–40 років) мають кращий результат, незважаючи на наявність більшої кількості симптомів на момент звернення, можливо, через нижчу швидкість поширення раку на лімфатичні вузли (стадія III). Гістологічний ступінь пов’язаний з агресивністю раку, і його класифікують на 4 ступені, причому 1 має найкращий прогноз (п’ятирічна виживаність понад 89%), а 4 – найгірший прогноз (46% п’ятирічної виживаності). У деяких людей НКК виявляють ще до появи симптомів (випадково) завдяки КТ або УЗД. Випадково діагностований НКК (без симптомів) відрізняється за прогнозами від раку, діагностованого після появи симптомів або метастазів. Рівень п’ятирічної виживаності був вищим для випадково знайдених пухлин, ніж для симптоматичних: 85,3% проти 62,5%. Випадково знайдені ураження мали значно нижчу стадію, ніж ті, що викликали симптоми: 62% пацієнтів з випадково знайденою НКК мали стадію I, проти 23% пацієнтів з симптоматичною НКК.[98] Якщо НКК метастазував у лімфатичні вузли, п’ятирічна виживаність становить від 5% до 15%. Для мНКК несприятливі для прогнозу фактори включають низьку оцінку стану за Карнофським (стандартний спосіб вимірювання функціональних порушень у пацієнтів з раком), низький рівень гемоглобіну, високий рівень лактатдегідрогенази в сироватці крові та високий скоригований рівень кальцію в сироватці крові.[99][100] Для неметастатичних випадків для прогнозування прогресування захворювання після операції можна використовувати алгоритм Лейбовича.[101] НКК є одним із видів раку, який найбільше пов’язаний з паранеопластичними синдромами, найчастіше через ектопічну продукцію пухлиною гормонів. Лікування цих ускладнень НКК зазвичай обмежується лікуванням основної пухлини. ЕпідеміологіяЧастота захворювання залежить від географічних, демографічних і, меншою мірою, спадкових факторів. Існують деякі відомі фактори ризику, однак значення інших потенційних факторів залишається більш суперечливим. Захворюваність на НКК зростала в усьому світі зі швидкістю приблизно 2–3% на десятиліття [90] до останніх кількох років, коли кількість нових випадків стабілізувалася.[18] Захворюваність на НКК різниться залежно від статі, віку, раси та географічного розташування в усьому світі. У чоловіків захворюваність вища, ніж у жінок (приблизно 1,6:1) [102], і в переважній більшості діагностується після 65 років.[102] Повідомляється, що азіати мають значно нижчу захворюваність на НКК, ніж європеоїди. В той час як африканські країни мають найнижчий зареєстрований рівень захворюваності, афроамериканці мають найвищий рівень захворюваності серед населення Сполучених Штатів.[18] У розвинених країнах захворюваність вища, ніж у країнах, що розвиваються, при цьому найвищі показники спостерігаються в Північній Америці, Європі та Австралії/Новій Зеландії.[103] ІсторіяДаніель Зеннерт зробив перше повідомлення про те, що схоже на пухлину нирки у своїй праці Practicae Medicinae, вперше опублікованому в 1613 році.[104] Міріл (Miril) опублікував повідомлення про перший однозначний випадок ниркової карциноми в 1810 році.[105] Він описав випадок Франсуази Левелі, 35-річної жінки, яка звернулася до Брестської міської лікарні 6 квітня 1809 року, нібито на пізніх термінах вагітності.[104] У 1826 році Кеніг (Koenig) опублікував першу класифікацію пухлин нирок, засновану на макроскопічній морфології. Кеніг розділив пухлини на скиррозні, стеатоматозні, грибоподібні та медулярні.[106] Суперечка про гіпернефромуПісля появи класифікації пухлини дослідники спробували визначити тканину походження раку нирки. Патогенез епітеліальних пухлин нирок обговорювався протягом десятиліть. Дебати були ініційовані Полом Ґравіцем (Paul Grawitz[en]), коли в 1883 році він опублікував свої спостереження щодо морфології маленьких жовтих пухлин нирок. Ґравіц прийшов до висновку, що тільки альвеолярні пухлини мають надниркове походження, тоді як папілярні пухлини походять з ниркової тканини.[104] У 1893 році Пол Судек (Paul Sudeck) поставив під сумнів теорію, висунуту Ґравіцем, опублікувавши описи пухлин нирок, у яких він визначив атипові особливості всередині ниркових канальців і зазначив градацію цих атипових особливостей між канальцями та сусідньою злоякісною пухлиною. У 1894 році Отто Любарш (Otto Lubarsch[en]), який підтримував теорію Ґравіца, ввів термін гіпернефроїдна пухлина, який був змінений Феліксом Віктором Берч-Гіршфельдом (Felix Victor Birch-Hirschfeld[en]) на термін гіпернефрома для опису цих пухлин.[107] Яскраву критику Ґравіца надав Оскар Стерк (Oskar Stoerk) у 1908 році, який вважав надниркове походження пухлини нирок недоведеним. Незважаючи на переконливі аргументи проти теорії, висунутої Ґравіцем, термін гіпернефрома із відсилкою до надниркових залоз зберігся в літературі.[104] Фут і Хамфріс, а також Фут та ін. вели термін «карцинома ниркових клітин» (Renal Celled Carcinoma), щоб підкреслити канальцеве походження цих пухлин. Їхнє позначення було дещо змінено Феттером на тепер уже широко прийнятий термін нирково-клітинна карцинома (Renal Cell Carcinoma).[108] Переконливі докази для вирішення дискусії надали Оберлінг та ін. в 1959 році, які вивчали ультраструктуру світлих клітин восьми ниркових карцином. Вони виявили, що цитоплазма пухлинних клітин містить численні мітохондрії та відкладення глікогену та жиру. Вони ідентифікували цитоплазматичні мембрани, перпендикулярні до базальної мембрани з окремими клітинами, що містять мікроворсинки вздовж країв, що не пов'язані з іншими клітинами. Вони прийшли до висновку, що ці особливості вказують на те, що ці пухлини виникли з епітеліальних клітин звивистих канальців нирок, і, таким чином, остаточно вирішили одну з найбільш обговорюваних проблем онкології.[104][109] Примітки
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia

















