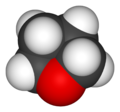
| テトラヒドロフラン
|

|
|
|

|
|
|
別称 THF, 1,4-epoxybutane, butylene oxide, cyclotetramethylene oxide, oxacyclopentane, diethylene oxide, furanidine, hydrofuran, tetra-methylene oxide |
| 識別情報
|
|
|
|
|
|
|
| ChEMBL
|
|
| ChemSpider
|
|
| ECHA InfoCard
|
100.003.389 
|
|
|
|
| RTECS number
|
|
|
|
|
InChI=1S/C4H8O/c1-2-4-5-3-1/h1-4H2  Key: WYURNTSHIVDZCO-UHFFFAOYSA-N  InChI=1/C4H8O/c1-2-4-5-3-1/h1-4H2 Key: WYURNTSHIVDZCO-UHFFFAOYAI
|
|
|
| 特性
|
| 化学式
|
C4H8O
|
| モル質量
|
72.11 g/mol
|
| 外観
|
無色の液体
|
| 密度
|
0.8892 g/cm3 (g/mL) @ 20 °C, 液体
|
| 融点
|
−108.4 °C (164.75 K)
|
| 沸点
|
66 °C (339.15 K)
|
| 水への溶解度
|
混和性
|
| 粘度
|
0.48 cP at 25 °C
|
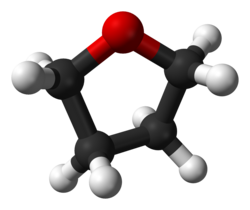
| 構造
|
|
|
envelope
|
|
|
1.63 D (気体)
|
| 危険性
|
| NFPA 704(ファイア・ダイアモンド)
|
|
| 引火点
|
−14 °C
|
| 関連する物質
|
| 関連する複素環式化合物
|
フラン
ピロリジン
ジオキサン
|
| 関連物質
|
ジエチルエーテル
|
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。
|
テトラヒドロフラン(英: tetrahydrofuran、THF)は、飽和の5員環に酸素を1つ含んだ環状エーテル化合物である。常温・常圧では芳香を持つ無色の液体である[1]。別名テトラメチレンオキシド、オキソラン、オキサシクロペンタン。
特徴
自由に水と混和し、多くの有機化合物・高分子を溶解するので溶媒としてよく使用される。引火点が −14.5 °Cと低く、日本では消防法により危険物第四類(第一石油類 危険等級2 水溶性)に指定されている。
空気中の酸素と反応して徐々に過酸化物を生成するので、長期保存したものを蒸発乾固させることは危険である。市販品には酸化を防ぐため安定化剤を含むものがあるが、安定化剤除去・水分除去などの目的で蒸留精製する際にも蒸発乾固させてはいけない。
酸素の配位性を利用して、ルイス酸や金属イオンの配位子とされる。ボランとの錯体(英語版) (BH3•THF) は安定で、溶液が市販されている[2]。
製造
THFは年間およそ20万トンが生産されている[3]。最も広く用いられている工業的な生産方法には1,4-ブタンジオールの酸触媒脱水が含まれ、それはエタノールからのジエチルエーテルの製造と同種の方法である[4]。原料の1,4-ブタンジオールは、アセチレンとホルムアルデヒドとの縮合によって合成される1,4-ブチンジオールを水素化することで生成される[4][5]。また、アリルアルコールのヒドロホルミル化反応によって生成した4-ヒドロキシブチルアルデヒドを水素化させることでも1,4-ブタンジオールが得られる[6]。他に、デュポンが開発した製造法として、n-ブタンを酸化させることで粗無水マレイン酸を生成させ、次いでそれを水素化させることでTHFを得る方法も用いられる[4][7]。
THFはフランの水素化によっても合成される[8][9]。フランはペントースから合成されるためこの製造方法は再生可能資源を利用することができるが、この方法は広く用いられていない。
用途
溶媒のほか、開環重合によりポリテトラメチレンエーテルグリコール(ポリエーテル)製造の原料となる[1]。また、酸化により、γ-ブチロラクトンに変えられる。
添加剤
2005年、水にテトラヒドロフランを0.1%ほど混ぜると、50気圧、7℃という穏やかな条件で安定な水素ハイドレートが生成することが報告された(通常では -24℃・2000気圧が必要)[10][11]。しかしながら本結果は追試により確かめられていない[12]。約4%(重量%)まで貯蔵可能とされる。
脚注
- ^ a b 井上克巳「テトラヒドロフラン」『有機合成化学協会誌』第40巻第8号、有機合成化学協会、1982年、763-764頁、doi:10.5059/yukigoseikyokaishi.40.763。
- ^ “Borane - Tetrahydrofuran Complex 14044-65-6”. 東京化成工業株式会社. 2017年4月24日閲覧。
- ^ “Ethers, by Lawrence Karas and W. J. Piel”. Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. 2004.
- ^ a b c 浅野泰資「THF, γ-ブチロラクトンの製造技術の発達について」『有機合成化学協会誌』第36巻第2号、有機合成化学協会、1978年、146-155頁、doi:10.5059/yukigoseikyokaishi.36.146。
- ^ Herbert Müller, "Tetrahydrofuran" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a26_221
- ^ ホワイト・ダニエル・F., Japan Patent Kokai 2010-523558 (2010.7.15) (ekouhou.net)
- ^ Merck Index of Chemicals and Drugs, 9th ed.
- ^ Morrison, Robert Thornton; Boyd, Robert Neilson: Organic Chemistry, 2nd ed., Allyn and Bacon 1972, p. 569
- ^ Donald Starr and R. M. Hixon (1943). “Tetrahydrofuran”. Organic Syntheses (英語).; Collective Volume, vol. 2, p. 566
- ^ Lee, H.; Lee, J.-W.; Kim, D. Y.; Park, J.; Seo, Y.-T.; Zeng, H.; Moudrakovski, I. L.; Ratcliffe, C. I.; Ripmeester, J. A. Nature 2005, 434, 743-746. DOI: Tuning clathrate hydrates for hydrogen storage ,doi:10.1038/nature03457
- ^ http://www.org-chem.org/yuuki/mow/2006/hydrogen.html
- ^ Strobel, T. A.; Hester, K. C.; Koh, C. A.; Sum, A. K.; Sloan, D. Jr. Chemical Physics Letters 2009, 478, 97-109.Properties of the clathrates of hydrogen and developments in their applicability for hydrogen storage, doi:10.1016/j.cplett.2009.07.030
関連項目
外部リンク


















