Азотоводородна киселина
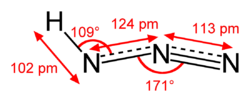
Азотоводородна киселина, исто така позната како водород азид, азинска киселина или азоимид[2] — соединение со хемиска формула HN Азотоводородната киселина, како и други минерални киселини, е растворлива во вода. Неразредената азотоводородна киселина е опасно експлозивна[5] со стандардна енталпија на образување Δ f H o (l, 298K) = +264 kJ/mol.[6] Разредени, гасот и водените раствори (<10%) можат безбедно да се подготват, но треба веднаш да се употребат. Поради нејзината ниска точка на вриење, азотоводородната киселина се збогатува при испарување и кондензација, така што разредените раствори што не се способни за експлозија може да образуваат капки во главниот простор на контејнерот или реакторот што можат да експлодираат. ПроизводствоКиселината обично се образува со закиселување на азидна сол како што е натриум азидот. Нормално, растворите на натриум азид во вода содржат траги на азотоводородна киселина во рамнотежа со азидната сол, но воведувањето на посилна киселина може да ги претвори примарните видови во растворот во азотоводородна киселина. Чистата киселина може последователно да се добие со фракциона дестилација како крајно експлозивна безбојна течност со непријатен мирис.[2]
Нејзиниот воден раствор може да се подготви и со обработка на раствор на бариум азид со разредена сулфурна киселина, со филтрирање на нерастворливиот бариум сулфат. Првично била подготвена со реакција на воден хидразин со азотеста киселина:
Со хидразиниумов катјон [N
За производство на азотоводородна киселина од хидразин, исто така може да се користат други оксидирачки агенси како што се водородот пероксид, нитросилот хлорид, трихлораминот или азотната киселина. Уништување пред отстранувањеАзотоводородната киселина реагира со азотестата киселина:
Оваа реакција вклучува соединенија со азот во четири различни состојби на оксидација, што ја прави невообичаена. РеакцииВо своите својства азотоводородната киселина покажува одредена аналогија со халогените киселини, бидејќи образува слабо растворливи (во вода) соли на олово, сребро и жива(I). Сите метални соли кристализираат во безводен облик и се распаѓаат при загревање, оставајќи остаток од чист метал. Таа е слаба киселина (p K a = 4,75[6]). Нејзините соли на тешки метали се експлозивни и лесно комуницираат со алкил јодидите. Азидите на потешките алкални метали (со исклучок на литиумот) или земноалкалните метали не се експлозивни, туку се разградуваат на поконтролиран начин при загревањето, ослободувајќи спектроскопски чист гас N Азотоводородната киселина може да реагира со карбонилни деривати, вклучувајќи алдехиди, кетони и карбоксилни киселини, при што се добива амин или амид, со исфрлање на азот. Ова се нарекува Шмитова реакција или Шмитово преуредување.   Со растворање во најсилните киселини се добиваат експлозивни соли кои го содржат јонот на аминодиазониум [H
Јонот [H Разградувањето на азотоводородната киселина, предизвикано од удар, триење, искра итн. произведува азот и водород:
Азотоводородната киселина се подложува на едномолекуларно разградување со доволно енергија:
Најниската енергетска патека произведува NH во тројна (триплет) состојба, што ја прави спин-забранета реакција. Ова е една од ретките реакции чија брзина е одредена за посебни количини на вибрациона енергија во основната електронска состојба, со ласерски фотодисоцијациски проучувања.[8] Дополнително, овие едномолекуларни вредности биле теоретски анализирани, а експерименталните и пресметаните вредности се во разумна согласност.[9] ОтровностАзотоводородната киселина е испарлива и многу отровна. Има лут мирис и нејзината пареа може да предизвика силни главоболки. Соединението делува како некумулативен отров. Примени2-Фуронитрил, фармацевтски меѓупроизвод и потенцијално вештачко засладувачко средство се подготвува со добар принос со третирање на фурфурал со мешавина од азотоводородна киселина (HN Целосно гасофазен јоден ласер (AGIL) меша гасовита азотоводородна киселина со хлор за да произведе побуден азот хлорид, кој потоа се користи за да предизвика јодот да премине во ласерска состојба. На овој начин се избегнуваат барањата на течната хемија за КОИЛ ласерите. Наводи
Надворешни врски
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia