Карбоксилна киселина 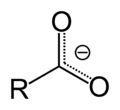  Карбоксилна киселина је органско једињење које у себи садржи функционалну карбоксилну групу (-COOH).[1] То је велика и разнолика група хемијских једињења, а други назив за њих су и органске киселине. Општа формула свих карбоксилних киселина је R-COOH, где R представља алкил групу, CnH2n. Најпростије карбоксилне киселине су тзв. алканске киселине код којих је радикал алкил група. Соли органских киселина се називају карбоксилати.[2][3] Карбоксилна група је приближно тригонално-планарна. Изузетак су врло разблажени раствори када услед водоничног везивања, настају димери карбоксилних киселина. Карбоксилне киселине реагују у многим процесима живих бића, међу којима је значајна и естерификација. У том процесу карбоксилне киселине реагују са органским једињењима које садрже хидроксилну групу (-ОН), односно алкохолима. Свакако најпознатији естри карбоксилних (масних) киселина су липиди. НоменклатураКарбоксилне киселине се именују као алканске киселине, додатком наставка -ска киселина на назив алкана. Тако на пример од метана настаје метанска киселина.[4] Бројем 1 се обележава карбонилни угљеник најдужег низа у коме се налази карбоксилна група. Дикарбоксилне киселине се именују као алкан-дикиселине. Циклични и ароматични системи називају се циклоалканкарбоксилне и бензоеве киселине. Код ових система угљениковом атому за који је везана карбоксилна група приписује се број 1. Иако постоји IUPAC-ова номенклатура, чешће се користе тривијални називи. На пример, бутаноична киселина се углавном назива бутерна киселина (C3H7CO2H). Карбоксилни јон R-COO− се именује додавањем суфикса -ате, па од сирћетне киселине настаје ацетатни јон.
Физичка својстваРастворљивостКарбоксилне киселине су поларне. Будући да су оне акцептори водоничне везе (карбонил –C=O) и донори водоничне везе (хидроксил –OH), оне такође учествују у водоничном везивању. Заједно, хидроксилна и карбонилна група творе функционалну карбоксилну групу. Карбоксилне киселине обично постоје као димери у неполарним медијима због њихове склоности да се „самоасоцирају”. Лакше карбоксилне киселине (1 до 5 угљеника) су растворљиве у води, док теже карбоксилне киселине имају ограничену растворљивост због повећане хидрофобне природе алкилног ланца. Ове киселине дужег ланца имају тенденцију да буду растворљиве у мање поларним растварачима као што су етри и алкохоли.[5] Водени натријум хидроксид и карбоксилне киселине, чак и хидрофобне, реагују дајући натријумове соли растворљиве у води. На пример, хептанска киселина има ниску растворљивост у води (0,2 g/L), али је њена натријумова со веома растворљива у води.  Тачке кључањаКарбоксилне киселине имају тенденцију да имају веће тачке кључања од воде, због веће површине и склоности стварања стабилизованих димера путем водоничних веза. Да би дошло до кључања, било се везе димера морају прекинути или цео димеризовани аранжман мора испарити, чиме се значајно повећава неопхона енталпија испаравања.  КиселостКарбоксилне киселине су Бренстед-Лауријеве киселине, јер су донатори протона (H+). Оне су најчешћи тип органске киселине. Карбоксилне киселине су типично слабе киселине, што значи да се само делимично дисоцирају на H3O+ катјоне и RCOO− анјоне у неутралном воденом раствору. На пример, на собној температури, у 1-моларном раствору сирћетне киселине, дисоцира се само 0,4% киселине. Супституенти који повлаче електроне, попут -CF3 групе, дају јаче киселине (pKa мравље киселине је 3,75, док трифлуоросирћетна киселина, са трифлуорометил супституентом, има pKa 0,23). Супституенти који донирају електроне дају слабије киселине (pKa мравље киселине је 3,75, док сирћетна киселина, са метил супституентом, има pKa 4,76)
Депротонизација карбоксилних киселина даје карбоксилатне анионе; они су резонантно стабилизовани, јер се негативни набој делокализује преко два атома кисеоника, повећавајући стабилност аниона. Свака од веза угљеник-кисеоник у карбоксилатном анјону има парцијални карактер двоструке везе. Парцијални позитивни набој карбонилног угљеника такође је ослабљен -1/2 негативним наелектрисањем на 2 атома кисеоника. МирисКарбоксилне киселине често имају јаке киселе мирисе. Естри карбоксилних киселина имају угодан мирис, а многи се користе у парфемима. КарактеризацијаКарбоксилне киселине се лако идентификују као такве инфрацрвеном спектроскопијом. Оне показују оштар појас повезан са вибрацијом C–O вибрационе везе (νC=O) између 1680 и 1725 cm−1. Карактеристична νO–H трака појављује се као широки врх у региону од 2500 до 3000 cm−1.[5] Помоћу 1H NMR спектрометрије, хидроксилни водоник се појављује у региону 10–13 ppm, иако је често проширен или се не примећује због размене са траговима воде. Појава и применеМноге карбоксилне киселине се индустријски производе у великим количинама. Такође се често налазе у природи. Естри масних киселина су главне компоненте липида, а полиамиди аминокарбоксилних киселина су главне компоненте протеина. Карбоксилне киселине се користе у производњи полимера, фармацеутских производа, растварача и адитива за храну. Индустријски важне карбоксилне киселине укључују сирћетну киселину (компонента сирћета, прекурзор растварача и премаза), акрилну и метакрилну киселину (прекурзори полимера, лепкова), адипинску киселину (полимери), лимунску киселину (арома и конзерванс у храни и пићима), етилендиаминтетрасирћетна киселина (хелирајући агенс), масне киселине (превлаке), малеинска киселина (полимери), пропионска киселина (конзерванс за храну), терефтална киселина (полимери). Важне соли карбоксилата су сапуни. СинтезаИндустријске рутеГенерално, индустријски путеви до карбоксилних киселина разликују се од оних који се користе у мањем обиму, јер захтевају специјализовану опрему.
Лабораторијске методеПрипремне методе за реакције малих размера за истраживање или производњу финих хемикалија често користе скупе потрошне реагенсе.
Референце
Спољашње везе
|
Portal di Ensiklopedia Dunia













