கரிமகந்தக சேர்மங்கள்கரிமகந்தகச் சேர்மங்கள் என்பது கந்தகத்தைக்[1] கொண்ட கரிம சேர்மங்கள் ஆகும். இச்சேர்மங்கள் பெரும்பாலும் விரும்பத்தகாத மணத்தைப் பெற்றுள்ளன. எனினும், பல இனிமையான சேர்மங்கள் கரிமகந்தக வழிப்பொருட்களில் உள்ளன. எ. கா., சாக்கரின். இயற்கையிலேயே கந்தகம் ஏராளமாக உள்ளது. வாழ்க்கைக்கு கந்தகம் அவசியமானதாக உள்ளது. 20 பொதுவான அமினோ அமிலங்களில் இரண்டு (சிஸ்டீன் மற்றும் மெத்தியோனைன்) கரிமகந்தக சேர்மங்கள் ஆகும். நுண்ணுயிர் எதிர்பொருள் பென்சிலின் (படம் கீழே), சல்ஃபா மருந்துகள் இரண்டும் கந்தகத்தைக் கொண்டுள்ளன. கந்தகம்-கொண்ட பல நுண்ணுயிர் எதிர்பொருள் மருந்துகள் பல உயிர்களைக் காக்க உதவுகிறது. சல்பர்கடுகு ஒரு கொடிய காரணியாக வேதியியல் ஆயுதமாக போர்முறைகளில் உள்ளது. படிம எரிபொருள், நிலக்கரி, பெட்ரோலியம், இயற்கை எரிவாயு முதலியவை பழைமயான படிமங்களில் இருந்து பெறப்படுகின்றன. இதில் முக்கியமானதாக கரிமகந்தகச் சேர்மங்கள் உள்ளன. எண்ணெய் சுத்திகரிப்பு நிலையங்களில் இவை நீக்கப்படுகின்றன. கந்தகம், சால்கோசன் தொகுதிகளுடன் ஆக்சிஜன், செலீனியம் மற்றும் டொலுரியம் இவற்றை பங்கீட்டுக் கொள்கிறது. கரிமகந்தகச் சேர்மங்கள், கார்பன்–ஆக்சிஜன், கார்பன்–செலினியம், மற்றும் கார்பன்–டொலூரியம் சேர்மங்களுடன் ஒத்து காணப்படுகின்றன. கந்தகச் சேர்மங்களைக் கண்டறிய்கூடிய ஒரு பாரம்பரிய இரசாயன சோதனை காரியசு ஆலசன் முறை. வகுப்புகள்கந்தகத்தில் உள்ள வினைபடு தொகுதியை அடிப்படையாகக் கொண்டு கரிமகந்தகச் சேர்மங்கள் வகைப்படுத்தப்படுகின்றன. கரிம கந்தகச் சேர்மங்களுக்கு எடுத்துக்காட்டுகள்
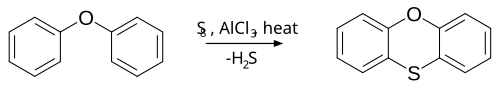
சல்பைடுகள் (Sulfides)சல்பைடுகள், தயேர்ஈத்தர் என்று முன்னர் அழைக்கப்பட்டுள்ளன. இவை C−S−C பிணைப்பின்[2][3] பண்புகளைக் கொண்டுள்ளன. C−C பிணைப்புடன் ஒப்பிடுகையில் C−S இன் பிணைப்பு நீளமானது. ஏனெனில், கார்பனை விட கந்தகம் பெரியது மற்றும் சுமார் 10% வலுகுறைந்தது. மீத்தேன்தயோலின் S−C ஒற்றை பிணைப்பின் பிணைப்பு நீளம் 183 பிக்கோமீட்டர் மற்றும் தயோபீனின் பிணைப்பு நீளம் 173 பிக்கோமீட்டர். தயோமீத்தேனில் உள்ள C−S பிணைப்பின் பிரிகை ஆற்றல் 89 கிலோ கலோரி/மோல் (370 kJ/mol) மீத்தேனுடன் ஒப்பிடும் போது மீத்தேனின் பிரிகை ஆற்றல் 100 கிலோ கலோரி/மோல் (420 kJ/mol). மெத்தில் தொகுதியால் ஐதரசன் நீக்கப்படும் போது ஆற்றல்73 கிலோ கலோரி/மோல் (305 kJ/mol)[4] வரை குறைகிறது. C−C பிணைப்பை விட கார்பன் - ஆக்சிசன் பிணைப்பு நீளம் குறைவானது. இருமெத்தில் சல்பைடு மற்றும் இருமெத்தில் ஈதர் இவற்றின் பிணைப்பின் பிரிகை ஆற்றல் முறையே 73 மற்றும் 77 கிலோ கலோரி/மோல் (305 மற்றும் 322 kJ/mol). தயோல்களை அல்க்கைல் ஏற்றம் செய்து பொதுவாக சல்பைடுகள் தயாரிக்கப்படுகின்றன.மேலும் பம்மரர் மறுசீராக்கம்(Pummerer rearrangement) மூலமாகவும் தயார் செய்யப்படுகிறது. சல்பர் மற்றும் அலுமினியம் குளோரைடு[5] உடன் பினைல் ஈதர் மறுசீராக்கம் அடைந்து பினாக்சதினாக மாற்றம் அடைகிறது. இப் பெயர் வினை பெராரியோ (Ferrario) பெயர்வினை என்று அழைக்கப்படுகிறது. தயோல்கள், டைசல்பைடுகள்,பாலிசல்பைடுகள் (Thiols, disulfides, polysulfides)தயோல் வினைபடு தொகுதியாகஆர்−எாஸ். எச் ஐக் கொண்டுள்ளன. தயோல்கள் கட்டமைப்பில் ஆல்ககாலை ஒத்து காணப்படுகின்றன. இருந்தாலும் வேதியியல் பண்புகளும், செயல்பாடுகளும் வேறுபட்டுக் காணப்படுகின்றன. தயோல்கள் அதிகளவு கருக்கவர்தன்மை மற்றும் அதிக அமிலத்தன்மை உடையவை. மேலும், எளிதில் ஆக்சிசன் ஏற்றம் அடைகின்றன. இதன் அமிலத்தன்மை 5 pKa அலகுகள்[6] வேறுபடுகிறது. தயோ ஏசுத்தர்(Thioesters)தயோ ஏசுத்தரின் பொது அமைப்பு ஆர்−சி(O)−S−R. மேற்கோள்கள்
|
Portal di Ensiklopedia Dunia