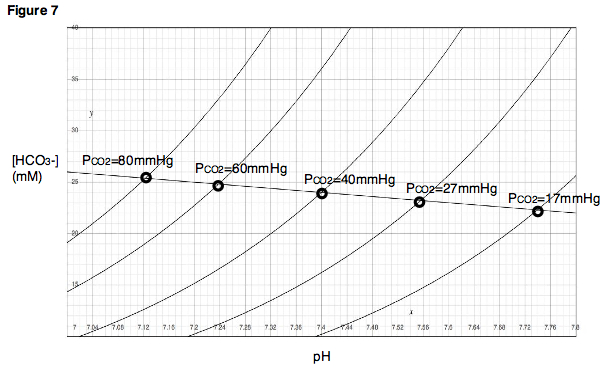
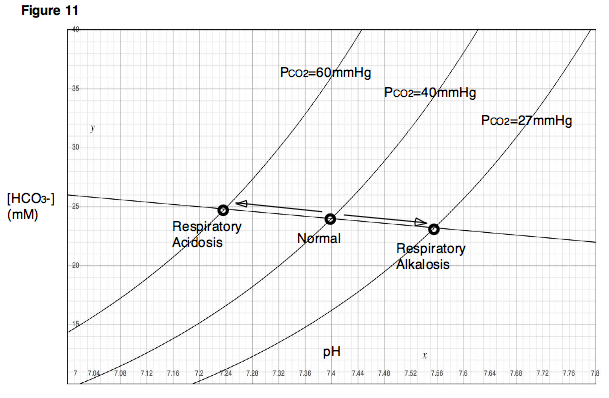
Діаграма ДевенпортаУ фізіології кислотно-лужного балансу діаграма Девенпорта (Давенпорта) — це графічний інструмент, розроблений Горасом В. Девенпортом, який дозволяє клініцисту або досліднику описувати концентрацію бікарбонату в крові та pH крові після порушення кислотно-основного балансу, пов'язаного з диханням та/або метаболізмом. На діаграмі зображено тривимірну поверхню, що описує всі можливі стани хімічної рівноваги між вуглекислим газом, бікарбонатом та протонами на фізіологічно складному інтерфейсі альвеол легень та альвеолярних капілярів. Хоча поверхня, представлена на діаграмі, визначена експериментально, діаграма Девенпорта рідко використовується в клінічних умовах, але дозволяє досліднику або студенту уявити вплив фізіологічних змін на кислотно-основний баланс крові. Для клінічного використання нещодавно запроваджено дві інновації: кислотно-основну діаграму, яка надає текстові описи аномалій[1], та версію для високогір'я, яка надає текстові описи, що відповідають висоті.[2] ВиведенняКоли зразок крові піддається впливу повітря, або в альвеолах легень, або в лабораторному експерименті in vitro, вуглекислий газ (CO2) у повітрі швидко входить у рівновагу з похідними вуглекислого газу та іншими речовинами у водному розчині. На рисунку 1 проілюстровано найважливіші рівноважні реакції CO2 в крові, пов'язані з кислотно-основною фізіологією: Зверніть увагу, що в цьому рівнянні буферна система HB/B- представляє всі небікарбонатні буфери, присутні в крові, такі як гемоглобін у його різних протонованих та депротонованих станах. Оскільки в крові людини присутня велика кількість різних небікарбонатних буферів, кінцевий рівноважний стан, досягнутий при будь-якому заданому парціальному тиску вуглекислого газу (PCO2), є дуже складним і не може бути легко передбачуваний, використовуючи лише теорію. Зображуючи експериментальні результати, діаграма Девенпорта забезпечує простий підхід до опису поведінки цієї складної системи. На рисунку 2 показано діаграму Девенпорта, як її зазвичай зображують у підручниках та літературі. Щоб зрозуміти, як її слід інтерпретувати, корисно зрозуміти, як вона взагалі була побудована. Розглянемо наступний експеримент. У здорового пацієнта береться невеликий зразок крові та поміщається в камеру, в якій PCO2 підтримується на рівні 40 мм рт. ст. Після досягнення рівноваги вимірюють pH та концентрацію бікарбонату ([HCO− Далі, PCO2 у камері підтримується постійним, поки змінюється pH зразка крові, спочатку додаванням сильної кислоти, а потім сильної основи. При зміні pH формується крива титрування зразка (рис. 4). Зверніть увагу, що ця крива титрування дійсна лише при PCO2 40 мм рт. ст., оскільки цей парціальний тиск у камері підтримувався протягом усього експерименту. Далі уявіть, що експериментатор отримує новий, ідентичний зразок крові від того ж пацієнта. Однак, замість того, щоб поміщати зразок у камеру з PaCO2 40 мм рт. ст., PaCO2 у камері встановлюють 60 мм рт. ст. Після встановлення рівноваги досягається нова точка, що вказує на новий pH та нову [HCO− Якщо цей самий експеримент повторити при різних PCO2, буде отримано серію точок. Через ці точки можна провести лінію, яку називають буферною лінією (рис. 6). Буферну лінію можна використовувати для прогнозування результату зміни PCO2 діапазоні, близькому до експериментально визначених точок. Крім того, для кожної експериментальної точки можна провести титрування, в якому змінюється pH, а PCO2 підтримується постійним, і побудувати криві титрування для кожного PCO2 (рис. 7). На діаграмі Девенпорта ці криві титрування називаються ізоплетами, оскільки вони утворюються за фіксованого парціального тиску вуглекислого газу. Ключовою концепцією для розуміння діаграми Девенпорта є те, що зі збільшенням PCO2 величина результуючої зміни pH залежить від буферної здатності небікарбонатних буферів, присутніх у розчині. Якщо присутні сильні небікарбонатні буфери, то вони швидко поглинуть переважну більшість H+, що вивільняються внаслідок утворення HCO− Повчально зазначити, що нахил бікарбонатної лінії ніколи насправді не досягне нуля (тобто ніколи не буде горизонтальним) за рівноважних умов, навіть за повної відсутності небікарбонатних буферів. Це пояснюється тим, що утворення H+ внаслідок збільшення PCO2 супроводжується утворенням HCO− Двовимірне зображення тривимірної поверхніНагадаємо, що зв'язок, представлений на діаграмі Девенпорта, є зв'язком між трьома змінними: PCO2, [HCO− Більш точне зображення включало б три осі. На рисунку 9 показано діаграму Девенпорта у трьох вимірах. Світло-блакитні лінії позначають ізоплети в їхньому звичайному вигляді, обмеженому двовимірною площиною. Темно-сині криві показують фактичне розташування ізоплет у трьох вимірах. Таким чином, світло-блакитні лінії — це просто проекції ізоплет у тривимірному просторі на двовимірну площину. Знову ж таки, нагадаємо, що ізоплета — це просто крива титрування, тобто шлях, який прокладається, якщо pH змінюється при постійному PCO2. Зелена поверхня описує всі комбінації PCO2, [HCO− Друга ключова концепція полягає в тому, що рух уздовж буферної лінії повинен відповідати зміні PCO2 Таким чином, подібно до ізоплетів, буферна лінія, намальована на типовій діаграмі Девенпорта (наприклад, рис. 6), насправді є проекцією лінії, що існує в тривимірному просторі, на двовимірну площину. Як і у випадку з ізоплетами, буферні лінії у своїй фактичній тривимірній орієнтації обмежені поверхнею, що представляє значення PCO2, [HCO− Порушення дихання та метаболізмуОднією з найважливіших особливостей діаграми Девенпорта є її корисність для зображення руху з однієї точки на поверхні рівноваги до іншої після змін дихання та/або метаболізму. Можуть виникнути чотири фундаментальні зміни, які впливають на кислотно-основний баланс в організмі: респіраторний ацидоз, респіраторний алкалоз, метаболічний ацидоз та метаболічний алкалоз. Крім того, одночасно можуть виникати дихальні та метаболічні порушення, такі як респіраторний ацидоз з подальшим компенсаторним зрушенням у бік метаболічного алкалозу. Порушення диханняЩоб зрозуміти, як зміни в диханні можуть впливати на pH крові, розглянемо вплив вентиляції на рівень PCO2 у легенях. Коли людина затримує дихання (або дихає дуже повільно, як у випадку пригнічення дихання), кров продовжує доставляти CO2 до альвеол легень, і кількість CO2 в легенях збільшується. З іншого боку, якщо людина посилює вентиляцію, то в легені потрапляє свіже повітря, а CO2 швидко видихається. У першому випадку, оскільки CO2 накопичується в легенях, альвеолярний рівень PCO2 стає дуже високим. У другому випадку, оскільки CO2 швидко виходить з легень, альвеолярний рівень PCO2 буде дуже низьким. Зверніть увагу, що ці дві ситуації, гіповентиляція та гіпервентиляція, викликають ефекти, які безпосередньо аналогічні експерименту, описаному раніше, в якому змінювалися PCO2 та спостерігалися зміни pH. Як показано на діаграмі Девенпорта, пригнічення дихання, яке призводить до високого PCO2, знижує pH крові. Гіпервентиляція матиме протилежний ефект. Зниження pH крові внаслідок гіповентиляції називається респіраторним ацидозом. Підвищення pH крові внаслідок гіпервентиляції називається респіраторним алкалозом (рис. 11). Метаболічні порушенняЗміни метаболічного складу крові також можуть впливати на рН крові. Знову ж таки, згадаємо з нашого першого експерименту, що якщо до зразка крові додати сильну кислоту або сильну основу, pH та [HCO− Аналогічно, у фізіологічній системі, такій як живий організм, видалення H+, наприклад, шляхом блювоти кислого вмісту шлунка, призведе до підвищення pH та збільшення [HCO− Примітки
|
Portal di Ensiklopedia Dunia