–ü–Ķ—Ä—Ė–ĺ–ī 3 –Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ĺ—ó —Ā–ł—Ā—ā–Ķ–ľ–ł –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤
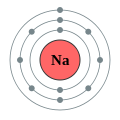
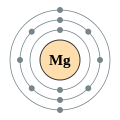
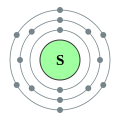
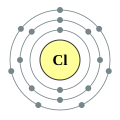
–Ē–ĺ —ā—Ä–Ķ—ā—Ć–ĺ–≥–ĺ –Ņ–Ķ—Ä—Ė–ĺ–ī—É –Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ĺ—ó —Ā–ł—Ā—ā–Ķ–ľ–ł –≤—Ė–ī–Ĺ–ĺ—Ā—Ź—ā—Ć—Ā—Ź –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā–ł —ā—Ä–Ķ—ā—Ć–ĺ–≥–ĺ —Ä—Ź–ī–ļ–į (–į–Ī–ĺ —ā—Ä–Ķ—ā—Ć–ĺ—ó –Ņ–Ķ—Ä—Ė–ĺ–ī—É) –Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ĺ—ó —Ā–ł—Ā—ā–Ķ–ľ–ł —Ö—Ė–ľ—Ė—á–Ĺ–ł—Ö –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤. –Ď—É–ī–ĺ–≤–į –Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ĺ—ó —ā–į–Ī–Ľ–ł—Ü—Ė –∑–į—Ā–Ĺ–ĺ–≤–į–Ĺ–į –Ĺ–į —Ä—Ź–ī–ļ–į—Ö –ī–Ľ—Ź —Ė–Ľ—é—Ā—ā—Ä–į—Ü—Ė—ó –Ņ–ĺ–≤—ā–ĺ—Ä—é–≤–į–Ĺ–ł—Ö (–Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ł—Ö) —ā—Ä–Ķ–Ĺ–ī—Ė–≤ —É —Ö—Ė–ľ—Ė—á–Ĺ–ł—Ö –≤–Ľ–į—Ā—ā–ł–≤–ĺ—Ā—ā—Ź—Ö –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤ –Ņ—Ä–ł –∑–Ī—Ė–Ľ—Ć—ą–Ķ–Ĺ–Ĺ—Ė –į—ā–ĺ–ľ–Ĺ–ĺ–≥–ĺ –Ĺ–ĺ–ľ–Ķ—Ä–į: –Ĺ–ĺ–≤–ł–Ļ —Ä—Ź–ī–ĺ–ļ –Ņ–ĺ—á–ł–Ĺ–į—Ē—ā—Ć—Ā—Ź —ā–ĺ–ī—Ė, –ļ–ĺ–Ľ–ł —Ö—Ė–ľ—Ė—á–Ĺ—Ė –≤–Ľ–į—Ā—ā–ł–≤–ĺ—Ā—ā—Ė –Ņ–ĺ–≤—ā–ĺ—Ä—é—é—ā—Ć—Ā—Ź, —Č–ĺ –ĺ–∑–Ĺ–į—á–į—Ē, —Č–ĺ –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā–ł –∑ –į–Ĺ–į–Ľ–ĺ–≥—Ė—á–Ĺ–ł–ľ–ł –≤–Ľ–į—Ā—ā–ł–≤–ĺ—Ā—ā—Ź–ľ–ł –Ņ–ĺ—ā—Ä–į–Ņ–Ľ—Ź—é—ā—Ć –≤ –ĺ–ī–ł–Ĺ —Ė —ā–ĺ–Ļ –∂–Ķ –≤–Ķ—Ä—ā–ł–ļ–į–Ľ—Ć–Ĺ–ł–Ļ —Ā—ā–ĺ–≤–Ņ–Ķ—Ü—Ć. –£—Ā—Ė –į—ā–ĺ–ľ–ł —ā—Ä–Ķ—ā—Ć–ĺ–≥–ĺ –Ņ–Ķ—Ä—Ė–ĺ–ī—É –Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ĺ—ó —Ā–ł—Ā—ā–Ķ–ľ–ł –ľ–į—é—ā—Ć —ā—Ä–ł –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–Ĺ—Ė –ĺ–Ī–ĺ–Ľ–ĺ–Ĺ–ļ–ł. –ó–ĺ–≤–Ĺ—Ė—ą–Ĺ—Ź (—ā—Ä–Ķ—ā—Ź) –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–Ĺ–į –ĺ–Ī–ĺ–Ľ–ĺ–Ĺ–ļ–į –ľ–ĺ–∂–Ķ –Ī—É—ā–ł –∑–į–Ĺ—Ź—ā–į –≤—Ė–ī –ĺ–ī–Ĺ–ĺ–≥–ĺ –ī–ĺ –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ –≤–ĺ—Ā—Ć–ľ–ł –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ—Ė–≤ (–į—Ä–≥–ĺ–Ĺ - [Ne] 3s2 3p6). –Ę–į–ļ–ł–ľ —á–ł–Ĺ–ĺ–ľ —ā—Ä–Ķ—ā—Ė–Ļ –Ņ–Ķ—Ä—Ė–ĺ–ī –ľ—Ė—Ā—ā–ł—ā—Ć 8 —Ö—Ė–ľ—Ė—á–Ĺ–ł—Ö –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤ (—Ź–ļ —Ė –Ņ–ĺ–Ņ–Ķ—Ä–Ķ–ī–Ĺ—Ė–Ļ), –ī–ĺ –Ĺ—Ć–ĺ–≥–ĺ –≤—Ö–ĺ–ī—Ź—ā—Ć: –Ĺ–į—ā—Ä—Ė–Ļ, –ľ–į–≥–Ĺ—Ė–Ļ, –į–Ľ—é–ľ—Ė–Ĺ—Ė–Ļ, –ļ—Ä–Ķ–ľ–Ĺ—Ė–Ļ, —Ą–ĺ—Ā—Ą–ĺ—Ä, —Ā—Ė—Ä–ļ–į, —Ö–Ľ–ĺ—Ä —Ė –į—Ä–≥–ĺ–Ĺ. –ü–Ķ—Ä—ą—Ė –ī–≤–į –∑ –Ĺ–ł—Ö, –Ĺ–į—ā—Ä—Ė–Ļ —Ė –ľ–į–≥–Ĺ—Ė–Ļ, –≤—Ö–ĺ–ī—Ź—ā—Ć –ī–ĺ s-–Ī–Ľ–ĺ–ļ—É –Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ĺ—ó —ā–į–Ī–Ľ–ł—Ü—Ė, —ā–ĺ–ī—Ė —Ź–ļ —Ė–Ĺ—ą—Ė –≤—Ė–ī–Ĺ–ĺ—Ā—ā—Ź—ā—Ć—Ā—Ź –ī–ĺ —Ä-–Ī–Ľ–ĺ–ļ—É. –°–Ľ—Ė–ī –∑–≤–Ķ—Ä–Ĺ—É—ā–ł —É–≤–į–≥—É, —Č–ĺ 3d-–ĺ—Ä–Ī—Ė—ā–į–Ľ—Ė —É –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤ –Ĺ–Ķ –∑–į–Ņ–ĺ–≤–Ĺ–Ķ–Ĺ—Ė –ī–ĺ 4 –Ņ–Ķ—Ä—Ė–ĺ–ī—É, —Č–ĺ –ī–į—Ē –Ņ–Ķ—Ä—Ė–ĺ–ī–į–ľ —ā–į–Ī–Ľ–ł—Ü—Ė —ó—Ö —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–ł–Ļ –≤–ł–≥–Ľ—Ź–ī ¬ę–ī–≤–į —Ä—Ź–ī–ļ–ł –≤ –ĺ–ī–Ĺ–ĺ–ľ—ɬĽ. –ě–≥–Ľ—Ź–ī–í—Ā—Ė –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā–ł —ā—Ä–Ķ—ā—Ć–ĺ–≥–ĺ –Ņ–Ķ—Ä—Ė–ĺ–ī—É –∑—É—Ā—ā—Ä—Ė—á–į—é—ā—Ć—Ā—Ź –≤ –Ņ—Ä–ł—Ä–ĺ–ī—Ė —Ė –ľ–į—é—ā—Ć –Ņ—Ä–ł–Ĺ–į–Ļ–ľ–Ĺ—Ė –ĺ–ī–ł–Ĺ —Ā—ā–į–Ī—Ė–Ľ—Ć–Ĺ–ł–Ļ —Ė–∑–ĺ—ā–ĺ–Ņ. –ē–Ľ–Ķ–ľ–Ķ–Ĺ—ā–ł
–ē–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–Ĺ—Ė –ļ–ĺ–Ĺ—Ą—Ė–≥—É—Ä–į—Ü—Ė—ó
–Ě–į—ā—Ä—Ė–Ļ –Ě–į—ā—Ä—Ė–Ļ (Na) ‚ÄĒ –Ľ—É–∂–Ĺ–ł–Ļ –ľ–Ķ—ā–į–Ľ —Ā—Ä—Ė–Ī–Ľ—Ź—Ā—ā–ĺ-–Ī—Ė–Ľ–ĺ–≥–ĺ –ļ–ĺ–Ľ—Ć–ĺ—Ä—É –∑ –į—ā–ĺ–ľ–Ĺ–ł–ľ –Ĺ–ĺ–ľ–Ķ—Ä–ĺ–ľ 11, –į—ā–ĺ–ľ–Ĺ–ĺ—é –ľ–į—Ā–ĺ—é 22,98977, —Č–ĺ –ľ–į—Ē –ĺ–ī–ł–Ĺ —Ā—ā–į–Ī—Ė–Ľ—Ć–Ĺ–ł–Ļ —Ė–∑–ĺ—ā–ĺ–Ņ 23Na. –í–ľ—Ė—Ā—ā –Ĺ–į—ā—Ä—Ė—é —É –∑–Ķ–ľ–Ĺ—Ė–Ļ –ļ–ĺ—Ä—Ė 2,64% –∑–į –ľ–į—Ā–ĺ—é. –Ě–į—ā—Ä—Ė–Ļ –Ņ—Ä–ł—Ā—É—ā–Ĺ—Ė–Ļ —É –≤–Ķ–Ľ–ł–ļ–ł—Ö –ļ—Ė–Ľ—Ć–ļ–ĺ—Ā—ā—Ź—Ö —É —Ā–≤—Ė—ā–ĺ–≤–ĺ–ľ—É –ĺ–ļ–Ķ–į–Ĺ—Ė —É —Ą–ĺ—Ä–ľ—Ė —Ö–Ľ–ĺ—Ä–ł–ī—É –Ĺ–į—ā—Ä—Ė—é. –£ –∂–ł–≤–ł—Ö –ĺ—Ä–≥–į–Ĺ—Ė–∑–ľ–į—Ö –Ĺ–į—ā—Ä—Ė–Ļ –∑–Ĺ–į—Ö–ĺ–ī–ł—ā—Ć—Ā—Ź –Ī—Ė–Ľ—Ć—ą–ĺ—é —á–į—Ā—ā–ł–Ĺ–ĺ—é –∑–ĺ–≤–Ĺ—Ė –ļ–Ľ—Ė—ā–ł–Ĺ (–Ņ—Ä–ł–Ī–Ľ–ł–∑–Ĺ–ĺ —É 15 —Ä–į–∑—Ė–≤ –Ī—Ė–Ľ—Ć—ą–Ķ –Ĺ—Ė–∂ —É —Ü–ł—ā–ĺ–Ņ–Ľ–į–∑–ľ—Ė). –¶—é —Ä—Ė–∑–Ĺ–ł—Ü—é –Ņ—Ė–ī—ā—Ä–ł–ľ—É—Ē –Ĺ–į—ā—Ä—Ė–Ļ-–ļ–į–Ľ—Ė—Ē–≤–ł–Ļ –Ĺ–į—Ā–ĺ—Ā, —Ź–ļ–ł–Ļ –≤—Ė–ī–ļ–į—á—É—Ē –Ĺ–į—ā—Ä—Ė–Ļ, —Č–ĺ –Ņ–ĺ—ā—Ä–į–Ņ–ł–≤ –≤—Ā–Ķ—Ä–Ķ–ī–ł–Ĺ—É –ļ–Ľ—Ė—ā–ł–Ĺ–ł. –†–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–ĺ–≤–į–Ĺ–į –ī–ĺ–∑–į –Ĺ–į—ā—Ä—Ė—é —Ā—ā–į–Ĺ–ĺ–≤–ł—ā—Ć –ī–Ľ—Ź –ī—Ė—ā–Ķ–Ļ –≤—Ė–ī 600 –ī–ĺ 1700 –ľ—Ė–Ľ—Ė–≥—Ä–į–ľ—Ė–≤, –ī–Ľ—Ź –ī–ĺ—Ä–ĺ—Ā–Ľ–ł—Ö –≤—Ė–ī 1200 –ī–ĺ 2300 –ľ—Ė–Ľ—Ė–≥—Ä–į–ľ—Ė–≤. –£ –≤–ł–≥–Ľ—Ź–ī—Ė –ļ—É—Ö–ĺ–Ĺ–Ĺ–ĺ—ó —Ā–ĺ–Ľ—Ė —Ü–Ķ —Ā—ā–į–Ĺ–ĺ–≤–ł—ā—Ć –≤—Ė–ī 3 –ī–ĺ 6 –≥—Ä–į–ľ—Ė–≤ –Ĺ–į –ī–Ķ–Ĺ—Ć. –ú–į–≥–Ĺ—Ė–Ļ –ú–į–≥–Ĺ—Ė–Ļ (Mg) ‚ÄĒ –Ľ—É–∂–Ĺ–ĺ–∑–Ķ–ľ–Ķ–Ľ—Ć–Ĺ–ł–Ļ –ľ–Ķ—ā–į–Ľ —Ā—Ä—Ė–Ī–Ľ—Ź—Ā—ā–ĺ-–Ī—Ė–Ľ–ĺ–≥–ĺ –ļ–ĺ–Ľ—Ć–ĺ—Ä—É –∑ –į—ā–ĺ–ľ–Ĺ–ł–ľ –Ĺ–ĺ–ľ–Ķ—Ä–ĺ–ľ 12 —Ė –į—ā–ĺ–ľ–Ĺ–ĺ—é –ľ–į—Ā–ĺ—é 24,305. –ú–į—Ē —ā—Ä–ł —Ā—ā–į–Ī—Ė–Ľ—Ć–Ĺ–ł—Ö —Ė–∑–ĺ—ā–ĺ–Ņ–ł: 24Mg (78,60%), 25Mg (10,11%), 26Mg (11,29%). –ě—Ā–Ĺ–ĺ–≤–Ĺ–į –ĺ–Ī–Ľ–į—Ā—ā—Ć –≤–ł–ļ–ĺ—Ä–ł—Ā—ā–į–Ĺ–Ĺ—Ź –ľ–į–≥–Ĺ—Ė—é ‚ÄĒ –≤–ł—Ä–ĺ–Ī–Ĺ–ł—Ü—ā–≤–ĺ –ľ–į–≥–Ĺ—Ė—Ē–≤–ł—Ö —Ā–Ņ–Ľ–į–≤—Ė–≤. –ú–į–≥–Ĺ—Ė–Ļ –∑–į—Ā—ā–ĺ—Ā–ĺ–≤—É—é—ā—Ć —ā–į–ļ–ĺ–∂ –ī–Ľ—Ź –Ľ–Ķ–≥—É–≤–į–Ĺ–Ĺ—Ź —Ā–Ņ–Ľ–į–≤—Ė–≤ –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤—Ė –į–Ľ—é–ľ—Ė–Ĺ—Ė—é, –ī–Ľ—Ź –ľ–Ķ—ā–į–Ľ–ĺ—ā–Ķ—Ä–ľ—Ė—á–Ĺ–ĺ–≥–ĺ –ĺ—ā—Ä–ł–ľ–į–Ĺ–Ĺ—Ź –ī–Ķ—Ź–ļ–ł—Ö –ľ–Ķ—ā–į–Ľ—Ė–≤ (Ti, U, Zr, V —ā–į —Ė–Ĺ.), –ī–Ľ—Ź —Ä–ĺ–∑–ļ–ł—Ā–Ľ–Ķ–Ĺ–Ĺ—Ź —ā–į –ī–Ķ—Ā—É–Ľ—Ć—Ą—É—Ä–į—Ü—Ė—ó —Ä—Ź–ī—É –ľ–Ķ—ā–į–Ľ—Ė–≤ —Ė —Ā–Ņ–Ľ–į–≤—Ė–≤, —É —Ā–ł–Ĺ—ā–Ķ–∑—Ė –ľ–į–≥–Ĺ—Ė–Ļ–ĺ—Ä–≥–į–Ĺ—Ė—á–Ĺ–ł—Ö –∑'—Ē–ī–Ĺ–į–Ĺ—Ć. –ô–ĺ–Ĺ–ł –ľ–į–≥–Ĺ—Ė—é –∑–Ĺ–į–Ļ–ī–Ķ–Ĺ—Ė —É —Ö–Ľ–ĺ—Ä–ĺ—Ą—Ė–Ľ—Ė. –ź–Ľ—é–ľ—Ė–Ĺ—Ė–Ļ –ź–Ľ—é–ľ—Ė–Ĺ—Ė–Ļ (Al) ‚ÄĒ –Ņ–ĺ—Ā—ā–Ņ–Ķ—Ä–Ķ—Ö—Ė–ī–Ĺ–ł–Ļ –ľ–Ķ—ā–į–Ľ —Ā—Ä—Ė–Ī–Ľ—Ź—Ā—ā–ĺ-–Ī—Ė–Ľ–ĺ–≥–ĺ –ļ–ĺ–Ľ—Ć–ĺ—Ä—É –∑ –į—ā–ĺ–ľ–Ĺ–ł–ľ –Ĺ–ĺ–ľ–Ķ—Ä–ĺ–ľ 13, –į—ā–ĺ–ľ–Ĺ–ĺ—é –ľ–į—Ā–ĺ—é 26,98154, —Č–ĺ –ľ–į—Ē –ĺ–ī–ł–Ĺ —Ā—ā–į–Ī—Ė–Ľ—Ć–Ĺ–ł–Ļ —Ė–∑–ĺ—ā–ĺ–Ņ 27Al. –í–ľ—Ė—Ā—ā –į–Ľ—é–ľ—Ė–Ĺ—Ė—é —É –∑–Ķ–ľ–Ĺ—Ė–Ļ –ļ–ĺ—Ä—Ė 8,8% –∑–į –ľ–į—Ā–ĺ—é. –ó–į –Ņ–ĺ—ą–ł—Ä–Ķ–Ĺ—Ė—Ā—ā—é —É –Ņ—Ä–ł—Ä–ĺ–ī—Ė –≤—Ė–Ĺ –∑–į–Ļ–ľ–į—Ē —á–Ķ—ā–≤–Ķ—Ä—ā–Ķ –ľ—Ė—Ā—Ü–Ķ —Ā–Ķ—Ä–Ķ–ī –≤—Ā—Ė—Ö –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤ (–Ņ—Ė—Ā–Ľ—Ź –ļ–ł—Ā–Ĺ—é, –≤–ĺ–ī–Ĺ—é —Ė –ļ—Ä–Ķ–ľ–Ĺ—Ė—é) —ā–į –Ņ–Ķ—Ä—ą–Ķ —Ā–Ķ—Ä–Ķ–ī –ľ–Ķ—ā–į–Ľ—Ė–≤. –£ –≤—Ė–Ľ—Ć–Ĺ–ĺ–ľ—É –≤–ł–≥–Ľ—Ź–ī—Ė –Ĺ–Ķ –∑—É—Ā—ā—Ä—Ė—á–į—Ē—ā—Ć—Ā—Ź. –ź–Ľ—é–ľ—Ė–Ĺ—Ė–Ļ –≤–ł–ļ–ĺ—Ä–ł—Ā—ā–ĺ–≤—É—é—ā—Ć –≥–ĺ–Ľ–ĺ–≤–Ĺ–ł–ľ —á–ł–Ĺ–ĺ–ľ –ī–Ľ—Ź –ĺ—ā—Ä–ł–ľ–į–Ĺ–Ĺ—Ź –į–Ľ—é–ľ—Ė–Ĺ—Ė—Ē–≤–ł—Ö —Ā–Ņ–Ľ–į–≤—Ė–≤. –ß–ł—Ā—ā–ł–Ļ –į–Ľ—é–ľ—Ė–Ĺ—Ė–Ļ ‚ÄĒ –ļ–ĺ–Ĺ—Ā—ā—Ä—É–ļ—Ü—Ė–Ļ–Ĺ–ł–Ļ –ľ–į—ā–Ķ—Ä—Ė–į–Ľ —É –Ī—É–ī—Ė–≤–Ĺ–ł—Ü—ā–≤—Ė –Ī—É–ī–ł–Ĺ–ļ—Ė–≤, —É —Ā—É–ī–Ĺ–ĺ–Ī—É–ī—É–≤–į–Ĺ–Ĺ—Ė, –ī–Ľ—Ź –ĺ–Ī–Ľ–į–ī–Ĺ–į–Ĺ–Ĺ—Ź —Ā–ł–Ľ–ĺ–≤–ł—Ö –Ņ—Ė–ī—Ā—ā–į–Ĺ—Ü—Ė–Ļ —Ė —ā. –ī. –ó–į—Ā—ā–ĺ—Ā–ĺ–≤—É—é—ā—Ć –į–Ľ—é–ľ—Ė–Ĺ—Ė–Ļ —ā–į–ļ–ĺ–∂ –ī–Ľ—Ź –≤–ł–≥–ĺ—ā–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—Ź –ļ–į–Ī–Ķ–Ľ—Ć–Ĺ–ł—Ö, —Ā—ā—Ä—É–ľ–ĺ–Ņ—Ä–ĺ–≤—Ė–ī–Ĺ–ł—Ö —ā–į —Ė–Ĺ—ą–ł—Ö –≤–ł—Ä–ĺ–Ī—Ė–≤ –≤ –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ—ā–Ķ—Ö–Ĺ—Ė—Ü—Ė, –ļ–ĺ—Ä–Ņ—É—Ā—Ė–≤ —Ė –ĺ—Ö–ĺ–Ľ–ĺ–ī–∂—É–≤–į—á—Ė–≤ –ī—Ė–ĺ–ī—Ė–≤, —Ā–Ņ–Ķ—Ü—Ė–į–Ľ—Ć–Ĺ–ĺ—ó —Ö—Ė–ľ—Ė—á–Ĺ–ĺ—ó –į–Ņ–į—Ä–į—ā—É—Ä–ł, —ā–ĺ–≤–į—Ä—Ė–≤ –Ĺ–į—Ä–ĺ–ī–Ĺ–ĺ–≥–ĺ —Ā–Ņ–ĺ–∂–ł–≤–į–Ĺ–Ĺ—Ź. –ü–ĺ–ļ—Ä–ł—ā—ā—Ź –∑ –į–Ľ—é–ľ—Ė–Ĺ—Ė—é –Ĺ–į–Ĺ–ĺ—Ā—Ź—ā—Ć –Ĺ–į —Ā—ā–į–Ľ–Ķ–≤—Ė –≤–ł—Ä–ĺ–Ī–ł –ī–Ľ—Ź –Ņ—Ė–ī–≤–ł—Č–Ķ–Ĺ–Ĺ—Ź —ó—Ö –ļ–ĺ—Ä–ĺ–∑—Ė–Ļ–Ĺ–ĺ—ó —Ā—ā—Ė–Ļ–ļ–ĺ—Ā—ā—Ė. –ö—Ä–Ķ–ľ–Ĺ—Ė–Ļ–ö—Ä–Ķ–ľ–Ĺ—Ė–Ļ (Si) ‚ÄĒ –ľ–Ķ—ā–į–Ľ–ĺ—ó–ī, –Ĺ–į–Ņ—Ė–≤–Ņ—Ä–ĺ–≤—Ė–ī–Ĺ–ł–ļ –∑ –į—ā–ĺ–ľ–Ĺ–ł–ľ –Ĺ–ĺ–ľ–Ķ—Ä–ĺ–ľ 14. –ß–ł—Ā—ā–į —Ä–Ķ—á–ĺ–≤–ł–Ĺ–į —É—ā–≤–ĺ—Ä—é—Ē —ā–Ķ–ľ–Ĺ–ĺ-—Ā—Ė—Ä—Ė –∑—Ė —Ā–ľ–ĺ–Ľ–ł—Ā—ā–ł–ľ –Ī–Ľ–ł—Ā–ļ–ĺ–ľ –ļ—Ä–ł—Ö–ļ—Ė –ļ—Ä–ł—Ā—ā–į–Ľ–ł –∑ –≥—Ä–į–Ĺ–Ķ—Ü–Ķ–Ĺ—ā—Ä–ĺ–≤–į–Ĺ–ĺ—é –ļ—É–Ī—Ė—á–Ĺ–ĺ—é “Ď—Ä–į—ā–ļ–ĺ—é —ā–ł–Ņ—É –į–Ľ–ľ–į–∑—É. –ó–į –Ĺ–ĺ–≤–ĺ—é –Ĺ–ĺ–ľ–Ķ–Ĺ–ļ–Ľ–į—ā—É—Ä–ĺ—é IUPAC –°–ł–Ľ—Ė—Ü—Ė–Ļ –Ĺ–į–Ľ–Ķ–∂–ł—ā—Ć –ī–ĺ –≥—Ä—É–Ņ–ł 14 –Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ĺ—ó —Ā–ł—Ā—ā–Ķ–ľ–ł –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤, –∑–į —Ā—ā–į—Ä–ĺ—é ‚ÄĒ –ī–ĺ IV –Ņ—Ė–ī–≥—Ä—É–Ņ–ł –ĺ—Ā–Ĺ–ĺ–≤–Ĺ–ĺ—ó –≥—Ä—É–Ņ–ł. –ď—É—Ā—ā–ł–Ĺ–į –ļ—Ä–Ķ–ľ–Ĺ—Ė—é 2,328, t–Ņ–Ľ–į–≤ 1415 ¬įC, t–ļ–ł–Ņ 3250 ¬įC. –Ę–≤–Ķ—Ä–ī—Ė—Ā—ā—Ć –∑–į –Ď—Ä—Ė–Ĺ–Ķ–Ľ–Ľ–Ķ–ľ 2,4 –ď–ü–į, –∑–į –ú–ĺ–ĺ—Ā–ĺ–ľ 7. –ú–ĺ–ī—É–Ľ—Ć –Ņ—Ä—É–∂–Ĺ–ĺ—Ā—ā—Ė 109 –ď–ü–į. –ö—Ä–Ķ–ľ–Ĺ—Ė–Ļ ‚ÄĒ –Ĺ–į–Ņ—Ė–≤–Ņ—Ä–ĺ–≤—Ė–ī–Ĺ–ł–ļ, –Ķ–Ľ–Ķ–ļ—ā—Ä–ł—á–Ĺ—Ė –≤–Ľ–į—Ā—ā–ł–≤–ĺ—Ā—ā—Ė —Ź–ļ–ĺ–≥–ĺ —Ā–ł–Ľ—Ć–Ĺ–ĺ –∑–į–Ľ–Ķ–∂–į—ā—Ć –≤—Ė–ī –ī–ĺ–ľ—Ė—ą–ĺ–ļ. –ü—Ä–ł –Ĺ–ł–∑—Ć–ļ—Ė–Ļ —ā–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä—Ė –°–ł–Ľ—Ė—Ü—Ė–Ļ —Ö—Ė–ľ—Ė—á–Ĺ–ĺ —Ė–Ĺ–Ķ—Ä—ā–Ĺ–ł–Ļ. –ó –Ī–į–≥–į—ā—Ć–ľ–į –ľ–Ķ—ā–į–Ľ–į–ľ–ł —É—ā–≤–ĺ—Ä—é—Ē —Ā–ł–Ľ—Ė—Ü–ł–ī–ł. –í–ľ—Ė—Ā—ā —É –∑–Ķ–ľ–Ĺ—Ė–Ļ –ļ–ĺ—Ä—Ė 27,6% –∑–į –ľ–į—Ā–ĺ—é. –°–ĺ–Ľ—Ė –ļ—Ä–Ķ–ľ–Ĺ—Ė—Ē–≤–ł—Ö –ļ–ł—Ā–Ľ–ĺ—ā –Ņ–ĺ—ą–ł—Ä–Ķ–Ĺ—Ė –≤ –Ņ—Ä–ł—Ä–ĺ–ī—Ė ‚ÄĒ –ľ—Ė–Ĺ–Ķ—Ä–į–Ľ–ł –ļ–Ľ–į—Ā—É –Ņ—Ä–ł—Ä–ĺ–ī–Ĺ–ł—Ö —Ā–ł–Ľ—Ė–ļ–į—ā—Ė–≤. –ü—Ä–ł —Ė–∑–ĺ–ľ–ĺ—Ä—Ą–Ĺ–ĺ–ľ—É –∑–į–ľ—Ė—Č–Ķ–Ĺ–Ĺ—Ė –≤ —ó—Ö–Ĺ—Ė–Ļ —Ā—ā—Ä—É–ļ—ā—É—Ä—Ė —á–į—Ā—ā–ł–Ĺ–ł –ļ—Ä–Ķ–ľ–Ĺ—Ė—é –į–Ľ—é–ľ—Ė–Ĺ—Ė—Ē–ľ —É—ā–≤–ĺ—Ä—é—é—ā—Ć—Ā—Ź –į–Ľ—é–ľ–ĺ—Ā–ł–Ľ—Ė–ļ–į—ā–ł. –í—Ė–ī–ĺ–ľ–ĺ –Ņ–ĺ–Ĺ–į–ī 400 –ľ—Ė–Ĺ–Ķ—Ä–į–Ľ—Ė–≤, —Č–ĺ –ľ—Ė—Ā—ā—Ź—ā—Ć –°–ł–Ľ—Ė—Ü—Ė–Ļ. –Ě–į–Ļ–≤–į–∂–Ľ–ł–≤—Ė—ą—Ė –ľ—Ė–Ĺ–Ķ—Ä–į–Ľ–ł –°–ł–Ľ—Ė—Ü—Ė—é ‚ÄĒ —Ā–ł–Ľ—Ė–ļ–į—ā–ł, –ļ—Ä–Ķ–ľ–Ĺ–Ķ–∑–Ķ–ľ. –Ě–į –ļ—Ä–Ķ–ľ–Ĺ—Ė—é –≤–ł–≥–ĺ—ā–ĺ–≤–Ľ—Ź—é—ā—Ć –Ī—Ė–Ľ—Ć—ą—Ė—Ā—ā—Ć —Ė–Ĺ—ā–Ķ–≥—Ä–į–Ľ—Ć–Ĺ–ł—Ö —Ā—Ö–Ķ–ľ. –§–ĺ—Ā—Ą–ĺ—Ä –§–ĺ—Ā—Ą–ĺ—Ä (P) ‚ÄĒ —Ö—Ė–ľ—Ė—á–Ĺ–ł–Ļ –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā 15-—ó –≥—Ä—É–Ņ–ł (–Ņ–ĺ –∑–į—Ā—ā–į—Ä—Ė–Ľ–ĺ—ó –ļ–Ľ–į—Ā–ł—Ą—Ė–ļ–į—Ü—Ė—ó ‚ÄĒ –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ—ó –Ņ—Ė–ī–≥—Ä—É–Ņ–ł –Ņ'—Ź—ā–ĺ—ó –≥—Ä—É–Ņ–ł) —ā—Ä–Ķ—ā—Ć–ĺ–≥–ĺ –Ņ–Ķ—Ä—Ė–ĺ–ī—É –Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ĺ—ó —Ā–ł—Ā—ā–Ķ–ľ–ł; –Ĺ–Ķ–ľ–Ķ—ā–į–Ľ; –ľ–į—Ē –į—ā–ĺ–ľ–Ĺ–ł–Ļ –Ĺ–ĺ–ľ–Ķ—Ä 15. –ě–ī–ł–Ĺ –∑ –Ņ–ĺ—ą–ł—Ä–Ķ–Ĺ–ł—Ö –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤ –∑–Ķ–ľ–Ĺ–ĺ—ó –ļ–ĺ—Ä–ł: –Ļ–ĺ–≥–ĺ –∑–ľ—Ė—Ā—ā —Ā—ā–į–Ĺ–ĺ–≤–ł—ā—Ć 0,08-0,09% —ó—ó –ľ–į—Ā–ł. –ö–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü—Ė—Ź —É –ľ–ĺ—Ä—Ā—Ć–ļ—Ė–Ļ –≤–ĺ–ī—Ė 0,07 –ľ–≥/–Ľ[1]. –£ –≤—Ė–Ľ—Ć–Ĺ–ĺ–ľ—É —Ā—ā–į–Ĺ—Ė –Ĺ–Ķ –∑—É—Ā—ā—Ä—Ė—á–į—Ē—ā—Ć—Ā—Ź —á–Ķ—Ä–Ķ–∑ –≤–ł—Ā–ĺ–ļ—É —Ö—Ė–ľ—Ė—á–Ĺ—É –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć. –£—ā–≤–ĺ—Ä—é—Ē –Ī–Ľ–ł–∑—Ć–ļ–ĺ 190 –ľ—Ė–Ĺ–Ķ—Ä–į–Ľ—Ė–≤, –Ĺ–į–Ļ–≤–į–∂–Ľ–ł–≤—Ė—ą–ł–ľ–ł –∑ —Ź–ļ–ł—Ö —Ē –į–Ņ–į—ā–ł—ā Ca 5 (PO 4 ) 3 (F, Cl, OH), —Ą–ĺ—Ā—Ą–ĺ—Ä–ł—ā —ā–į —Ė–Ĺ—ą—Ė. –§–ĺ—Ā—Ą–ĺ—Ä –ľ—Ė—Ā—ā–ł—ā—Ć—Ā—Ź —É –≤—Ā—Ė—Ö —á–į—Ā—ā–ł–Ĺ–į—Ö –∑–Ķ–Ľ–Ķ–Ĺ–ł—Ö —Ä–ĺ—Ā–Ľ–ł–Ĺ, —Č–Ķ –Ī—Ė–Ľ—Ć—ą–Ķ –Ļ–ĺ–≥–ĺ –≤ –Ņ–Ľ–ĺ–ī–į—Ö —Ė –Ĺ–į—Ā—Ė–Ĺ–Ĺ—Ė (–ī–ł–≤. —Ą–ĺ—Ā—Ą–ĺ–Ľ—Ė–Ņ—Ė–ī–ł). –ú—Ė—Ā—ā–ł—ā—Ć—Ā—Ź –≤ —ā–ļ–į–Ĺ–ł–Ĺ–į—Ö —ā–≤–į—Ä–ł–Ĺ, –≤—Ö–ĺ–ī–ł—ā—Ć –ī–ĺ —Ā–ļ–Ľ–į–ī—É –Ī—Ė–Ľ–ļ—Ė–≤ —ā–į —Ė–Ĺ—ą–ł—Ö –Ĺ–į–Ļ–≤–į–∂–Ľ–ł–≤—Ė—ą–ł—Ö –ĺ—Ä–≥–į–Ĺ—Ė—á–Ĺ–ł—Ö —Ā–Ņ–ĺ–Ľ—É–ļ (–ź–Ę–§, –Ē–Ě–ö), —Ē –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā–ĺ–ľ –∂–ł—ā—ā—Ź. –°—Ė—Ä–ļ–į –°—Ė—Ä–ļ–į (S) ‚ÄĒ —Ö—Ė–ľ—Ė—á–Ĺ–ł–Ļ –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā VI –≥—Ä—É–Ņ–ł –Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ĺ—ó —Ā–ł—Ā—ā–Ķ–ľ–ł –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤, –Ĺ–Ķ–ľ–Ķ—ā–į–Ľ, –į—ā–ĺ–ľ–ĺ–≤–į –≤–į–≥–į 32,064; –Ĺ–Ķ–ľ–Ķ—ā–į–Ľ; –∂–ĺ–≤—ā–į –ļ—Ä–ł—Ā—ā–į–Ľ—Ė—á–Ĺ–į —Ä–Ķ—á–ĺ–≤–ł–Ĺ–į. –Ē–ĺ—Ā–ł—ā—Ć –Ņ–ĺ—ą–ł—Ä–Ķ–Ĺ–ł–Ļ –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā, –Ĺ–į –Ĺ–Ķ—ó –Ņ—Ä–ł–Ņ–į–ī–į—Ē –Ī–Ľ–ł–∑—Ć–ļ–ĺ 0,1% –ľ–į—Ā–ł –∑–Ķ–ľ–Ĺ–ĺ—ó –ļ–ĺ—Ä–ł. –£ –Ņ—Ä–ł—Ä–ĺ–ī—Ė –≤–ĺ–Ĺ–į –∑—É—Ā—ā—Ä—Ė—á–į—Ē—ā—Ć—Ā—Ź —Ź–ļ —É –≤—Ė–Ľ—Ć–Ĺ–ĺ–ľ—É —Ā—ā–į–Ĺ—Ė ‚ÄĒ —ā–į–ļ –∑–≤–į–Ĺ–į —Ā–į–ľ–ĺ—Ä–ĺ–ī–Ĺ–į —Ā—Ė—Ä–ļ–į, –į–Ľ–Ķ –∑–Ĺ–į—á–Ĺ–ĺ —á–į—Ā—ā—Ė—ą–Ķ —Ā—Ė—Ä–ļ–į –∑—É—Ā—ā—Ä—Ė—á–į—Ē—ā—Ć—Ā—Ź —É –∑–≤'—Ź–∑–į–Ĺ–ĺ–ľ—É –≤–ł–≥–Ľ—Ź–ī—Ė, —ā–ĺ–Ī—ā–ĺ —É –≤–ł–≥–Ľ—Ź–ī—Ė —Ä—Ė–∑–Ĺ–ł—Ö —Ā–Ņ–ĺ–Ľ—É–ļ. –Ě–į–Ļ–≤–į–∂–Ľ–ł–≤—Ė—ą—Ė –∑ –Ĺ–ł—Ö ‚ÄĒ –∑–į–Ľ—Ė–∑–Ĺ–ł–Ļ –ļ–ĺ–Ľ—á–Ķ–ī–į–Ĺ, –į–Ī–ĺ –Ņ—Ė—Ä–ł—ā FeS2, —Ü–ł–Ĺ–ļ–ĺ–≤–į –ĺ–Ī–ľ–į–Ĺ–ļ–į ZnS, —Ā–≤–ł–Ĺ—Ü–Ķ–≤–ł–Ļ –Ī–Ľ–ł—Ā–ļ PbS, –ľ—Ė–ī–Ĺ–ł–Ļ –Ī–Ľ–ł—Ā–ļ Cu2S, –≥—Ė–Ņ—Ā CaSO4 ¬∑ 2H2O, –ľ—Ė—Ä–į–Ī—Ė–Ľ—Ė—ā Na2SO4 ¬∑ 10H2O —ā–ĺ—Č–ĺ. –£ –Ĺ–Ķ–≤–Ķ–Ľ–ł–ļ–ł—Ö –ļ—Ė–Ľ—Ć–ļ–ĺ—Ā—ā—Ź—Ö —Ā—Ė—Ä–ļ–į –ľ—Ė—Ā—ā–ł—ā—Ć—Ā—Ź –≤ –ļ–į–ľ'—Ź–Ĺ–ĺ–ľ—É –≤—É–≥—Ė–Ľ–Ľ—Ė —Ė –Ĺ–į—Ą—ā—Ė, –į —ā–į–ļ–ĺ–∂ –≤ —É—Ā—Ė—Ö —Ä–ĺ—Ā–Ľ–ł–Ĺ–Ĺ–ł—Ö —Ė —ā–≤–į—Ä–ł–Ĺ–Ĺ–ł—Ö –ĺ—Ä–≥–į–Ĺ—Ė–∑–ľ–į—Ö, –ĺ—Ā–ļ—Ė–Ľ—Ć–ļ–ł –≤–ĺ–Ĺ–į –≤—Ö–ĺ–ī–ł—ā—Ć –ī–ĺ —Ā–ļ–Ľ–į–ī—É –Ī—Ė–Ľ–ļ—Ė–≤. –ó–Ĺ–į–Ļ–ī–Ķ–Ĺ–į —É –ī–≤–ĺ—Ö –į–ľ—Ė–Ĺ–ĺ–ļ–ł—Ā–Ľ–ĺ—ā–į—Ö: —Ü–ł—Ā—ā–Ķ—ó–Ĺ—Ė —ā–į –ľ–Ķ—ā—Ė–ĺ–Ĺ—Ė–Ĺ—Ė. –°—Ė—Ä–ļ—É –∑–į—Ā—ā–ĺ—Ā–ĺ–≤—É—é—ā—Ć –Ņ–Ķ—Ä–Ķ–≤–į–∂–Ĺ–ĺ —É —Ö—Ė–ľ—Ė—á–Ĺ—Ė–Ļ –Ņ—Ä–ĺ–ľ–ł—Ā–Ľ–ĺ–≤–ĺ—Ā—ā—Ė –ī–Ľ—Ź –≤–ł—Ä–ĺ–Ī–Ĺ–ł—Ü—ā–≤–į —Ā—Ė—Ä—á–į–Ĺ–ĺ—ó –ļ–ł—Ā–Ľ–ĺ—ā–ł, —Ā–ł–Ĺ—ā–Ķ—ā–ł—á–Ĺ–ĺ–≥–ĺ –≤–ĺ–Ľ–ĺ–ļ–Ĺ–į, —Ā—Ė—Ä—á–ł—Ā—ā–ł—Ö –Ī–į—Ä–≤–Ĺ–ł–ļ—Ė–≤, –ī–ł–ľ–Ĺ–ĺ–≥–ĺ –Ņ–ĺ—Ä–ĺ—Ö—É, —É “Ď—É–ľ–ĺ–≤—Ė–Ļ –Ņ—Ä–ĺ–ľ–ł—Ā–Ľ–ĺ–≤–ĺ—Ā—ā—Ė, —ā–į–ļ–ĺ–∂ —É —Ā—Ė–Ľ—Ć—Ā—Ć–ļ–ĺ–ľ—É –≥–ĺ—Ā–Ņ–ĺ–ī–į—Ä—Ā—ā–≤—Ė, —Ą–į—Ä–ľ–į—Ü–Ķ–≤—ā–ł—Ü—Ė —ā–ĺ—Č–ĺ. –•–Ľ–ĺ—Ä –•–Ľ–ĺ—Ä (Cl) ‚ÄĒ –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā 17-—ó –≥—Ä—É–Ņ–ł –Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ĺ—ó —ā–į–Ī–Ľ–ł—Ü—Ė —Ö—Ė–ľ—Ė—á–Ĺ–ł—Ö –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤ (–∑–į –∑–į—Ā—ā–į—Ä—Ė–Ľ–ĺ—é –ļ–Ľ–į—Ā–ł—Ą—Ė–ļ–į—Ü—Ė—Ē—é ‚ÄĒ –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā –≥–ĺ–Ľ–ĺ–≤–Ĺ–ĺ—ó –Ņ—Ė–ī–≥—Ä—É–Ņ–ł VII –≥—Ä—É–Ņ–ł) –∑ –į—ā–ĺ–ľ–Ĺ–ł–ľ –Ĺ–ĺ–ľ–Ķ—Ä–ĺ–ľ 17[2]. –ü–ĺ–∑–Ĺ–į—á–į—Ē—ā—Ć—Ā—Ź —Ā–ł–ľ–≤–ĺ–Ľ–ĺ–ľ Cl (–Ľ–į—ā. Chlorum). –•—Ė–ľ—Ė—á–Ĺ–ĺ –į–ļ—ā–ł–≤–Ĺ–ł–Ļ –Ĺ–Ķ–ľ–Ķ—ā–į–Ľ. –í—Ö–ĺ–ī–ł—ā—Ć —É –≥—Ä—É–Ņ—É –≥–į–Ľ–ĺ–≥–Ķ–Ĺ—Ė–≤ (—Ā–Ņ–ĺ—á–į—ā–ļ—É –Ĺ–į–∑–≤—É ¬ę–≥–į–Ľ–ĺ–≥–Ķ–ŬĽ –≤–ł–ļ–ĺ—Ä–ł—Ā—ā–ĺ–≤—É–≤–į–≤ –Ĺ—Ė–ľ–Ķ—Ü—Ć–ļ–ł–Ļ —Ö—Ė–ľ—Ė–ļ –®–≤–Ķ–Ļ–≥–Ķ—Ä –ī–Ľ—Ź —Ö–Ľ–ĺ—Ä—É [–ī–ĺ—Ā–Ľ—Ė–≤–Ĺ–ĺ ¬ę–≥–į–Ľ–ĺ–≥–Ķ–ŬĽ –Ņ–Ķ—Ä–Ķ–ļ–Ľ–į–ī–į—Ē—ā—Ć—Ā—Ź —Ź–ļ —Ā–ĺ–Ľ–Ķ—Ä—Ė–ī], –į–Ľ–Ķ –≤–ĺ–Ĺ–ĺ –Ĺ–Ķ –Ņ—Ä–ł–∂–ł–Ľ–ĺ—Ā—Ź, —Ė –∑–≥–ĺ–ī–ĺ–ľ —Ā—ā–į–Ľ–ĺ –∑–į–≥–į–Ľ—Ć–Ĺ–ł–ľ –ī–Ľ—Ź VII –≥—Ä—É–Ņ–ł –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤, —É —Ź–ļ—É –≤—Ö–ĺ–ī–ł—ā—Ć —Ė —Ö–Ľ–ĺ—Ä[3]). –ü—Ä–ĺ—Ā—ā–į —Ä–Ķ—á–ĺ–≤–ł–Ĺ–į —Ö–Ľ–ĺ—Ä (CAS-–Ĺ–ĺ–ľ–Ķ—Ä: 7782-50-5) –∑–į –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ–ł—Ö —É–ľ–ĺ–≤–į—Ö ‚ÄĒ –ĺ—ā—Ä—É–Ļ–Ĺ–ł–Ļ –≥–į–∑ –∂–ĺ–≤—ā—É–≤–į—ā–ĺ-–∑–Ķ–Ľ–Ķ–Ĺ–ĺ–≥–ĺ –ļ–ĺ–Ľ—Ć–ĺ—Ä—É –≤–į–∂—á–ł–Ļ –∑–į –Ņ–ĺ–≤—Ė—ā—Ä—Ź, –∑ —Ä—Ė–∑–ļ–ł–ľ –∑–į–Ņ–į—Ö–ĺ–ľ. –ú–ĺ–Ľ–Ķ–ļ—É–Ľ–į —Ö–Ľ–ĺ—Ä—É –ī–≤–ĺ–į—ā–ĺ–ľ–Ĺ–į (—Ą–ĺ—Ä–ľ—É–Ľ–į Cl 2). –í–ł–ļ–ĺ—Ä–ł—Ā—ā–ĺ–≤—É—Ē—ā—Ć—Ā—Ź —Ź–ļ –ī–Ķ–∑–ł–Ĺ—Ą—Ė–ļ—É—é—á–ł–Ļ –∑–į—Ā—Ė–Ī, –ĺ—Ā–ĺ–Ī–Ľ–ł–≤–ĺ —É –Ņ–Ľ–į–≤–į–Ľ—Ć–Ĺ–ł—Ö –Ī–į—Ā–Ķ–Ļ–Ĺ–į—Ö.
–ź—Ä–≥–ĺ–Ĺ –ź—Ä–≥–ĺ–Ĺ (Ar) —Ē —Ė–Ĺ–Ķ—Ä—ā–Ĺ–ł–ľ –≥–į–∑–ĺ–ľ, —Č–ĺ —Ä–ĺ–Ī–ł—ā—Ć –Ļ–ĺ–≥–ĺ –ľ–į–Ļ–∂–Ķ –Ņ–ĺ–≤–Ĺ—Ė—Ā—ā—é –Ĺ–Ķ—Ä–Ķ–į–ļ—Ü—Ė–ĺ–Ĺ–Ĺ–ĺ—Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ł–ľ. –õ–į–ľ–Ņ–ł —Ä–ĺ–∑–∂–į—Ä—é–≤–į–Ĺ–Ĺ—Ź —á–į—Ā—ā–ĺ –∑–į–Ņ–ĺ–≤–Ĺ—é—é—ā—Ć —Ė–Ĺ–Ķ—Ä—ā–Ĺ–ł–ľ–ł –≥–į–∑–į–ľ–ł, —É —ā–ĺ–ľ—É —á–ł—Ā–Ľ—Ė —Ė –į—Ä–≥–ĺ–Ĺ–ĺ–ľ, —Č–ĺ –ĺ–Ī–Ķ—Ä—Ė–≥–į—Ē –Ĺ–ł—ā–ļ–ł –≤—Ė–ī –Ņ–Ķ—Ä–Ķ–≥–ĺ—Ä–į–Ĺ–Ĺ—Ź –Ņ—Ä–ł –≤–ł—Ā–ĺ–ļ–ł—Ö —ā–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–į—Ö. —Ö—Ė–ľ—Ė—á–Ĺ–ł–Ļ –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā –∑ –į—ā–ĺ–ľ–Ĺ–ł–ľ –Ĺ–ĺ–ľ–Ķ—Ä–ĺ–ľ 18, –į —ā–į–ļ–ĺ–∂ –Ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ā—ā–į —Ä–Ķ—á–ĺ–≤–ł–Ĺ–į, —Ė–Ĺ–Ķ—Ä—ā–Ĺ–ł–Ļ –≥–į–∑, –Ī–Ķ–∑ –ļ–ĺ–Ľ—Ć–ĺ—Ä—É —Ė –∑–į–Ņ–į—Ö—É. –í–≤–į–∂–į—Ē—ā—Ć—Ā—Ź, —Č–ĺ –≤—Ė–Ĺ –Ĺ–Ķ –≤—Ā—ā—É–Ņ–į—Ē –≤ —Ä–Ķ–į–ļ—Ü—Ė—ó –∑ —Ė–Ĺ—ą–ł–ľ–ł –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā–į–ľ–ł, –Ņ—Ä–ĺ—ā–Ķ –Ĺ–Ķ–ī–į–≤–Ĺ–ĺ –≤—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ, —Č–ĺ –≤—Ė–Ĺ –ľ–ĺ–∂–Ķ –∑'—Ē–ī–Ĺ—É–≤–į—ā–ł—Ā—Ź –∑ —Ą—ā–ĺ—Ä–ł–ī–ĺ–ľ –Ī–ĺ—Ä—É. –ú—Ė—Ā—ā–ł—ā—Ć—Ā—Ź –≤ –į—ā–ľ–ĺ—Ā—Ą–Ķ—Ä—Ė –ó–Ķ–ľ–Ľ—Ė (1 %). –í—Ė–ī–Ĺ–ĺ—Ā–ł—ā—Ć—Ā—Ź –ī–ĺ –Ĺ—É–Ľ—Ć–ĺ–≤–ĺ—ó –≥—Ä—É–Ņ–ł –Ņ–Ķ—Ä—Ė–ĺ–ī–ł—á–Ĺ–ĺ—ó —Ā–ł—Ā—ā–Ķ–ľ–ł –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā—Ė–≤, –į—ā–ĺ–ľ–Ĺ–į –≤–į–≥–į 39,944. –ü—Ä–ł—Ä–ĺ–ī–Ĺ–ł–Ļ –į—Ä–≥–ĺ–Ĺ —Ā–ļ–Ľ–į–ī–į—Ē—ā—Ć—Ā—Ź –∑ —Ė–∑–ĺ—ā–ĺ–Ņ—Ė–≤ 36Ar (0,337%). 38Ar (0,063%), 40Ar (99,600%); —ą—ā—É—á–Ĺ–ĺ –ĺ–ī–Ķ—Ä–∂–į–Ĺ–ĺ —Ä–į–ī—Ė–ĺ–į–ļ—ā–ł–≤–Ĺ—Ė —Ė–∑–ĺ—ā–ĺ–Ņ–ł 35Ar, 37Ar —Ė 41Ar. –ź—Ä–≥–ĺ–Ĺ ‚ÄĒ –Ī–Ķ–∑–ļ–ĺ–Ľ—Ė—Ä–Ĺ–ł–Ļ, –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł –Ļ–ĺ–≥–ĺ –ĺ–ī–Ĺ–ĺ–į—ā–ĺ–ľ–Ĺ—Ė; t¬į –ļ–ł–Ņ. ‚ÄĒ 185,83 ¬įC, t¬į –Ņ–Ľ–į–≤.‚ÄĒ 189,3 ¬įC, –ļ—Ä–ł—ā–ł—á–Ĺ–į —ā–Ķ–ľ–Ņ–Ķ—Ä–į—ā—É—Ä–į ‚ÄĒ 122,4 ¬įC; –ļ—Ä–ł—ā–ł—á–Ĺ–ł–Ļ —ā–ł—Ā–ļ ‚ÄĒ 48 –į—ā–ľ. –í –Ņ—Ä–ł—Ä–ĺ–ī—Ė –į—Ä–≥–ĺ–Ĺ –∑—É—Ā—ā—Ä—Ė—á–į—Ē—ā—Ć—Ā—Ź –Ľ–ł—ą–Ķ —É –≤—Ė–Ľ—Ć–Ĺ–ĺ–ľ—É —Ā—ā–į–Ĺ—Ė —Ė —Ā—ā–į–Ĺ–ĺ–≤–ł—ā—Ć 0,933% (–∑–į –ĺ–Ī'—Ē–ľ–ĺ–ľ) –Ņ–ĺ–≤—Ė—ā—Ä—Ź, –∑ —Ź–ļ–ĺ–≥–ĺ –≤–Ņ–Ķ—Ä—ą–Ķ –Ļ–ĺ–≥–ĺ –≤–ł–ī—Ė–Ľ–ł–Ľ–ł —É 1894 —Ä–ĺ—Ü—Ė –£. –†–į–ľ–∑–į–Ļ —Ė –Ē–∂. –†–Ķ–Ľ–Ķ–Ļ. –£ –Ņ—Ä–ĺ–ľ–ł—Ā–Ľ–ĺ–≤–ĺ—Ā—ā—Ė –į—Ä–≥–ĺ–Ĺ –ī–ĺ–Ī—É–≤–į—é—ā—Ć —Ą—Ä–į–ļ—Ü—Ė–ĺ–Ĺ—É–≤–į–Ĺ–Ĺ—Ź–ľ —Ä—Ė–ī–ļ–ĺ–≥–ĺ –Ņ–ĺ–≤—Ė—ā—Ä—Ź. –ü—Ä–ł–ľ—Ė—ā–ļ–ł
–õ—Ė—ā–Ķ—Ä–į—ā—É—Ä–į
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia