「
氧化硼 」重定向至此。關於硼的其他氧化物,請見「
一氧化二硼 」。
三氧化二硼 (化学式 :B2 O3 )又称氧化硼 ,是硼 最主要的氧化物 。它是一种白色蜡状固体,一般以无定形 的状态存在,很难形成晶体 ,但在高强度退火 后也能结晶。它是已知的最难结晶的物质之一。
玻璃状氧化硼(g-B2 O3 )很可能是一种由许多三角形BO3 单元通过共用氧原子部分有序连接而成的网络结构,其中以硼氧相间的六元环B3 O3 占优势。该六元环中,硼原子为三配位,氧原子为二配位。[ 1] [ 2] 2 O3 单体组成,其结构为角形的 O=B-O-B=O。
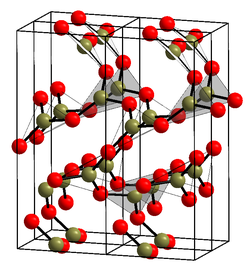
常压下使液态的氧化硼在200-250 °C范围内结晶,可以形成普通的六方晶系 氧化硼(α-B2 O3 ),其结构(见右图)[ 3] 3 单元组成。
在22000atm和400 °C时,α-B2 O3 转变为高温高压型的单斜晶体 β-B2 O3 。[ 4] 石英 在高压下到柯石英 的转化。除此之外,β-B2 O3 也可以由液态氧化硼在40000atm和600 °C时结晶得到。
β-B2 O3 的体积模量 很大(K = 180 GPa)。g-B2 O3 和β-B2 O3 的维氏硬度 分别为1.5GPa和16GPa。[ 5]
虽然硼在空气和氧气中燃烧都可以直接产生三氧化二硼,但三氧化二硼主要是通过硼酸 脱水 制取的。在200-400 °C对硼酸真空脱水,可以得到非常干燥的三氧化二硼。如果在大气中脱水,即使加热到1000 °C,也很难去除最后剩下的痕量水。
H
3
B
O
3
→
H
B
O
2
+
H
2
O
{\displaystyle {\rm {H_{3}BO_{3}\rightarrow HBO_{2}+H_{2}O\,}}}
2
H
B
O
2
→
B
2
O
3
+
H
2
O
{\displaystyle {\rm {2HBO_{2}\rightarrow B_{2}O_{3}+H_{2}O\,}}}
硼酸则可通过硼砂 和硫酸 共热反应制取。[ 6] [ 5]
氧化硼是酸性氧化物 ,熔融时可以溶解许多碱性的金属 氧化物 ,生成有特征颜色的玻璃状硼酸盐 和偏硼酸盐 (玻璃)。这是硼砂珠试验 定性鉴别金属的原理。例如:
C
u
O
+
B
2
O
3
→
C
u
(
B
O
2
)
2
{\displaystyle {\rm {CuO+B_{2}O_{3}\rightarrow Cu(BO_{2})_{2}\,}}}
F
e
2
O
3
+
3
B
2
O
3
→
2
F
e
(
B
O
2
)
3
{\displaystyle {\rm {Fe_{2}O_{3}+3B_{2}O_{3}\rightarrow 2Fe(BO_{2})_{3}\,}}}
氧化硼可以被碱金属 、铝 和镁 还原为单质硼 :
B
2
O
3
+
3
M
g
→
2
B
+
3
M
g
O
{\displaystyle {\rm {B_{2}O_{3}+3Mg\rightarrow 2B+3MgO\,}}}
反应后用盐酸 处理反应混合物,MgO、B2 O3 和Mg溶于盐酸,过滤后得到粗硼。氧化硼在高温时不能为碳 还原(高温下可以形成碳化硼 )。高温下氧化硼与碳和氯气 反应,可以得到三氯化硼 :
B
2
O
3
+
3
C
+
3
C
l
2
→
2
B
C
l
3
+
3
C
O
{\displaystyle {\rm {B_{2}O_{3}+3C+3Cl_{2}\rightarrow 2BCl_{3}+3CO\,}}}
600 °C时,氧化硼与氨 反应可以得到氮化硼 (BN),与氢化钙 反应则得到六硼化钙 (CaB6 )。
氧化硼是硼酸 的酸酐 ,溶于水时会放出大量热生成偏硼酸 和硼酸 :
B
2
O
3
(
s
)
+
H
2
O
(
g
)
→
2
H
B
O
2
(
g
)
{\displaystyle {\rm {B_{2}O_{3}(s)+H_{2}O(g)\rightarrow 2HBO_{2}(g)\,}}}
Δ
H
o
=
−
199.2
k
J
/
m
o
l
{\displaystyle {\rm {\Delta H^{o}=-199.2kJ/mol\,}}}
B
2
O
3
+
3
H
2
O
→
2
H
3
B
O
3
{\displaystyle {\rm {B_{2}O_{3}+3H_{2}O\rightarrow 2H_{3}BO_{3}\,}}}
氧化硼可以用作:
^ Eckert, H. Prog. NMR Spectrosc. , 24 (1992) 159-293.
^ S.-J. Hwang, C. Femandez, J.P. Amoureux, J. Cho, S.W. Martin & M. Pruski. "Quantitative study of the short range order in B,O, and B,S, by MAS and two-dimensional triple-quantum MAS 11 B NMR" Solid State Nuclear Magnetic Resonance 8 (1997) 109-121
^ G.E. Gurr, P.W. Montgomery, C.D. Knutson, B.T.Gorres "The Crystal Structure of Trigonal Diboron Trioxide" Acta Cryst. B26 (1970) 906-915
^ V. V. Brazhkin et al. "Structural transformations in liquid, crystalline and glassy B2 O3 under high pressure" JETPh Lett. 78 (2003) 845 (页面存档备份 ,存于互联网档案馆 )
^ 5.0 5.1 V. A. Mukhanov, O. O. Kurakevich, and V. L. Solozhenko "On the Hardness of Boron (III) Oxide" of Superhard Materials 30 (2008) 71
^ Pradyot Patnaik. Handbook of Inorganic Chemicals . McGraw-Hill, 2002, ISBN 0-07-049439-8