Формула Рыдберга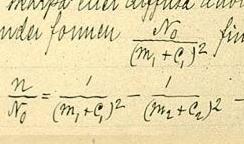 Формула Рыдберга — эмпірычная формула, якая апісвае даўжыні хваль у спектрах выпраменьвання атамаў хімічных элементаў. Прапанавана шведскім навукоўцам Ёханесам Рыдбергам і прадстаўлена 5 лістапада 1888 года. Формула Рыдберга для вадародападобных элементаў выглядае наступным чынам: дзе
ГісторыяУ 1880-х гадах, Рыдберг працаваў над формулай, якая апісвала б узаемасувязь паміж даўжынямі хваль у спектрах шчолачных металаў. Ён заўважыў, што лініі ўтвараюць серыі, і ён выявіў, што можа паменшыць працаёмкасць сваіх разлікаў, выкарыстоўваючы хвалевы лік (велічыня, роўная 1/λ, адваротная даўжыні хвалі) у якасці адзінкі вымярэння. Ён запісаў хвалевыя лікі (n) паслядоўных ліній у кожнай серыі насупраць размешчаных паралельна ў адпаведным парадку цэлых лікаў, якія прадстаўлялі сабой парадак лініі ў дадзенай канкрэтнай серыі. Выявіўшы, што атрыманыя крывыя мелі падобныя формы, ён знайшоў адзіную функцыю, якая апісвае ўсе гэтыя крывыя, пры падстаноўцы ў яе адпаведных канстант. Спачатку ён праверыў формулу: , дзе n — гэта хвалевы лік лініі, n0 — мяжа серыі, m — парадкавы нумар лініі ў серыі (канстанта, розная для розных серый) і C0 — універсальная канстанта. Гэтая формула не працавала дастаткова добра. Рыдберг праверыў: , калі яму стала вядомая формула Бальмера для спектра атама вадароду . у гэтай формуле, m — целы, і h — канстанта. Рыдберг, аднак, перапісаў формулу Бальмера, выкарыстоўваючы абазначэнні хвалевых лікаў, у наступным выглядзе . Гэта падказала, што формула Бальмера для вадароду можа з’яўляцца асобным выпадкам пры і , дзе адваротная канстанце Бальмера. Велічыня Co, як аказалася, была ўніверсальнай канстантай, агульнай для ўсіх элементаў, роўнай 4/h. Гэтая канстанта зараз вядомая як пастаянная Рыдберга, і m' вядомая як квантавы дэфект. Як падкрэсліў Нільс Бор[1], выраз вынікаў праз хвалевыя лікі, а не праз даўжыні хваль, быў ключом да адкрыцця Рыдберга. Фундаментальная роля хвалевых лікаў была асабліва падкрэслена адкрыццём камбінацыйнага прынцыпу Рыдберга—Рытца ў 1908 годзе. Фундаментальная прычына гэтага ляжыць у вобласці квантавай механікі. Хвалевыя лікі светлавых хваль прапарцыянальныя частаце , і таму таксама прапарцыянальныя энергіі квантаў святла E. Гэта значыць, . Сучаснае разуменне заключаецца ў тым, што графікі Рыдберга былі спрошчанымі (валодалі невысокай ступенню адэкватнасці рэальным залежнасцям), бо адлюстроўвалі толькі простыя ўласцівасці ў паводзінах спектральных ліній ва ўмовах строга вызначаных (квантаваных) рознасцей энергій паміж электроннымі арбіталямі ў атаме. Класічны выраз Рыдберга (ад 1888) для формы спектральных серый не суправаджаўся фізічным тлумачэннем. Даквантавае тлумачэнне Рытца (1908) механізму «ўтварэння» спектральных серый заключалася ў тым, што электроны ў атаме паводзяць сябе як магніты, і што магніты могуць вагацца адносна атамнага ядра (па меншай меры часова), генеруючы электрамагнітнае выпраменьванне[2]. Гэты феномен упершыню быў зразуметы Нільсам Борам ў 1913 годзе так, як ён уключаны ў Бораўскую мадэль атама. У тэорыі атама вадароду па Бору цэлыя лікі Рыдберга (і Бальмера) n адпавядаюць электронным арбіталям на розных строга вызначаных адлегласцях ад атама. Таму частата (або спектральная энергія), атрыманая пры пераходзе з n1 на n2, прадстаўляе сабой энергію фатона, выпрамененага ці паглынутага, калі электрон «пераскоквае» з арбіталі 1 на арбіталь 2. Формула Рыдберга для вадародудзе
Прымаючы роўным 1, і мяркуючы, што можа прымаць цэлыя значэнні ад 2 да бесканечнасці, атрымліваем спектральныя лініі, вядомыя як серыя Лаймана, ніжняя мяжа даўжынь хваль якіх імкнецца да 91 нм. Аналагічна атрымаем і іншыя серыі:
Формула Рыдберга для любых вадародападобных іонаўФормула для атама вадароду, прыведзеная вышэй, можа быць дапоўнена для прымянення да любых вадародападобных атамаў: дзе
Важна заўважыць, што гэтая формула падыходзіць толькі для вадародападобных атамаў, гэта значыць для такіх атамаў, якія ўтрымліваюць у электроннай абалонцы адзін і толькі адзін электрон. Да такіх атамаў адносяцца, напрыклад, He+, Li2+, Be3+ і г. д. Формула Рыдберга дазваляе атрымліваць карэктныя значэнні даўжынь хваль для аддаленых электронаў, калі эфектыўны зарад ядра можна лічыць такім жа як і ў вадароду, калі ўсе, акрамя аднаго, зарады ў ядры экранаваныя іншымі электронамі, і цэнтр атама мае эфектыўны дадатны зарад, роўны +1. Пры пэўнай змене (замене Z на Z-1, і выкарыстанні цэлых лікаў 1 і 2 для n, якія даюць лікавае значэнне 3⁄4 для рознасці іх адваротных квадратаў (у формуле вышэй)), формула Рыдберга дае карэктныя вынікі ў спецыяльным выпадку K-альфа ліній, падобныя пераходы з’яўляюцца K-альфа пераходам электрона з арбіталі 1s на арбіталь 2p. Гэта аналагічна пераходу, які адпавядае Лаймана-альфа лініі для вадароду, і мае той жа самы частотны фактар. Паколькі 2p-электрон не экранаваны ад ядра ў атаме ніякімі іншымі электронамі, то зарад ядра аслаблены адзіным 1s-электронам, які застаецца, вымушаючы атам быць фактычна вадародаподабным атамам, але з аслабленым зарадам Z-1. Яго частата, такім чынам, з’яўляецца частатой Лайман-альфа вадароду, узрастаючы, дзякуючы велічыні (Z-1)². Гэтая формула f = c/λ = (Лайман-альфа частата) ⋅ (Z-1)² гістарычна вядомы як закон Мозлі (дадаючы велічыню c для замены ў формуле даўжыні хвалі на частату), і можа быць выкарыстана для прадказанні даўжынь хваль Kα (K-альфа) рэнтгенаўскіх прамянёў у спектрах выпраменьвання хімічных элементаў ад алюмінія да золата. Даведацца аб гістарычнай важнасці гэтага закона можна, азнаёміўшыся з біяграфіяй Генры Мозлі. Гэты закон быў атрыманы эмпірычна прыкладна ў той жа час, калі была створана Бораўская мадэль атама. Для іншых спектральных пераходаў у шмат-электронных атамах, формула Рыдберга дае некарэктныя вынікі, паколькі велічыня экранавання ўнутраных электронаў для пераходаў знешніх электронаў вар’іруецца, і няма магчымасці зрабіць у формуле падобную простую «кампенсавальную» «аслабленне дзеяння зарада ядра» папраўку, як паказана вышэй. Гл. таксамаЗноскі
|
Portal di Ensiklopedia Dunia



































