Ацетилен
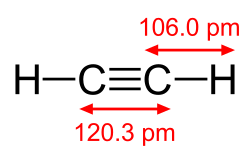
Ацетилен (систематско име: етин) — органско соединение со хемиска формула HC2H и структура H−C≡C−H. Ацетиленот е јаглеводород и претставува наједноставниот алкин.[1] Овој безбоен гас е широко користен како гориво и хемиска градбена материја. Тој е нестабилен во својот чист облик и затоа обично се третира како раствор.[2] Чистиот ацетилен е без мирис, но комерцијалните сорти обично имаат изразен мирис поради нечистотии како што се дивинил сулфид и фосфин.[2][3] Како алкин, ацетиленот е незаситени бидејќи неговите два јаглеродни атоми се сврзани заедно во тројна врска. Тројната врска јаглерод-јаглерод ги поставува сите четири атоми во иста права линија, со агли на врската CCH од 180°.[4] Физички својстваПромена на состојбаНа атмосферски притисок, ацетиленот не може да постои како течност и нема точка на топење. тројната точка на фазен дијаграм одговара на точката на топење (−80,8 °C) при минималниот притисок при кој може да постои течен ацетилен (1,27 атм). На температури под тројната точка, цврстиот ацетилен може директно да се промени во пареа (гас) со сублимација. Точката на сублимација при атмосферски притисок е -84,0 °C.[5] ДругоНа собна температура, растворливоста на ацетилен во ацетон е 27,9 г на кг. За иста количина на диметилформамид, растворливоста е 51 г. На 20,26 бари, растворливоста се зголемува на 689,0 и 628,0 г за ацетон и диметилформамид, редоследно. Овие растворувачи се користени во гасни цилиндри под притисок.[6] РеакцииВинилациски реакцииВо реакциите на винилација, соединенијата на H−X се додадени низ тројната врска. Алкохоли и феноли се додавани во ацетилен за да се добие винил етер. Тиолите даваат винил тиоетери. Слично, винилпиролидон и винилкарбазол се произведувани индустриски со винилација на 2-пиролидон и карбазол.[2][6] Хидратацијата на ацетиленот е реакција на винилација, но добиениот винил алкохол се изомеризира во ацеталдехид. Реакцијата се катализира со соли на жива. Оваа реакција некогаш била најзастапена технологија за производство на ацеталдехид, но таа била поместена од Вакеровата постапка, кој дава ацеталдехид со оксидација на етилен, поевтина суровина. Слична ситуација се однесува на претворањето на ацетилен во вредниот винил хлорид со хидрохлорирање наспроти оксихлорирање на етилен. Винил ацетат е користен наместо ацетилен за некои винилации, кои попрецизно се опишани како трансвинилации.[7] Во синтезата на винил формат се користени повисоки естри на винил ацетат. ЕтинилацијаАцетиленот додава во алдехиди и кетони за да образува α-етинил алкохоли:[2] Реакцијата со формалдехид е користена индустриски во производството на бутинедиол, правејќи пропаргил алкохол како нуспроизвод. Бакар ацетилид е користен како катализатор.[8][9] Бидејќи халогените се додаваат низ тројната врска, заменетите ацетилени дифлуороацетилен, дихлороацетилен, дибромоацетилен и дијодоацетилен не можат да бидат направени директно од ацетилен. Вообичаено решение е да бидат дехидрирани винил дихалоетенолите.[10] КарбонилацијаВалтер Репе открил дека во присуство на катализатори, ацетиленот реагира и дава широк опсег на индустриски значајни хемикалии.[2][11][12] Со јаглерод моноксид, ацетиленот реагира и дава акрилна киселина, или акрилни естри, кои може да бидат користени за производство на акрилно стакло.[13] Органометалска хемискаАцетиленот и неговите деривати (2-бутин, дифенилацетилен, итн.) образуваат комплекси со преодни метали. Неговата врска со металот е нешто слична на онаа на етиленските комплекси. Овие комплекси се посредници во многу каталитички реакции како што се алкинска тримеризација кон бензен, тетрамеризација кон циклооктатетраен,[2] и карбонилација во хидрохинон:[11]
Во присуство на одредени преодни метали, алкините се подложени на алкинска метатеза. Чести се и метални ацетилид, видови со формулата L Киселинско-базни реакцииАцетиленот има pKa од 25, ацетиленот може да биде депротониран со супербаза за да образува ацетилид:[14] Различни органометални[15] и неорганско[16] реагенси се ефикасни. Наводи
Надворешни врски
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia