Група перыядычнай сістэмы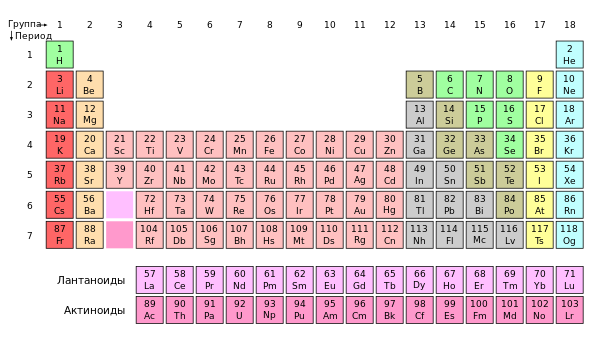 Група перыядычнай сістэмы — паслядоўнасць хімічных элементаў з аднатыпнаю электроннаю будоваю, упарадкаваная па ўзрастанню зараду ядра. Інакш кажучы, група — гэта слупок у перыядычнай табліцы хімічных элементаў. Нумар групы вызначаецца колькасцю электронаў на вонкавай абалонцы атама (валентных электронаў) і, як правіла, адпавядае найвышэйшай валентнасці атама. У кароткаперыядным варыянце перыядычнай сістэмы групы падзяляюцца на падгрупы — галоўныя (ці падгрупы A), якія пачынаюцца з элементаў першага і другога перыядаў, і пабочныя (падгрупы В), якія ўключаюць d-элементы. Падгрупы таксама маюць назвы па элементу з найменшым зарадам ядра (як правіла, па элементу другога перыяду для галоўных падгруп і элементу чацвёртага перыяду для пабочных падгруп). Элементы аднае падгрупы валодаюць падобнымі хімічнымі ўласцівасцямі. З нарастаннем зараду ядра ў элементаў аднае групы з-за павелічэння ліку электронных абалонак павялічваюцца атамныя радыусы, у выніку адбываецца зніжэнне электраадмоўнасці, узмацненне металічных і аслабленне неметалічных уласцівасцей элементаў, узмацненне аднаўленчых і аслабленне акісляльных уласцівасцей утвораных імі рэчываў. Нумарацыя групЗ 1989 года Міжнародны саюз тэарэтычнай і прыкладной хіміі (IUPAC) у якасці асноўнага варыянта перыядычнай сістэмы зацвердзіў доўгаперыядычную форму[1]. У сувязі з гэтым IUPAC рэкамендуе суцэльную нумарацыю груп: арабскімі лічбамі ад 1 да 18. Нягледзячы на гэта, працягваюць ужываць традыцыйныя сістэмы нумарацыі з выкарыстаннем рымскіх лічбаў і лацінскія літары, розныя для Амерыкі і Еўропы. Сучасная сістэма нумарацыі ўтрымлівае наступныя групы (старыя сістэмы, еўрапейская і амерыканская, прыведзены ў дужках):
Зноскі
|
Portal di Ensiklopedia Dunia













