–¢—Ä–æ–≤–∞—ö–µ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º
–¢—Ä–æ–≤–∞—ö–µ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º, –∏–Ω—Ç–æ–∫—Å–∏–∫–∞—Ü–∏—ò–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º, —ò–µ –Ω–µ–∂–µ—ô–µ–Ω–æ-—à—Ç–µ—Ç–Ω–æ –¥–µ—ò—Å—Ç–≤–æ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –∫–æ—ò–∏ –æ–Ω –º–æ–∂–µ –∏–∑–∞–∑–≤–∞—Ç–∏ —É —õ–µ–ª–∏—ò–∞–º–∞ –∏ —Ç–∫–∏–≤–∏–º–∞ –∂–∏–≤–∏—Ö –±–∏—õ–∞. –¢–æ —ò–µ –ø—Ä–∞–≤–∏ –ø–∞—Ä–∞–¥–æ–∫—Å –¥–∞ –∫–∏—Å–µ–æ–Ω–∏–∫ –∫–æ—ò–∏ —ò–µ –Ω–µ–æ–ø—Ö–æ–¥–∞–Ω –∑–∞ –∂–∏–≤–æ—Ç —õ–µ–ª–∏—ò–µ –º–æ–∂–µ –±–∏—Ç–∏ –∏ —ö–µ–Ω –æ—Ç—Ä–æ–≤.[1] –ö–∞–æ —Ä–µ–∑—É–ª—Ç–∞—Ç –¥–∏—Å–∞—ö–∞, –ø–æ–≤–∏—à–µ–Ω–µ –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–µ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É –æ—Ä–≥–∞–Ω–∏–∑–º—É –∂–∏–≤–∏—Ö –±–∏—õ–∞ –Ω–∞—Å—Ç–∞—ò–µ —Ö–∏–ø–µ—Ä–æ–∫—Å–∏—ò–∞, –≤–∏—à–∞–∫ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É —Ç–∫–∏–≤–∏–º–∞. –ò–∞–∫–æ —ò–µ —Ç–µ—Ä–∞–ø–∏—ò–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º –∫–æ—Ä–∏—Å–Ω–∞ —É –º–Ω–æ–≥–∏–º –ø–æ—Ä–µ–º–µ—õ–∞—ò–∏–º–∞-–±–æ–ª–µ—Å—Ç–∏–º–∞, —ö–µ–≥–æ–≤–∞ –Ω–µ–∫–æ–Ω—Ç—Ä–æ–ª–∏—Å–∞–Ω–∞ —É–ø–æ—Ç—Ä–µ–±–∞ –º–æ–∂–µ –¥–æ–≤–µ—Å—Ç–∏ –¥–æ —Ç—Ä–æ–≤–∞—ö–∞, —É —É—Å–ª–æ–≤–∏–º–∞ —Ö–∏–ø–µ—Ä–æ–∫—Å–∏—ò–µ, –∫–æ—ò–∏ –æ–±–∏—á–Ω–æ —É–∫—ô—É—á—É—ò—É; –ø—Ä–æ–º–µ–Ω–µ –Ω–∞ —Ü–µ–Ω—Ç—Ä–∞–ª–Ω–æ–º –Ω–µ—Ä–≤–Ω–æ–º —Å–∏—Å—Ç–µ–º—É (–¶–ù–°), –ø–ª—É—õ–∏–º–∞ –∏ –æ—á–∏–º–∞. –ó–∞—Ç–æ —ò–µ –∑–∞ –±–µ–∑–±–µ–¥–Ω—É –ø—Ä–∏–º–µ–Ω—É –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –ø–æ—Ç—Ä–µ–±–Ω–æ; –æ–¥–≥–æ–≤–∞—Ä–∞—ò—É—õ–µ –∑–Ω–∞—ö–µ –æ –º–æ–≥—É—õ–∏–º —à—Ç–µ—Ç–Ω–∏–º —É—Ç–∏—Ü–∞—ò–∏–º–∞, —ö–µ–≥–æ–≤–∞ —ò–∞—Å–Ω–æ –¥–µ—Ñ–∏–Ω–∏—Å–∞–Ω–∞ (–ø—Ä–∞–≤–∏–ª–Ω–æ –¥–æ–∑–∏—Ä–∞–Ω–∞) —É–ø–æ—Ç—Ä–µ–±–∞ –∏ —Å—Ç–∞–ª–Ω–∏ –º–æ–Ω–∏—Ç–æ—Ä–∏–Ω–≥ (–ø—Ä–∞—õ–µ—ö–µ) –≤–∏—Ç–∞–ª–Ω–∏—Ö –ø–∞—Ä–∞–º–µ—Ç–∞—Ä–∞ –ø–∞—Ü–∏—ò–µ–Ω–∞—Ç–∞, —É —Ü–∏—ô—É –ø—Ä–∞–≤–æ–≤—Ä–µ–º–µ–Ω–æ–≥ –ø—Ä–µ–ø–æ–∑–Ω–∞–≤–∞—ö–∞ –ø–æ—á–µ—Ç–Ω–∏—Ö –º–∞–Ω–∏—Ñ–µ—Å—Ç–∞—Ü–∏—ò–∞ —Ç—Ä–æ–≤–∞—ö–∞. –ò—Å—Ç–æ—Ä–∏—ò–∞ –è–æ–∑–µ—Ñ –ü—Ä–∏—Å—Ç–ª–∏, –∫–æ—ò–∏ —ò–µ –æ—Ç–∫—Ä–∏–æ –∫–∏—Å–µ–æ–Ω–∏–∫ –∏ –≤–µ–ª–∏—á–∞–æ —ö–µ–≥–æ–≤ –∑–Ω–∞—á–∞—ò –∑–∞ –∂–∏–≤–∞ –±–∏—õ–∞, –º–µ—í—É –ø—Ä–≤–∏–º–∞ —ò–µ —É–∫–∞–∑–æ –∏ –Ω–∞ –ø–æ—Å—Ç–æ—ò–∞—ö–µ –º–æ–≥—É—õ–∏—Ö —à—Ç–µ—Ç–Ω–∏—Ö —É—Ç–∏—Ü–∞—ò–∞ –æ–≤–æ–≥ –≥–∞—Å–∞ –Ω–∞ –∂–∏–≤–∞ –±–∏—õ–∞. –ö–∞–¥–∞ —ò–µ —É 1775, –ø—Ä–∏–º–µ—Ç–∏–æ –¥–∞ —Å–≤–µ—õ–∞ –º–Ω–æ–≥–æ –±—Ä–∂–µ —Å–∞–≥–æ—Ä–∏ —É –∫–∏—Å–µ–æ–Ω–∏–∫—É –Ω–µ–≥–æ —É –≤–∞–∑–¥—É—Ö—É, –ü—Ä–∏—Å—Ç–ª–∏ —Å–µ –∑–∞–ø–∏—Ç–∞–æ...‚Äû–¥–∞ –ª–∏ –∏ –∫–æ–¥ –∂–∏–≤–∏—Ö –±–∏—õ–∞ –º–æ–∂–µ –¥–æ—õ–∏ –¥–æ –≤–µ–ª–∏–∫–æ–≥ –∏—Å—Ü—Ä–ø—ô–∏–≤–∞—ö–∞ –æ—Ä–≥–∞–Ω–∏–∑–º–∞ —É —á–∏—Å—Ç–æ–º –∫–∏—Å–µ–æ–Ω–∏–∫—É‚Äù?[2] –ê–Ω—Ç–æ–∞–Ω –õ–∞–≤–æ–∞–∑—ò–µ, —Å–∞ —Å–∞—Ä–∞–¥–Ω–∏—Ü–∏–º–∞ 1770. –¥–µ—Ñ–∏–Ω–∏—Å–∞–æ —ò–µ –∫–∏—Å–µ–æ–Ω–∏–∫ –∫–∞–æ —Ö–µ–º–∏—ò—Å–∫–∏ –µ–ª–µ–º–µ–Ω—Ç –∏ —É–≤–µ–æ —Ç–µ—Ä–º–∏–Ω –æ–∫—Å–∏–≥–µ–Ω–∞—Ü–∏—ò–∞ - –∫–∞–æ –¥–æ–¥–∞–≤–∞—ö–µ –∫–∏—Å–µ–æ–Ω–∏—á–∫–æ–≥ –∞—Ç–æ–º–∞ —Å—É–ø—Å—Ç–∞–Ω—Ü–∏.[3] –¢–æ–∫—Å–∏—á–Ω–∏ —É—Ç–∏—Ü–∞—ò –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ —Ü–µ–Ω—Ç—Ä–∞–ª–Ω–∏ –Ω–µ—Ä–≤–Ω–∏ —Å–∏—Å—Ç–µ–º, –∫–æ—ò–∏ —ò–µ –ø–æ —ö–µ–º—É –Ω–∞–∑–≤–∞–Ω ‚Äû–ë–µ—Ä—Ç–æ–≤ –µ—Ñ–µ–∫–∞—Ç‚Äú' –æ—Ç–∫—Ä–∏–æ —ò–µ –ü–æ–ª –ë–µ—Ä, —Ñ—Ä–∞–Ω—Ü—É—Å–∫–∏ –Ω–∞—É—á–Ω–∏–∫ –∫–æ—ò–∏ —ò–µ 1878, –ø—Ä–≤–∏ –ø—Ä–∏–∫–∞–∑–∞–æ –∫–æ–Ω–≤—É–ª–∑–∏—ò–µ —É —à–µ–≤–∞ –∏–∑–ª–æ–∂–µ–Ω–∏—Ö –ø—Ä–∏—Ç–∏—Å–∫—É –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –æ–¥ 15-20 –ê–¢–ê .[4] –û–Ω —ò–µ –¥–æ–∫–∞–∑–∞–æ –∏ –¥–∞ —ò–µ –∫–∏—Å–µ–æ–Ω–∏–∫ —Ç–æ–∫—Å–∏—á–∞–Ω –∑–∞ –∏–Ω—Å–µ–∫—Ç–µ, –º–µ–∫—É—à—Ü–µ, –∫–∏—à–Ω–µ –≥–ª–∏—Å—Ç–µ, –≥—ô–∏–≤–µ, –ø—Ç–∏—Ü–µ –∏ –¥—Ä—É–≥–µ –∂–∏–≤–æ—Ç–∏—ö–µ.[5] –¢–æ–∫—Å–∏—á–Ω–∏ —É—Ç–∏—Ü–∞—ò –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ –ø–ª—É—õ–∏–º–∞, –ø–æ–∑–Ω–∞—Ç –ø–æ–¥ –Ω–∞–∑–∏–≤–æ–º ‚Äû–°–º–∏—Ç–æ–≤ –µ—Ñ–µ–∫–∞—Ç‚Äú –Ω–∞–∑–≤–∞–Ω —ò–µ –ø–æ –Ω–∞—É—á–Ω–∏–∫—É (–µ–Ω–≥–ª. J Lorain Smith), –∫–æ—ò–∏ —ò–µ 1899, —Ç–æ–∫–æ–º –ø–æ–∫—É—à–∞—ò–∞ –¥–∞ —Ä–µ–ø—Ä–æ–¥—É–∫—É—ò–µ ‚Äû–ë–µ—Ä—Ç–æ–≤ –µ—Ñ–µ–∫–∞—Ç‚Äú, –ø—Ä–∏–º–µ—Ç–∏–æ —Ñ–∞—Ç–∞–ª–Ω—É —É–ø–∞–ª—É –ø–ª—É—õ–∞ –∫–æ–¥ –ø–∞—Ü–æ–≤–∞, –Ω–∞–∫–æ–Ω —á–µ—Ç–≤—Ä—Ç–æ–≥ –¥–∞–Ω–∞ –æ–¥ –∏–∑–ª–∞–≥–∞—ö–∞ –æ–≤–∏—Ö –∂–∏–≤–æ—Ç–∏—ö–∞ 73% –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º –Ω–∞ 1 –ê–¢–ê.[2][4] –û–Ω —ò–µ —Ç–æ –∏ –¥–æ–∫–∞–∑–∞–æ —É –¥–∞—ô–∏–º –µ–∫—Å–ø–µ—Ä–∏–º–µ–Ω—Ç–∏–º–∞ –Ω–∞ –º–∏—à–µ–≤–∏–º–∞ –∏ –ø—Ç–∏—Ü–∞–º–∞, –∫–æ—ò–µ —ò–µ –ø—Ä–≤–æ –∏–∑–ª–∞–≥–∞–æ –ø—Ä–∏—Ç–∏—Å–∫—É –æ–¥ 0,43 –±–∞—Ä–∞ (43 kPa), –∫–∞–¥–∞ –∫–∏—Å–µ–æ–Ω–∏–∫ –Ω–∏—ò–µ –∏—Å–ø–æ—ô–∏–æ —Ç–æ–∫—Å–∏—á–Ω–æ –¥–µ—ò—Å—Ç–≤–æ –∞ –∑–∞—Ç–∏–º –ø—Ä–∏—Ç–∏—Å–∫—É –æ–¥ 0,75 –±–∞—Ä–∞ (75 kPa) –∫–∞–¥–∞ —ò–µ –∫–∏—Å–µ–æ–Ω–∏–∫ –∏—Ä–∏—Ç–∏—Ä–∞–æ –ø–ª—É—õ–∞ –∏ –∏—Å–ø–æ—ô–∏–æ —Ç–æ–∫—Å–∏—á–Ω–æ—Å—Ç.[5] –ü—Ä–≤–∏ –∫–æ—ò–∏ —ò–µ –∑–∞–±–µ–ª–µ–∂–∏–æ —Ç—Ä–æ–≤–∞—ö–µ –∫–∏–æ—Å–µ–æ–Ω–∏–∫–æ–º –∫–æ–¥ —ô—É–¥–∏ –±–∏–æ —ò–µ –µ–Ω–≥–ª. Bornstein 1910, –∫–æ–¥ –¥–≤–æ—ò–∏—Ü–µ —ô—É–¥–∏ –∫–æ—ò–∏ —Å—É –¥–∏—Å–∞–ª–∏ –∫–∏—Å–µ–æ–Ω–∏–∫ –Ω–∞ 2,8 –±–∞—Ä–∞ (280 kPa) –æ–∫–æ 30 –º–∏–Ω—É—Ç–∞, –¥–æ–∫ —ò–µ –æ–Ω —É–¥–∏—Å–∞–æ –∫–∏—Å–µ–æ–Ω–∏–∫ 48 –º–∏–Ω—É—Ç–∞, –±–µ–∑ –∏–∫–∞–∫–≤–∏—Ö —Å–∏–º–ø—Ç–æ–º–∞. –ì–æ–¥–∏–Ω–µ 1912, Bornstein —ò–µ –∏–∑–∞–∑–≤–∞–æ –≥—Ä—á–µ–≤–µ —É —Ä—É–∫–∞–º–∞ –∏ –Ω–æ–≥–∞–º–∞, —Ç–æ–∫–æ–º –¥–∏—Å–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ –ø—Ä–∏—Ç–∏—Å–∫—É –æ–¥ 2,8 –±–∞—Ä–∞ (280 kPa) —É —Ç—Ä–∞—ò–∞—ö—É –æ–¥ 51 –º–∏–Ω—É—Ç–∞.[6] –¢–æ–∫–æ–º 1935. –ê–ª—Ñ—Ä–µ–¥ –ë–µ–Ω–∫–µ (–µ–Ω–≥–ª. Alfred R. Behnke) –∏ —Å–∞—Ä. –ø—Ä–≤–∏ —Å—É –ø—Ä–æ—É—á–∞–≤–∞–ª–∏ –ø—Ä–æ–º–µ–Ω–µ —É –≤–∏–¥–Ω–æ–º –ø–æ—ô—É (—Ç–∑–≤."—Ç—É–Ω–µ–ª—Å–∫–∏ –≤–∏–¥") —É —Ç–æ–∫—É –∑–∞—Ä–æ–Ω–∞ –Ω–∞ –¥—É–±–∏–Ω—É –æ–¥ 1,0 –∏ 4.1 –±–∞—Ä–∞ (410 kPa).[7] –¢–æ–∫–æ–º –î—Ä—É–≥–æ–≥ —Å–≤–µ—Ç—Å–∫–æ–≥ —Ä–∞—Ç–∞, (–µ–Ω–≥–ª. Donald et Yarbrough) –∏ —Å–∞—Ä. –æ–±–∞–≤–∏–ª–∏ —Å—É –ø—Ä–µ–∫–æ 2.000 –µ–∫—Å–ø–µ—Ä–∏–º–µ–Ω–∞—Ç–∞ –Ω–∞ —Ç–æ–∫—Å–∏—á–Ω–æ—Å—Ç –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É —Ü–∏—ô—É —É–Ω–∞–ø—Ä–µ—í–µ—ö–∞ –æ–ø—Ä–µ–º–µ –∑–∞ –¥–∏—Å–∞—ö–µ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –∫–æ–¥ —Ä–æ–Ω–∏–ª–∞—Ü–∞. –ù–∞–∫–æ–Ω –î—Ä—É–≥–æ–≥ —Å–≤–µ—Ç—Å–∫–æ–≥ —Ä–∞—Ç–∞, –õ–∞–º–±–µ—Ä—Ç—Å–µ–Ω –∏ —Å–∞—Ä. –∏–Ω—Ç–µ–Ω–∑–∏–≤–Ω–æ —Å—É –∏—Å—Ç—Ä–∞–∂–∏–≤–∞–ª–∏ —É—á–∏–Ω–∫–µ –¥–∏—Å–∞—ö–µ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –ø–æ–¥ –ø—Ä–∏—Ç–∏—Å–∫–æ–º, –∏ –º–æ–≥—É—õ—É –ø—Ä–∏–º–µ–Ω—É –ø–æ—Å—Ç—É–ø–∞–∫–∞ –∑–∞ –ø—Ä–µ–≤–µ–Ω—Ü–∏—ò—É —Ç–æ–∫—Å–∏—á–Ω–æ–≥ –¥–µ—ò—Å—Ç–≤–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞.[8] –ä–∏—Ö–æ–≤–∞ –∏—Å—Ç—Ä–∞–∂–∏–≤–∞—ö–∞ —Ä–µ–∑—É–ª—Ç–æ–≤–∞–ª–∞ —Å—É –∏–∑—Ä–∞–¥–æ–º –º–æ–¥–µ–ª–∞ –∑–∞ –ø—Ä–µ–¥–≤–∏—í–∞—ö–µ –º–æ–≥—É—õ–µ —Ç–æ–∫—Å–∏—á–Ω–æ—Å—Ç–∏ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ –æ—Å–Ω–æ–≤—É –ø–ª—É—õ–Ω–∏—Ö —Ñ—É–Ω–∫—Ü–∏—ò–∞, –∫–∞–æ –∏ –∏–∑—Ä–∞–¥–æ–º –∫—ô—É—á–Ω–∏—Ö –Ω–æ—Ä–º–∞—Ç–∏–≤–∞ –∑–∞ —Ä–∞–∑–≤–æ—ò —Å—Ç–∞–Ω–¥–∞—Ä–¥–Ω–∏—Ö –æ–ø–µ—Ä–∞—Ç–∏–≤–Ω–∏—Ö –ø—Ä–æ—Ü–µ–¥—É—Ä–∞ –ø—Ä–∏–ª–∏–∫–æ–º –¥–∏—Å–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ –ø–æ–≤–∏—à–µ–Ω–æ–º –ø—Ä–∏—Ç–∏—Å–∫—É. –õ–∞–º–±–µ—Ä—Ç—Å–µ–Ω–æ–≤ —Ä–∞–¥ –ø–æ–∫–∞–∑–∞–æ —ò–µ –∑–Ω–∞—á–∞—ò —Å–º–∞—ö–µ—ö–∞ —É–≥—ô–µ–Ω–∏–∫–∞ —É –≤—Ä–µ–º–µ –ø–æ—á–µ—Ç–Ω–∏—Ö –ø—Ä–æ–º–µ–Ω–∞ –Ω–∞ —Ü–µ–Ω—Ç—Ä–∞–ª–Ω–æ–º –Ω–µ—Ä–≤–Ω–æ–º —Å–∏—Å—Ç–µ–º—É, —à—Ç–æ —ò–µ –∫–∞—Å–Ω–∏—ò–µ –ø–æ—Å–ª—É–∂–∏–ª–æ –∑–∞ –±—É–¥—É—õ–∏ –¥–∏–∑–∞—ò–Ω –∞–ø–∞—Ä–∞—Ç–∞ –∑–∞ –¥–∏—Å–∞—ö–µ –∫–∏—Å–µ–æ–Ω–∏–∫–∞.[9] –Ý–µ—Ç–∏–Ω–æ–ø–∞—Ç–∏—ò–∞ –∫–æ–¥ –Ω–æ–≤–æ—Ä–æ—í–µ–Ω–µ –¥–µ—Ü–µ –Ω–∏—ò–µ –ø—Ä–∏–º–µ—õ–µ–Ω–∞ –ø—Ä–µ –î—Ä—É–≥–æ–≥ —Å–≤–µ—Ç—Å–∫–æ–≥ —Ä–∞—Ç–∞, –∞–ª–∏ —É–∑ —Å–≤–µ –≤–µ—õ—É —É—á–µ—Å—Ç–∞–ª–æ—Å—Ç –¥–æ–ø—É–Ω—Å–∫–µ –ø—Ä–∏–º–µ–Ω–µ –∫–∏—Å–µ–æ–Ω–∏–∫–∞, —É –Ω–∞—Ä–µ–¥–Ω–∏—Ö –¥–µ—Å–µ—Ç –≥–æ–¥–∏–Ω–∞, –±—Ä–∑–æ —ò–µ –ø–æ—Å—Ç–∞–ª–æ —ò–∞—Å–Ω–æ –¥–∞ —ò–µ –æ–Ω —ò–µ–¥–∞–Ω –æ–¥ –≥–ª–∞–≤–Ω–∏—Ö —É–∑—Ä–æ–∫–∞ —Å–ª–µ–ø–∏–ª–∞ –Ω–æ–≤–æ—Ä–æ—í–µ–Ω—á–∞–¥–∏ —É —Ä–∞–∑–≤–∏—ò–µ–Ω–∏–º –∑–µ–º—ô–∞–º–∞ —Å–≤–µ—Ç–∞.[10] –ë—Ä–æ–Ω—Ö–æ–ø—É–ª–º–æ–Ω–∞–ª–Ω—É –¥–∏—Å–ø–ª–∞–∑–∏—ò—É –ø—Ä–≤–∏ –ø—É—Ç —ò–µ –æ–ø–∏—Å–∞–æ (–µ–Ω–≥–ª. Northway) 1967, –∏ –Ω–∞–≤–µ–æ —É—Å–ª–æ–≤–µ –∫–æ—ò–∏ —õ–µ –¥–æ–≤–µ—Å—Ç–∏ –¥–æ —ö–µ–Ω–µ –¥–∏—ò–∞–≥–Ω–æ–∑–µ.[11] –û–≤–æ —Å–∞–∑–Ω–∞—ö–∞ —Å—É –∫–∞—Å–Ω–∏—ò–µ –ø—Ä–æ—à–∏—Ä–∏–ª–∏ (–µ–Ω–≥–ª. Bancalari) –∏ 1988. (–µ–Ω–≥–ª. Shennan), –∞–ª–∏ —Å—É –∏–ø–∞–∫, (–µ–Ω–≥–ª. Nevertheless, Palta) –∏ —Å–∞—Ä. —É 1998. –∑–∞–∫—ô—É—á–∏–ª–∏ –¥–∞ —Å—É —Ä–∞–¥–∏–æ–≥—Ä–∞—Ñ—Å–∫–∏ –¥–æ–∫–∞–∑–∏, –Ω–∞—ò–ø—Ä–µ—Ü–∏–∑–Ω–∏—ò–∏ –ø—Ä–µ–¥–∏–∫—Ç–æ—Ä –¥—É–≥–æ—Ä–æ—á–Ω–∏—Ö –ø–æ—Å–ª–µ–¥–∏—Ü–µ —É–¥–∏—Å–∞—ö–∞ –º–µ–¥–∏—Ü–∏–Ω—Å–∫–æ–≥ –∫–∏—Å–µ–æ–Ω–∏–∫–∞.[12] –ò –ø–æ—Ä–µ–¥ –±—Ä–æ—ò–Ω–∏—Ö –∏—Å—Ç—Ä–∞–∂–∏–≤–∞—ö–∞, –ø–æ—É–∑–¥–∞–Ω –º–æ–¥–µ–ª –∑–∞ –ø—Ä–µ–¥–≤–∏—í–∞—ö–µ —Ç–æ–∫—Å–∏—á–Ω–æ–≥ –¥–µ—ò—Å—Ç–≤–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ –ø–ª—É—õ–∏–º–∞ –Ω–∏—ò–µ —É—Å–ø–µ–æ –¥–∞ –æ–±—ò–∞—Å–Ω–∏ —Å–≤–µ –ø–æ—Å–ª–µ–¥–∏—Ü–µ –∏–∑–ª–∞–≥–∞—ö–∞ –≤–µ—õ–µ–º –ø–∞—Ä—Ü–∏—ò–∞–ª–Ω–æ–º –ø—Ä–∏—Ç–∏—Å–∫—É –∫–∏—Å–µ–æ–Ω–∏–∫–∞.[13]  –ö—Ä–∞—ò–µ–º 1990, –∑–∞–ø–æ—á–∏—ö–µ –∫–æ—Ä–∏—à—õ–µ—ö–µ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É —Ä–µ–∫—Ä–µ–∞—Ç–∏–≤–Ω–µ —Å–≤—Ä—Ö–µ, –∫–æ—ò–∏ —Å—É —É —Å–≤–µ—Ç—É –ø–æ—á–µ–ª–∏ –¥–∞ –ø—Ä–æ–º–æ–≤–∏—à—É —Ç–∑–≤. ‚Äû–ö–∏—Å–µ–æ–Ω—á–∫–∏ –±–∞—Ä–æ–≤–∏‚Äú, —É –∫–æ—ò–∏–º–∞ –∫–æ—Ä–∏—Å–Ω–∏—Ü–∏ —ö–∏—Ö–æ–≤–∏—Ö —É—Å–ª—É–≥–∞ —É–¥–∏—à—É –∫–∏—Å–µ–æ–Ω–∏–∫ –ø—Ä–µ–∫–æ –Ω–æ—Å–Ω–∏—Ö –∫–∞–Ω–∏–ª–∞. –£ –æ–≤–∏–º –±–∞—Ä–æ–≤–∏–º–∞ –ø—Ä–æ–º–æ–≤–∏—à–µ —Å–µ –Ω–∞–≤–æ–¥–Ω–æ –Ω–æ–≤–∞ –º–µ—Ç–æ–¥–∞ –∫–æ—ò–æ–º —Å–µ —Å–º–∞—ö—É—ò–µ —Å—Ç—Ä–µ—Å, –ø–æ–≤–µ—õ–∞–≤–∞ –µ–Ω–µ—Ä–≥–∏—ò–∞, —Å–º–∞—ö—É—ò–µ –≥–ª–∞–≤–æ–±–æ—ô–∞, —É–∫–ª–∞—ö–∞—ò—É –æ—Ç—Ä–æ–≤–∏ –∏ –º–∞—Å–Ω–æ—õ–∞ –∏–∑ –æ—Ä–≥–∞–Ω–∏–∑–º–∞ –∏—Ç–¥, (—É–ø—Ä–∫–æ—Å –Ω–µ–¥–æ—Å—Ç–∞—Ç–∫—É –±–∏–ª–æ –∫–æ–≥ –Ω–∞—É—á–Ω–æ–≥ –¥–æ–∫–∞–∑–∞ –¥–∞ —ò–µ —ö–∏—Ö–æ–≤–∞ —É–ø–æ—Ç—Ä–µ–±–∞ –æ–ø—Ä–∞–≤–¥–∞–Ω–∞).[14] –ò–∞–∫–æ —ò–µ –ê–º–µ—Ä–∏—á–∫–∞ –∞—Å–æ—Ü–∏—ò–∞—Ü–∏—ò–∞ –∑–∞ –ø–ª—É—õ–Ω–µ –±–æ–ª–µ—Å—Ç–∏ –ø–æ–≤–æ–¥–æ–º –æ—Ç–≤–∞—Ä–∞—ö–∞ –æ–≤–∏—Ö –±–∞—Ä–æ–≤–∞ –∏–∑–¥–∞–ª–∞ —ò–µ —Å–∞–æ–ø—à—Ç–µ—ö–µ —É –∫–æ–º–µ –Ω–∞–≤–æ–¥–∏.. ‚Äû–Ω–µ–º–∞ –¥–æ–∫–∞–∑–∞ –¥–∞ —ò–µ –∫–∏—Å–µ–æ–Ω–∏–∫, –∫–æ—ò–∏ —Å–µ –ø—Ä–∏–º–µ—ö—É—ò–µ –Ω–∞ –Ω–∏—Å–∫–æ–º –ø—Ä–∏—Ç–∏—Å–∫—É –∏ –º–∞–ª–æ–º –ø—Ä–æ—Ç–æ–∫—É –æ–ø–∞—Å–∞–Ω –ø–æ –∑–¥—Ä–∞–≤—ô–µ –Ω–æ—Ä–º–∞–ª–Ω–µ-–∑–¥—Ä–∞–≤–µ –æ—Å–æ–±–µ‚Äù, –¶–µ–Ω—Ç–∞—Ä –∑–∞ –µ–≤–∞–ª—É–∞—Ü–∏—ò—É –∏ –∏—Å—Ç—Ä–∞–∂–∏–≤–∞—ö–µ –ª–µ–∫–æ–≤–∞ —É –°–ê–î, —É–ø–æ–∑–æ—Ä–∞–≤–∞ –¥–∞ —ô—É–¥–∏ —Å–∞ —Å—Ä—á–∞–Ω–∏–º –∏–ª–∏ –ø–ª—É—õ–Ω–∏–º –±–æ–ª–µ—Å—Ç–∏–º–∞, –Ω–µ –±–∏ —Ç—Ä–µ–±–∞–ª–æ –¥–∞ –∫–æ—Ä–∏—Å—Ç–µ –∫–∏—Å–µ–æ–Ω–∏–∫ —É –æ–≤–∏–º –±–∞—Ä–æ–≤–∏–º–∞, –ø–æ—à—Ç–æ —ö–µ–≥–æ–≤–∞ —É–ø–æ—Ç—Ä–µ–±–∞ –º–æ—Ä–∞ –¥–∞ –±—É–¥–µ —ò–∞—Å–Ω–æ —Ä–µ–≥—É–ª–∏—Å–∞–Ω–∞ –∏ –ø–æ–¥ –∫–æ–Ω—Ç—Ä–æ–ª–æ–º –º–µ–¥–∏—Ü–∏–Ω—Å–∫–æ–≥ –æ—Å–æ–±—ô–∞, —ò–µ—Ä —Å–µ —É –ø—Ä–æ—Ç–∏–≤–Ω–æ–º –Ω–µ –º–æ–∂–µ –∏—Å–∫—ô—É—á–∏—Ç–∏ –∏ –º–æ–≥—É—õ–Ω–æ—Å—Ç —Ç–æ–∫—Å–∏—á–Ω–æ–≥ –¥–µ—ò—Å—Ç–≤–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –∫–æ–¥ –æ–≤–∏—Ö –±–æ–ª–µ—Å–Ω–∏–∫–∞.[14] –§–∏–∑–∏–æ–ª–æ—à–∫–∏ –º–µ—Ö–∞–Ω–∏–∑–º–∏ –æ–¥–±—Ä–∞–Ω–µ –æ—Ä–≥–∞–Ω–∏–∑–º–∞ –æ–¥ –≤–∏—à–∫–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞–ö–∏—Å–µ–æ–Ω–∏–∫ —ò–µ –¥—Ä—É–≥–∏ –≥–∞—Å –ø–æ –∑–∞—Å—Ç—É–ø—ô–µ–Ω–æ—Å—Ç–∏ —É —Ñ–æ—Ä–º–∏—Ä–∞—ö—É –Ω–æ—Ä–º–∞–ª–∞–Ω–æ–≥ –∞—Ç–º–æ—Å—Ñ–µ—Ä—Å–∫–æ–≥ –≤–∞–∑–¥—É—Ö–∞, —É –∫–æ–º —ò–µ —Å–∞ (20,93%), –æ–¥–º–∞—Ö –∏–∑–∞ –∞–∑–æ—Ç–∞ (78,10%). –ö–∏—Å–µ–æ–Ω–∏–∫ —ò–µ –æ–¥ –≤–∏—Ç–∞–ª–Ω–æ–≥ –∑–Ω–∞—á–∞—ò–∞ –∑–∞ –æ–¥—Ä–∂–∞—ö–µ –∂–∏–≤–æ—Ç–∞ –Ω–∞ –∑–µ–º—ô–∏, –∞ —ö–µ–≥–æ–≤ –ø–∞—Ä—Ü–∏—ò–∞–ª–Ω–∏ –ø—Ä–∏—Ç–∏—Å–∞–∫–∞ —É –∞—Ç–º–æ—Å—Ñ–µ—Ä—Å–∫–æ–º –≤–∞–∑–¥—É—Ö—É –Ω–∞ –Ω–∏–≤–æ –º–æ—Ä–∞ —ò–µ –æ–∫–æ 160 mmHg.[15][16] –ö–∏—Å–µ–æ–Ω–∏–∫ —ò–µ –º–µ—Ç–∞–±–æ–ª–∏—á–∫–∏ –≥–∞—Å, –¥–∏—Ñ—É–∑–Ω–æ –ø—Ä–∏—Å—É—Ç–∞–Ω —É –∞–µ—Ä–æ–±–Ω–∏–º –æ—Ä–≥–∞–Ω–∏–∑–º–∏–º–∞. –û–Ω —ò–µ —É–∫—ô—É—á–µ–Ω —É –º–µ—Ç–∞–±–æ–ª–∏–∑–∞–º —Å–≤–∞–∫–µ —õ–µ–ª–∏—ò–µ –∫–∞–æ –æ–∫—Å–∏–¥–∞–Ω—Å —É –ø—Ä–æ—Ü–µ—Å—É –æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–µ —Ñ–æ—Å—Ñ–æ—Ä–∏–ª–∞—Ü–∏—ò–µ –∏ –∏–º–∞ –∏–∑—Ä–∞–∂–µ–Ω—É —Å–ø–æ—Å–æ–±–Ω–æ—Å—Ç –¥–∞ –ø—Ä–∏–º–∞ –µ–ª–µ–∫—Ç—Ä–æ–Ω–µ. –ê–∫–æ –æ–∫—Å–∏–¥–∞–Ω—Ç–Ω–∞ —Å–ø–æ—Å–æ–±–Ω–æ—Å—Ç –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –∏–∑–º–∞–∫–Ω–µ –∞–Ω—Ç–∏–æ–∫—Å–∏–¥–∞–Ω—Ç–Ω–æ—ò –∫–æ–Ω—Ç—Ä–æ–ª–∏ –æ–¥ —Å—Ç—Ä–∞–Ω–µ –æ—Ä–≥–∞–Ω–∏–∑–º–∞ –º–æ–≥—É –Ω–∞—Å—Ç–∞—Ç–∏ –æ–∑–±–∏—ô–Ω–∞ –æ—à—Ç–µ—õ–µ—ö–∞ –ø–∞ –∏ —Å–º—Ä—Ç –∞–µ—Ä–æ–±–Ω–∏—Ö –æ—Ä–≥–∞–Ω–∏–∑–∞–º–∞.[15] –û—Ä–≥–∞–Ω–∏–∑–∞–º —á–æ–≤–µ–∫–∞ (–∏ –¥—Ä—É–≥–∏—Ö –∞–µ—Ä–æ–±–Ω–∏—Ö –±–∏—õ–∞) —É —Ç–æ–∫—É —Å–≤–æ–≥ –µ–≤–æ–ª—É—Ü–∏–æ–Ω–æ–≥ —Ä–∞–∑–≤–æ—ò–∞ –∏–∑–≥—Ä–∞–¥–∏–æ —ò–µ —Å–Ω–∞–∂–Ω–µ –º–µ—Ö–∞–Ω–∏–∑–º–µ –∑–∞—à—Ç–∏—Ç–µ –æ–¥ –æ–∫—Å–∏–¥–∞—Ü–∏–æ–Ω–∏—Ö –ø—Ä–æ—Ü–µ—Å–∞ —É–Ω—É—Ç–∞—Ä —õ–µ–ª–∏—ò–µ –∏ —É —Å—Ç–∞—ö—É —ò–µ –¥–∞ –∫—Ä–æ–∑ –≤–∏—à–µ –ª–∏–Ω–∏—ò–∞ –æ–¥–±—Ä–∞–Ω–µ –¥–æ—Å—Ç–∞ —É—Å–ø–µ—à–Ω–æ –æ–≥—Ä–∞–Ω–∏—á–∏ —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —á–∞–∫ –∏ —É –∏–∑—Ä–∞–∂–µ–Ω–∏–º —É—Å–ª–æ–≤–∏–º–∞ —Ö–∏–ø–µ—Ä–æ–∫—Å–∏—ò–µ; –ü—Ä–≤–∞ –ª–∏–Ω–∏—ò–∞ - –ø–ª—É—õ–Ω–æ-–∫—Ä–≤–Ω–∞ –±–∞—Ä–∏—ò–µ—Ä–∞ –¢—Ä–∞–Ω—Å–ø–æ—Ä—Ç –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É –ø–ª—É—õ–∏–º–∞ –æ–¥–≤–∏—ò–∞ —Å–µ –Ω–∞ –Ω–∏–≤–æ—É –∞–ª–≤–µ–æ–ª–æ–∫–∞–ø–∏–ª–∞—Ä–Ω–µ –º–µ–º–±—Ä–∞–Ω–µ –∫—Ä–æ–∑ –∫–æ—ò—É —Å–µ —Ä–∞–∑–º–µ–Ω–∞ –≥–∞—Å–æ–≤–∞ –æ–±–∞–≤—ô–∞ –¥–∏—Ñ—É–∑–∏—ò–æ–º, –∏ –æ–Ω–∞ —ò–µ –ø—Ä–≤–∞ –ª–∏–Ω–∏—ò–∞ –æ–¥–±—Ä–∞–Ω–µ —É —Ö–∏–ø–µ—Ä–æ–∫—Å–∏—ò–∏. –à–∞—Å–Ω–æ –¥–µ—Ñ–∏–Ω–∏—Å–∞–Ω–∏–º —Ñ–∏–∑–∏–æ–ª–æ—à–∫–∏–º –º–µ—Ö–∞–Ω–∏–∑–º–∏–º–∞ –æ—Ä–≥–∞–Ω–∏–∑–∞–º–∞ —Ä–µ–≥—É–ª–∏—à–µ —Ç—Ä–∞–Ω—Å–ø–æ—Ä—Ç –∫–∏—Å–µ–æ–Ω–∏–∫–∞, –º–µ—í—É—Ç–∏–º —Ç–∏ –º–µ—Ö–∞–Ω–∏–∑–º–∏ –º–æ–≥—É –±–∏—Ç–∏ –æ–≥—Ä–∞–Ω–∏—á–µ–Ω–∏ —Å–ª–µ–¥–µ—õ–∏–º —Ñ–∞–∫—Ç–æ—Ä–∏–º–∞:[16]
Плућа на вишеденевно излагање хипероксији, реагују задебљањем авеолокапиларне мебране и смањењем виталног капацитета. Овај реверзибилни компензаторни механизам је прва линија заштите која има за циљ да смањи дифузију кисеоника. Међутим ова мера одбране организма у хипероксији може имати и неповољан утицај на организам, уколико се не прекине са хипероксијом, јер настаје тзв. „Лорен-Смитов ефекат“ (који је у овом тексту посебно описана). Друга линија - аутономна нервна контрола протока крви Централни и периферни хеморецептори који су смештени у зиду крвних судова (каротидна и аортне тела) реагују на промене количине кисеоника и угљендиоксида раствореног у плазми. На основу информација, које добија аутономни нервни систем (симпатички и парасимпатички) из хеморецептора, он обавља контролу тонуса и унутрашњи промер прекапиларног крвног суда и регулише капиларни крвни проток и количину кисеоника која ће бити доступна ћелијијама и ткиву у одређеном делу тела. Пораст количине кисеоника у крви у току хипероксије доводи до снажне васоконстрикције (сужења) у свим здравим крвним судовима и у свим здравим ткивима. Једино се супротан процес одиграва у крвним судовима плућа који у хипероксији реагују вазодилатацијом а у зонама хипоксије, хипоксичном плућном вазоконстрикцијом. Трећа линија одбране - на ћелијском нивоуТранспорт кисеоника између капилара и ћелије обавља се дифузијом по истом принципу како и у плућима, у складу са разликом (градијентом) притисака гасова.
. –ß–µ—Ç–≤—Ä—Ç–∞ –ª–∏–Ω–∏—ò–∞ - –∫–æ–Ω—Ç—Ä–æ–ª–∏—Å–∞–Ω–∞ –æ–∫—Å–∏–¥–∞—Ü–∏–æ–Ω–∞ —Ä–µ–∞–∫—Ü–∏—ò–∞–ö–∏—Å–µ–æ–Ω–∏–∫ —Å–µ —É –æ—Ä–≥–∞–Ω–∏–∑–º—É –ø–æ–Ω–∞—à–∞ –∏ –∫–∞–æ –∫–æ–Ω—Ç—Ä–æ–ª–∏—Å–∞–Ω–æ –æ–∫—Å–∏–¥–∞—Ü–∏–æ–Ω–æ —Å—Ä–µ–¥—Å—Ç–≤–æ. –ó–∞—Ç–æ —ò–µ –∫–æ–Ω—Ç—Ä–æ–ª–∏—Å–∞–Ω–∞ –æ–∫—Å–∏–¥–∞—Ü–∏–æ–Ω–∞ —Ä–µ–∞–∫—Ü–∏—ò–∞, –∏–∑—É–∑–µ—Ç–Ω–æ –∑–Ω–∞—á–∞—ò–Ω–∞ –º–µ—Ä–∞ –∑–∞—à—Ç–∏—Ç–µ —õ–µ–ª–∏—ò–µ –∏ —Ç–∫–∏–≤–∞ —É —Ö–∏–ø–µ—Ä–æ–∫—Å–∏—ò–∏, –∫–∞–æ –∏ —Å—Ç–µ–ø–µ–Ω–∞—Å—Ç–∏ —Å–∏—Å—Ç–µ–º —Ü–∏—Ç–æ—Ö—Ä–æ–º –æ–∫—Å–∏–¥–∞–∑–∞ –Ω–∞ –Ω–∏–≤–æ—É –º–∏—Ç–æ—Ö–æ–Ω–¥—Ä–∏—ò–µ.[3] –ü–µ—Ç–∞ –ª–∏–Ω–∏—ò–∞ - –∞–Ω—Ç–∏–æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–∞ –æ–¥–±—Ä–∞–Ω–∞–ï–Ω–∑–∏–º—Å–∫–∏ —Å–∏—Å—Ç–µ–º–∏, —á–∏—Å—Ç–∞—á–∏ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–≤–∏—Ö —Ä–∞–¥–∏–∫–∞–ª–∞ —É–Ω—É—Ç–∞—Ä –∏ –≤–∞–Ω —õ–µ–ª–∏—ò–µ: —Å—É–ø–µ—Ä–æ–∫—Å–∏–¥ –¥–∏—Å–º—É—Ç–∞–∑–∞ (SOD –∏ ECSOD), –ö–∞—Ç–∞–ª–∞–∑–∞ (–ö–ê–¢), –≥–ª—É—Ç–∞—Ç–∏–æ–Ω –ø–µ—Ä–æ–∫—Å–∏–¥–∞–∑–∞ (GSH-Px) –∏ –≥–ª—É—Ç–∞—Ç–∏–æ–Ω —Ä–µ–¥—É–∫—Ç–∞–∑–µ (–ì–Ý)), –±–∏—Ç–Ω–∏ —Å—É –º–µ—Ö–∞–Ω–∏–∑–º–∏ –∑–∞—à—Ç–∏—Ç–∏—Ç–µ –æ—Ä–≥–∞–Ω–∏–∑–º–∞ —É —Ö–∏–ø–µ—Ä–æ–∫—Å–∏—ò–∏ —ò–µ—Ä –Ω–µ—É—Ç—Ä–∞–ª–∏—à—É —Å—É–ø–µ—Ä–æ–∫—Å–∏–¥–Ω–µ –∞–Ω—ò–æ–Ω–µ, –≤–æ–¥–æ–Ω–∏–∫ –ø–µ—Ä–æ–∫—Å–∏–¥ –∏ –ª–∏–ø–∏–¥–Ω–µ –ø–µ—Ä–æ–∫—Å–∏–¥–µ. –ü–æ—Ä–µ–¥ –æ–≤–µ –≥–ª–∞–≤–Ω–µ –ø–æ—Å—Ç–æ—ò–∏ –∏ –ø–æ–º–æ—õ–Ω–∞, –µ–≥–∑–æ–≥–µ–Ω–∞ –ª–∏–Ω–∏—ò–∞ –∞–Ω—Ç–∏–æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–µ –æ–¥–±—Ä–∞–Ω–µ, –∫–æ—ò—É —á–∏–Ω–µ –Ω–µ–µ–Ω–∑–∏–º—Å–∫–µ –º–∞—Ç–µ—Ä–∏—ò–µ –∫–æ—ò–µ –Ω–µ—É—Ç—Ä–∞–ª–∏—à—É —Å–ª–æ–±–æ–¥–Ω–µ —Ä–∞–¥–∏–∫–∞–ª–µ (–Ω–ø—Ä.–≤–∏—Ç–∞–º–∏–Ω –ï, –≤–∏—Ç–∞–º–∏–Ω –¶, –≥–ª—É—Ç–∞—Ç–∏–æ–Ω (GHS), –∫–æ–µ–Ω–∑–∏–º -Q10). –ï—Ç–∏–æ–ª–æ–≥–∏—ò–∞–ü—Ä–µ–º–∞ –Ω–∞—á–∏–Ω—É –Ω–∞—Å—Ç–∞–Ω–∫–∞–£ –∫–ª–∏–Ω–∏—á–∫–æ—ò –ø—Ä–∞–∫—Å–∏ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–æ–Ω–∏–∫, –º–æ–≥—É –Ω–∞—Å—Ç–∞—Ç–∏ –Ω–∞ —ò–µ–¥–∞–Ω –æ–¥ —Å–ª–µ–¥–µ—õ–∞ –¥–≤–∞ –Ω–∞—ò—á–µ—à—õ–∞ –Ω–∞—á–∏–Ω–∞; –ü—Ä–≤–∏ –Ω–∞—á–∏–Ω ‚Äì –∫–∞–¥–∞ —ò–µ –ø–∞—Ü–∏—ò–µ–Ω—Ç –∏–∑–ª–æ–∂–µ–Ω –≤–µ–æ–º–∞ –≤–∏—Å–æ–∫–∏–º –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∞–º–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –∑–∞ –∫—Ä–∞—õ–µ –≤—Ä–µ–º–µ, –Ω–ø—Ä. —Ç–æ–∫–æ–º —Ö–∏–ø–µ—Ä–±–∞—Ä–∏—á–Ω–µ —Ç–µ—Ä–∞–ø–∏—ò–µ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º (–•–ë–û–¢) –∫–æ—ò–∞ —Å–µ —Å–ø—Ä–æ–≤–æ–¥–∏ –Ω–∞ –ø—Ä–∏—Ç–∏—Å–∫—É —É –≤–∏—à–µ–º –æ–¥ –∞—Ç–º–æ—Å—Ñ–µ—Ä—Å–∫–æ–≥ –ø—Ä–∏—Ç–∏—Å–∫–∞, –∫–æ—ò–∏ —É –ø—Ä–æ—Å–µ–∫—É –æ–±–∏—á–Ω–æ –∏–∑–Ω–æ—Å–∏ –æ–¥ 1,5-2,5 –±–∞—Ä-–∞. –ü—Ä–æ—Å–µ—á–Ω–æ —Ç—Ä–∞—ò–∞—ö–µ –•–ë–û–¢ —ò–µ 60-90 –º–∏–Ω—É—Ç–∞, –∏ –ø—Ä–∏–º–µ—ö—É—ò–µ —Å–µ —É —ò–µ–¥–Ω–æ–¥–Ω–µ–≤–Ω–∏–º —Ü–∏–∫–ª—É—Å–∏–º–∞ –ø—Ä–æ—Å–µ—á–Ω–æ 15 –¥–∞–Ω–∞. –ù–∞ –æ—Å–Ω–æ–≤—É –±—Ä–æ—ò–Ω–∏—Ö –∏—Å—Ç—Ä–∞–∂–∏–≤–∞—ö–∞ —Ç–æ–∫—Å–∏—á–Ω–æ –¥–µ—ò—Å—Ç–≤–æ —Ö–∏–ø–µ—Ä–±–∞—Ä–∏—á–Ω–æ–≥ –∫–∏—Å–µ–æ–Ω–∏–∫, –æ–±–∏—á–Ω–æ –º–æ–∂–µ –ø–æ—á–µ—Ç–∏ —Ç–µ–∫ –Ω–∞ –Ω–∞ –ø–∞—Ä—Ü–∏—ò–∞–ª–Ω–æ–º –ø—Ä–∏—Ç–∏—Å–∫—É –æ–¥ 50 kPa, –∫–æ—ò–∏ —ò–µ 2,5 –ø—É—Ç–∞ –≤–µ—õ–∏ –æ–¥ ‚Äû–Ω–æ –º–µ—í—É—Ç–∏–º–∞ –∞–∫–æ —Å–µ –•–ë–û–¢ –ø—Ä–∏–º–µ—ö—É—ò–µ –¥—É–∂–µ –≤—Ä–µ–º–µ, –≤–µ–ª–∏–∫–∏ –±—Ä–æ—ò –¥–∞–Ω–∞ –∏–ª–∏ —É –≤–µ—õ–µ–º –±—Ä–æ—ò—É —ò–µ–¥–Ω–æ–¥–Ω–µ–≤–Ω–∏—Ö —Å–µ–∞–Ω—Å–∏, –ø–æ–Ω–µ–∫–∞–¥ —á–∞–∫ –∏ –∫—Ä–∞—õ–µ —Ç—Ä–∞—ò–∞—ö–µ, —Ç–µ—Ä–∞–ø–∏—ò–µ –º–æ–∂–µ –¥–æ–≤–µ—Å—Ç–∏ –¥–æ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º –Ω–∞ –Ω–∏–∂–∏–º –ø—Ä–∏—Ç–∏—Å—Ü–∏–º–∞.[17] –î—Ä—É–≥–∏ –Ω–∞—á–∏–Ω ‚Äì –∫–∞–¥–∞ —ò–µ –ø–∞—Ü–∏—ò–µ–Ω—Ç –∏–∑–ª–æ–∂–µ–Ω –Ω–∏–∂–æ—ò –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∏ –≥–∞—Å–∞, –∞–ª–∏ —Å–µ –æ–Ω –∫–æ—Ä–∏—Å—Ç–∏ —É –¥—É–∂–µ–º –≤—Ä–µ–º–Ω–µ–Ω—Å–∫–æ–º –ø–µ—Ä–∏–æ–¥—É.  –ü—Ä–µ–º–∞ –æ—Ä–≥–∞–Ω—É–¢—Ä–æ–≤–∞—ö–µ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º, –Ω–∞ –æ—Å–Ω–æ–≤—É –æ—Ä–≥–∞–Ω–∞, —É –∫–æ–º–µ —ò–µ –ø—Ä–æ–∏–∑–≤–µ–æ –ø–æ—Å–ª–µ–¥–∏—Ü–µ, –º–æ–∂–µ —Å–µ –ø–æ–¥–µ–ª–∏—Ç–∏, –Ω–∞ —Ç—Ä–∏ –≥–ª–∞–≤–Ω–∞ –æ–±–ª–∏–∫–∞:[6][18][19]
–ï–ø–∏–¥–µ–º–∏–æ–ª–æ–≥–∏—ò–∞–û—Å–∏–º –∞–∫–æ –Ω–∏—ò–µ –Ω–∞—Å—Ç–∞–ª–æ —É—Å–ª–µ–¥ –∫–≤–∞—Ä–∞ –æ–ø—Ä–µ–º–µ –∏ —ô—É–¥—Å–∫–µ –≥—Ä–µ—à–∫–µ, —Ç—Ä–æ–≤–∞—ö–µ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º –¥–∞–Ω–∞—Å —ò–µ –ø–æ—Å—Ç–∞–ª–∞ —Ä–µ—Ç–∫–∞ –ø–æ—ò–∞–≤–∞, –∑–±–æ–≥ –≤–µ—õ–∏—Ö —Å–∞–∑–Ω–∞—ö–∞ –æ –æ–≤–æ–º –ø—Ä–æ–±–ª–µ–º—É, –∫–æ—ò–∞ —Å–≤–µ –≤–∏—à–µ –¥–æ–≤–æ–¥–µ –¥–æ –ø—Ä–∏–º–µ–Ω–µ –ø—Ä–µ–≤–µ–Ω—Ç–∏–≤–Ω–∏—Ö –º–µ—Ä–∞ —É —Ç–æ–∫—É —ö–µ–≥–æ–≤–µ –ø—Ä–∏–º–µ–Ω–µ, –∫–∞–æ —à—Ç–æ —Å—É;[20][21]
–ü–æ—ò–∞–≤—É —Å–≤–µ –º–∞—ö–µ —É—á–µ—Å—Ç–∞–ª–æ—Å—Ç–∏ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º —É —Å–≤–µ—Ç—É –ø–æ—Ç–≤—Ä—í—É—ò—É –æ–≤–∏ –ø–æ–¥–∞—Ü–∏;
–Ý–æ—ö–µ—ö–µ  –î–æ –î—Ä—É–≥–æ–≥ —Å–≤–µ—Ç—Å–∫–æ–≥ —Ä–∞—Ç–∞ —Ä–æ–Ω–∏–ª–∞—á–∫–µ –±–æ—Ü–µ —Å—É –ø—É—ö–µ–Ω–µ —É–≥–ª–∞–≤–Ω–æ–º —á–∏—Å—Ç–∏–º (100%) –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º —Ç–µ —ò–µ –∏ –∏–Ω—Ü–∏–¥–µ–Ω—Ü–∞ —Ç–æ–∫—Å–∏—á–Ω–æ–≥ –¥–µ—ò—Å—Ç–≤–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ —Ü–µ–Ω—Ç—Ä–∞–ª–Ω–∏ –Ω–µ—Ä–≤–Ω–∏ —Å–∏—Å—Ç–µ–º, –º–µ—í—É —Ä–æ–Ω–∏–æ—Ü–∏–º–∞ –±–∏–ª–∞ —ò–∞–∫–æ —á–µ—Å—Ç–∞. –ù–∞–∫–æ–Ω –î—Ä—É–≥–æ–≥ —Å–≤–µ—Ç—Å–∫–æ–≥ —Ä–∞—Ç–∞, —Å–≤–µ –≤–∏—à–µ —Å–µ —É —Ä–æ—ö–µ—ö—É –ø—Ä–∏–º–µ—ö—É—ò—É –ø—Ä–æ—Ç–æ–∫–æ–ª–∏ –∫–æ—ò–∏ –æ–≥—Ä–∞–Ω–∏—á–∞–≤–∞—ò—É –ø—Ä–∏–º–µ–Ω—É 100% –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ –ø–æ–≤–∏—à–µ–Ω–æ–º –ø—Ä–∏—Ç–∏—Å–∫—É. –ì–æ–¥–∏–Ω–µ 1947, –ø–æ—Å–µ–±–Ω–∏–º –ø—Ä–µ–ø–æ—Ä—É–∫–∞–º–∞ –æ–≥—Ä–∞–Ω–∏—á–∞–≤–∞ —Å–µ –¥—É–±–∏–Ω–∞ –¥–æ –∫–æ—ò–µ —ò–µ –ø—Ä–µ–ø–æ—Ä—É—á–µ–Ω–æ –¥–∏—Å–∞—ö–µ —á–∏—Å—Ç–æ–≥ –∫–∏—Å–µ–æ–Ω–∏–∫–∞, –¥–æ 7,6 m, –∞ ppO2 –Ω–∞ 1,8 –±–∞—Ä–∞ (180 kPa).[25] –î–∞–Ω–∞—Å —Ç–∞ –æ–≥—Ä–∞–Ω–∏—á–µ—ö–µ —Å—É —ò–æ—à –≤–∏—à–µ —Å–º–∞—ö–∏–ª–∞ –≥—Ä–∞–Ω–∏—Ü—É, –ø—Ä–µ–ø–æ—Ä—É—á–µ–Ω–æ–≥ppO2 –Ω–∞ 1,4 –±–∞—Ä–∞ (140 kPa), –∑–∞ —Ä–µ–∫—Ä–µ–∞—Ç–∏–≤–Ω–µ —Ä–æ–Ω–∏–æ—Ü–µ –∏ 1,6 –±–∞—Ä–∞ (160 kPa) —Ç–æ–∫–æ–º –ø–æ—Å—Ç—É–ø–∫–∞ –¥–µ–∫–æ–º–ø—Ä–µ—Å–∏—ò–µ –ø—Ä–∏ –∏–∑—Ä–æ—ö–∞–≤–∞—ö—É. –ú–µ—í—É –ø—Ä–≤–∏–º–∞ —ò–µ (–µ–Ω–≥–ª. U.S. Navy - –ê–º–µ—Ä–∏—á–∫–∞ –º–æ—Ä–Ω–∞—Ä–∏—Ü–∞), –ø—Ä–∏—Ö–≤–∞—Ç–∏–ª–∞ –ø—Ä–æ—Ç–æ–∫–æ–ª —Ä–æ—ö–µ—ö–∞ —É–∑ –∫–æ—Ä–∏—à—õ–µ—ö–µ –º–µ—à–∞–≤–∏–Ω–µ —Ö–µ–ª–∏—ò—É–º-–∫–∏—Å–µ–æ–Ω–∏–∫, –ø—Ä–µ–º–∞ –ø–æ—Å–µ–±–Ω–∏–º —Ç–∞–±–µ–ª–∞–º–∞. –ü—Ä–∏–º–µ–Ω–∞ —Ç–æ–≥ –ø—Ä–æ—Ç–æ–∫–æ–ª–∞ –∏–∑–º–µ—í—É 1995. –∏ 1999, –ø–æ–∫–∞–∑–∞–ª–∞ —ò–µ –¥–∞ —Å—É –∑–Ω–∞—Ü–∏ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º —É–æ—á–µ–Ω–∏ —Å–∞–º–æ –∫–æ–¥ 6 —Ä–æ–Ω–∏–ª–∞—Ü–∞ –∏–ª–∏ —É (1,5%) –∑–∞—Ä–æ–Ω–∞.[26] [27] –ê–º–µ—Ä–∏—á–∫–∞ –º–æ—Ä–Ω–∞—Ä–∏—Ü–∞ —ò–µ 2000. —Å–ø—Ä–æ–≤–µ–ª–∞ –æ–ø—Å–µ–∂–Ω–∞ –∏—Å—Ç—Ä–∞–∂–∏–≤–∞—ö–∞ –Ω–∞ 150 –∑–∞—Ä–æ–Ω–∞, –æ–¥ –∫–æ—ò–∏—Ö –Ω–∏—ò–µ–¥–∞–Ω –Ω–∏—ò–µ –∏–∑–∞–∑–≤–∞–æ —Å–∏–º–ø—Ç–æ–º–µ —Ç–æ–∫—Å–∏—á–Ω–æ–≥ –¥–µ—ò—Å—Ç–≤–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞. –ö–∞–æ —Ä–µ–∑—É–ª—Ç–∞—Ç –æ–≤–∏—Ö –∏ –¥—Ä—É–≥–∏—Ö –∏—Å—Ç—Ä–∞–∂–∏–≤–∞—ö–∞ 2001. –æ–±—ò–∞–≤—ô–µ–Ω–µ —Å—É –Ω–æ–≤–µ —Ä–µ–≤–∏–¥–∏—Ä–∞–Ω–µ —Ç–∞–±–ª–∏—Ü–µ –∑–∞ —É–ø–æ—Ç—Ä–µ–±—É —Å–º–µ—à–µ —Ö–µ–ª–∏—É–º-–∫–∏—Å–µ–æ–Ω–∏–∫ —É —Ä–æ—ö–µ—ö—É, –∫–æ—ò–µ —Å—É —ò–æ—à –≤–∏—à–µ —Å–º–∞—ö–∏–ª–µ –±—Ä–æ—ò –Ω–µ–∂–µ—ô–µ–Ω–∏—Ö —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º —É —Ç–æ–∫—É –∑–∞—Ä–æ–Ω–∞.[28] –•–ë–û–¢–£ —Ç–æ–∫—É —Ç–µ—Ä–∞–ø–∏—ò–µ 100% –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ –ø–æ–≤–∏—à–µ–Ω–æ–º –ø—Ä–∏—Ç–∏—Å–∫—É (–•–ë–û–¢), —Ç–æ–∫—Å–∏—á–Ω–µ –ø—Ä–æ–º–µ–Ω–µ –Ω–∞ —Ü–µ–Ω—Ç—Ä–∞–ª–Ω–æ–º –Ω–µ—Ä–≤–Ω–æ–º —Å–∏—Å—Ç–µ–º—É –∫–æ–¥ –±–æ–ª–µ—Å–Ω–∏–∫–∞ –∏–∑—É–∑–µ—Ç–Ω–æ —ò–µ —Ä–µ—Ç–∫–∞. –ù–∞ —Å—Ç–æ–ø—É —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º –Ω–∞ –ø–æ–≤–∏—à–µ–Ω–æ–º –ø—Ä–∏—Ç–∏—Å–∫—É —É—Ç–∏—á–µ –≤–∏—à–µ —Ñ–∞–∫—Ç–æ—Ä–∞;
–°—Ç—É–¥–∏—ò–∞ –∫–æ—ò—É —ò–µ —Å–ø—Ä–æ–≤–µ–æ (–µ–Ω–≥–ª. Welslau) —É 1996. –Ω–∞ –æ—Å–Ω–æ–≤—É –ø—Ä–∏—ò–∞–≤—ô–µ–Ω–∏—Ö –∏–Ω—Ü–∏–¥–µ–Ω–∞—Ç–∞, —Ç—Ä–æ–≤–∞—ö–µ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º —ò–∞–≤–∏–ª–æ —Å–µ –∫–æ–¥ 16 —Å–ª—É—á–∞—ò–µ–≤–∞ –æ–¥ 107.264 –ø–∞—Ü–∏—ò–µ–Ω–∞—Ç–∞ (0,015%), –¥–æ–∫ —Å—É –•–∞–º–ø—Å–æ–Ω –∏ –ê—Ç–∏–∫ —É 2003. –ø—Ä–æ–Ω–∞—à–ª–∏ –¥–∞ —ò–µ —Ç–∞ —Å—Ç–æ–ø–∞ 0,03%.[29][30] –£ —Å—Ç—É–¥–∏—ò–∏ (–µ–Ω–≥–ª. Yildiz, Ay –∏ Qyrdedi), –Ω–∞–≤–æ–¥–∏ —Å–µ –¥–∞ —ò–µ –∫–æ–¥ 36.500 –±–æ–ª–µ—Å–Ω–∏–∫–∞ —Ç—Ä–µ—Ç–∏—Ä–∞–Ω–∏—Ö (–•–ë–û–¢) –∏–∑–º–µ—í—É 1996. –∏ 2003, –±–∏–ª–æ —Å–∞–º–æ 3 –ø—Ä–∏—ò–∞–≤—ô–µ–Ω–∏—Ö –∏–Ω—Ü–∏–¥–µ–Ω–∞—Ç–∞ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º, —à—Ç–æ –¥–∞—ò–µ —Å—Ç–æ–ø—É —É—á–µ—Å—Ç–∞–ª–æ—Å—Ç–∏ –æ–¥ —Å–≤–µ–≥–∞ 0,008%. –ù–µ—à—Ç–æ –∫–∞—Å–Ω–∏—ò–µ –æ–±—ò–∞–≤—ô–µ–Ω–∏ –ø–æ–¥–∞—Ü–∏ –Ω–∞–∫–æ–Ω –ø—Ä–µ–≥–ª–µ–¥–∞ –ø—Ä–µ–∫–æ 80.000 –±–æ–ª–µ—Å–Ω–∏–∫–∞ –ª–µ—á–µ–Ω–∏—Ö (–•–ë–û–¢) –ø–æ–∫–∞–∑–∞–ª–∞ —Å—É —á–∞–∫ –∏ –Ω–∏–∂–∞—É —Å—Ç–æ–ø—É: 0,0024%. –°–º–∞—ö–µ—ö–µ–Ω–∞ —É—á–µ—Å—Ç–∞–ª–æ—Å—Ç —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º —É —Ç–æ–∫—É (–•–ë–û–¢), –º–æ–∂–µ –±–∏—Ç–∏ –¥–µ–ª–∏–º–∏—á–Ω–æ –∑–±–æ–≥; —É–ø–æ—Ç—Ä–µ–±–µ –∫–∏—Å–µ–æ–Ω–∏—á–∫–µ –º–∞—Å–∫–µ (—É–º–µ—Å—Ç–æ —Ö–∞—É–±–µ) –ø—Ä–µ–∫–æ –∫–æ—ò–µ —Å–µ —É–¥–∏—à–µ –∫–∏—Å–µ–æ–Ω–∏–∫.[31] –ü–µ–¥–∏—ò–∞—Ç—Ä–∏—ò–∞–ü—Ä–∏–º–µ–Ω–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É –ø–µ–¥–∏—ò–∞—Ç—Ä–∏—ò–∏ –º–æ–∂–µ –±–∏—Ç–∏ –ø—Ä–∞—õ–µ–Ω–∞;
–ü–∞—Ç–æ—Ñ–∏–∑–∏–æ–ª–æ–≥–∏—ò–∞–â—É–¥—Å–∫–∏ –æ—Ä–≥–∞–Ω–∏–∑–∞–º —ò–µ –∫–∞–æ –∏ —Å–≤–∏ –∞–µ—Ä–æ–±–Ω–∏ –æ—Ä–≥–∞–Ω–∏–∑–º–∏, —Å—Ç–∞–ª–Ω–æ —ò–µ –∏–∑–ª–æ–∂–µ–Ω –Ω–µ–ø–æ–≤–æ—ô–Ω–∏–º –µ—Ñ–µ–∫—Ç–∏–º–∞ —Å—Ç–≤–∞—Ä–∞—ö–∞ —Ä–µ–∞–∫—Ç–∏–≤–Ω–∏—Ö –∫–∏—Å–µ–æ–Ω–∏—á–∫–∏—Ö –≤—Ä—Å—Ç–∞ (–Ý–ö–í), –Ω–∞—Ä–æ—á–∏—Ç–æ —Ä–µ–∞–∫—Ç–∏–≤–Ω–∏—Ö —Å–ª–æ–±–æ–¥–Ω–∏—Ö –∫–∏—Å–µ–æ–Ω–∏—á–∫–∏—Ö —Ä–∞–¥–∏–∫–∞–ª–∞ (–°–ö–Ý). –°–ª–æ–±–æ–¥–Ω–µ –∫–∏—Å–µ–æ–Ω–∏—á–∫–µ —Ä–∞–¥–∏–∫–∞–ª–µ –æ—Ç–∫—Ä–∏–æ —ò–µ 1954. (–µ–Ω–≥–ª. Gerschman) —Å–∞ —Å–∞—Ä–∞–¥–Ω–∏—Ü–∏–º–∞, –∫–æ—ò–∏ —Å—É –∏—Ö –æ–∑–Ω–∞—á–∏–ª–∏ –∫–∞–æ –≤–µ—Ä–æ–≤–∞—Ç–Ω–∏ –µ—Ç–∏–æ–ª–æ—à–∫–∏ —Ñ–∞–∫—Ç–æ—Ä —É —Ä–∞–∑–≤–æ—ò—É —Ç–æ–∫—Å–∏—á–Ω–∏—Ö –µ—Ñ–µ–∫–∞—Ç–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞.[34] –°–ª–æ–±–æ–¥–Ω–∏ –∫–∏—Å–µ–æ–Ω–∏—á–∫–∏ —Ä–∞–¥–∏–∫–∞–ª–∏ (–°–ö–Ý) —Å—É —Ä–µ–∞–∫—Ç–∏–≤–Ω–µ –≤—Ä—Å—Ç–µ –∫–∏—Å–µ–æ–Ω–∏–∫–∞, –∫–æ—ò–µ —Å–µ —Å–∞—Å—Ç–æ—ò–µ –æ–¥ –∞—Ç–æ–º–∞, –º–æ–ª–µ–∫—É–ª–∞ –∏–ª–∏ —ò–æ–Ω–∞ –∫–æ—ò–∏ –∏–º–∞—ò—É —ò–µ–¥–∞–Ω –∏–ª–∏ –≤–∏—à–µ –Ω–µ—Å–ø–∞—Ä–µ–Ω–∏—Ö –µ–ª–µ–∫—Ç—Ä–æ–Ω–∞ —É —Å–≤–æ—ò–æ—ò —Å—Ç—Ä—É–∫—Ç—É—Ä–∏.[35] –û–Ω–∏ —Å—É –≤–∏—Å–æ–∫–æ —Ä–µ–∞–∫—Ç–∏–≤–Ω–∏ –∑–±–æ–≥ –ø—Ä–∏—Å—É—Å—Ç–≤–∞ —ò–µ–¥–Ω–æ–≥ –Ω–µ—Å–ø–∞—Ä–µ–Ω–æ–≥ –µ–ª–µ–∫—Ç—Ä–æ–Ω–∞. –ò —Å–∞–º –º–æ–ª–µ–∫—É–ª –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –∏–º–∞ –¥–≤–∞ –Ω–µ—Å–ø–∞—Ä–µ–Ω–∞ –µ–ª–µ–∫—Ç—Ä–æ–Ω–∞ —Å–∞ –∏—Å—Ç–∏–º —Å–ø–∏–Ω—Å–∫–∏–º –±—Ä–æ—ò–µ–≤–∏–º–∞ —É —Å–ø–æ—ô–Ω–∏–º –æ—Ä–±–∏—Ç–∞–º–∞ –∏ —Ç–µ—à–∫–æ –ø—Ä–∏–º–∞ –µ–ª–µ–∫—Ç—Ä–æ–Ω—Å–∫–∏ –ø–∞—Ä –¥–æ–Ω–æ—Ä–∞.[15]
–ü–æ–¥ —É—Ç–∏—Ü–∞—ò–µ–º —Å–ø–æ—ô–∞—à—ö–∏—Ö —Å—Ç—Ä–µ—Å–Ω–∏—Ö —É—Ç–∏—Ü–∞—ò–∞ –º–æ–∂–µ –¥–æ—õ–∏ –¥–æ –¥—Ä–∞–º–∞—Ç–∏—á–Ω–æ–≥ –ø–æ–≤–µ—õ–∞—ö–∞ —Å–ª–æ–±–æ–¥–Ω–∏—Ö —Ä–∞–¥–∏–∫–∞–ª–∞, —à—Ç–æ –º–æ–∂–µ –¥–æ–≤–µ—Å—Ç–∏ –¥–æ –∑–Ω–∞—á–∞—ò–Ω–∏—Ö –æ—à—Ç–µ—õ–µ—ö–∞ —õ–µ–ª–∏—ò—Å–∫–∏—Ö —Å—Ç—Ä—É–∫—Ç—É—Ä–∞ .[36] –û–¥ —É–Ω–µ—Ç–µ –∫–æ–ª–∏—á–∏–Ω–µ –∞—Ç–º–æ—Å—Ñ–µ—Ä—Å–∫–æ–≥ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ (–∫–æ—ò–µ–≥ —É –≤–∞–∑–¥—É—Ö—É –∏–º–∞ 21%) —É –æ—Ä–≥–∞–Ω–∏–∑–º—É —Å–µ 5% –¥–æ 10% –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–µ–ø–æ—Ç–ø—É–Ω–æ —Ä–µ–¥—É–∫—É—ò–µ —É —Ä–µ–∞–∫—Ç–∏–≤–Ω–µ –∫–∏—Å–µ–æ–Ω–∏—á–∫–µ –≤—Ä—Å—Ç–µ (–Ý–ö–í), –Ω–∞—ò–≤–µ—õ–∏–º –¥–µ–ª–æ–º —É —Å–ª–æ–±–æ–¥–Ω–µ –∫–∏—Å–µ–æ–Ω–∏—á–∫–µ —Ä–∞–¥–∏–∫–∞–ª–µ (–°–ö–Ý).[35] –£–¥–∏—Å–∞—ö–µ 100% –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ 1 –ê–¢–ê –º–æ–∂–µ –∏–∞–∑–≤–∞—Ç–∏ –Ω–µ–∂–µ—ô–µ–Ω–µ –æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–µ –ø—Ä–æ—Ü–µ—Å–µ –ø–æ–¥ —É—Ç–∏—Ü–∞—ò–µ–º —Å–ª–æ–±–æ–¥–Ω–∏—Ö —Ä–∞–¥–∏–∫–∞–ª–∞, –∫–æ—ò–∏ –º–æ–≥—É —É–º–∞—ö–∏—Ç–∏ –∞–∫—Ç–∏–≤–Ω–æ—Å—Ç —Ä–∞–∑–Ω–∏—Ö —õ–µ–ª–∏—ò–∞, (—Ä–∞–∑–∞—Ä–∞—ö–µ–º –º–æ–ª–µ–∫—É–ª–∞, –µ–Ω–∑–∏–º–∞, –ø—Ä–æ—Ç–µ–∏–Ω–∞ –ø–∞ –∏ —Ü–µ–ª–∏—Ö —õ–µ–ª–∏—ò–∞). –ü–æ—Ä–µ–º–µ—õ–∞—ò–∏ –∫–æ—ò–∏ –∫–∏—Å–µ–æ–Ω–∏—á–∫–∏ —Ä–∞–¥–∏–∫–∞–ª–∏ –º–æ–≥—É –¥–∞ –∏–∑–∞–∑–æ–≤—É —É —õ–µ–ª–∏—ò–∏ —Å—É;[37]
–ö–∞–æ –∫—Ä–∞—ò—ö–∏ –∏—Å—Ö–æ–¥ –¥–µ—ò—Å—Ç–≤–∞ –∫–∏—Å–µ–æ–Ω–∏—á–∫–∏—Ö —Ä–∞–¥–∏–∫–∞–ª–∞ —É –æ—Ä–≥–∞–Ω–∏–∑–º—É, –º–æ–≥—É –Ω–∞—Å—Ç–∞—Ç–∏, —Ç–æ–∫—Å–∏—á–Ω–∞ –æ—à—Ç–µ—õ–µ—ö–∞ –Ω–∞ —Å—Ç—Ä—É–∫—Ç—É—Ä–∞–º–∞ —õ–µ–ª–∏—ò–∞ —à—Ç–æ –¥–æ–≤–æ–¥–∏ –¥–æ —ö–∏—Ö–æ–≤–µ —É–º–∞—ö–µ–Ω–µ —Ñ—É–Ω–∫—Ü–∏—ò–µ –∏ —Å–∞–º–æ—Ä–µ–≥—É–ª–∞—Ü–∏—ò–µ. –ó–∞ –∫–æ–Ω—Ç—Ä–æ–ª—É (–Ý–ö–í) –æ—Ä–≥–∞–Ω–∏–∑–∞–º —ò–µ –º–æ—Ä–∞–æ —Ä–∞–∑–≤–∏—Ç–∏ –∞–Ω—Ç–∏–æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–∏ –æ–¥–±—Ä–∞–º–±–µ–Ω–∏ —Å–∏—Å—Ç–µ–º (–ê–û–î–°), —Å–∞—Å—Ç–∞–≤—ô–µ–Ω –æ–¥ –≤–∏—à–µ –Ω–∏–≤–æ–∞. –û—Ä–≥–∞–Ω–∏–∑–∞–º –∏–∑–ª–æ–∂–µ–Ω –≤–µ–ª–∏–∫–∏–º –∫–æ–ª–∏—á–∏–Ω–∞–º–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ (–∫–æ—ò–∞ –≤–ª–∞–¥–∞ —É —Ö–∏–ø–µ—Ä–æ–∫—Å–∏—ò–∏) –º–æ–∂–µ –≥–∞ –ø—Ä–∏—Å–∏–ª–∏—Ç–∏ –¥–∞ —Å—Ç–≤–∞—Ä–∞ (–Ý–ö–í) —É –≤–µ–ª–∏–∫–∏–º –∫–æ–ª–∏—á–∏–Ω–∞–º–∞ —à—Ç–æ —Ç—Ä–∞–∂–∏ –ø–æ–≤–µ—õ–∞–Ω–æ –∞–Ω–≥–∞–∂–æ–≤–∞—ö–µ (–ê–û–î–°). –ê–Ω—Ç–∏–æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–∏ –æ–¥–±—Ä–∞–º–±–µ–Ω–∏ —Å–∏—Å—Ç–µ–º (–ê–û–î–°) –ø–æ—Å–µ–¥—É—ò–µ —Å–æ–ø—Å—Ç–≤–µ–Ω–∏ —Ä–µ–¥–æ–∫—Å –∫–∞–ø–∞—Ü–∏—Ç–µ—Ç –∑–∞ —É–∫–ª–∞—ö–∞—ö–∞ —Ä–µ–∞–∫—Ç–∏–≤–Ω–∏—Ö –∫–∏—Å–µ–æ–Ω–∏—á–∫–∏—Ö –≤—Ä—Å—Ç–∞ (–Ý–ö–í), –∞ —Ç–∞–∫–æ—í–µ –∏ —Å–ø–æ—Å–æ–±–Ω–æ—Å—Ç –ø–æ–ø—Ä–∞–≤–∫–µ –≤–µ—õ –Ω–∞—Å—Ç–∞–ª–∏—Ö –æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–∏—Ö –æ—à—Ç–µ—õ–µ—ö–∞ –∏ –∫–æ—ò–∏ —É–≥–ª–∞–≤–Ω–æ–º –∑–∞–≤–∏—Å–∏ –æ–¥ –∏–Ω–¥–∏–≤–∏–¥—É–∞–ª–Ω–æ–≥ –∞–Ω—Ç–∏–æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–æ–≥ —Å—Ç–∞—Ç—É—Å–∞ –æ—Ä–≥–∞–Ω–∏–∑–º–∞. –ò—Å—Ü—Ä–ø—ô–∏–≤–∞—ö–µ –∏–ª–∏ –Ω–µ—Å–ø–æ—Å–æ–±–Ω–æ—Å—Ç (–ê–û–î–°) —É –æ–¥–±—Ä–∞–Ω–∏ –∏–º–∞ –∑–∞ –ø–æ—Å–ª–µ–¥–∏—Ü—É –ø—Ä–æ–ø–∞–≥–∞—Ü–∏—ò—É –Ω–µ–∫–æ–Ω—Ç—Ä–æ–ª–∏—Å–∞–Ω–∏—Ö (–Ý–ö–í) –∏ –ø–æ—ò–∞–≤—É –æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–æ–≥ —Å—Ç—Ä–µ—Å–∞ —É –æ—Ä–≥–∞–Ω–∏–∑–º—É, —à—Ç–æ –º–æ–∂–µ –±–∏—Ç–∏ —É–∑—Ä–æ–∫ –≤—Ä–ª–æ –æ–∑–±–∏—ô–Ω–∏—Ö –æ—à—Ç–µ—õ–µ—ö–∞ –∏ –ø–∞—Ç–æ–ª–æ—à–∫–∏—Ö —Å—Ç–∞—ö–∞ –æ—Ä–≥–∞–Ω–∏–∑–º–∞.[38] –ó–Ω–∞—ò—É—õ–∏ –¥–∞ —ò–µ —Å—Ç–∞—ö–µ (–ê–û–î–°) —É —Å–≤–∞–∫–æ–º –ø–æ—ò–µ–¥–∏–Ω–∞—á–Ω–æ–º —Å–ª—É—á–∞—ò—É —Ä–∞–∑–ª–∏—á–∏—Ç–æ, —Ç–æ –∑–∞—Ö—Ç–µ–≤–∞ —É —Ç–æ–∫—É –¥—É–≥–æ—Ç—Ä–∞—ò–Ω–µ –ø—Ä–∏–º–µ–Ω–µ —Ö–∏–ø–µ—Ä–æ–∫—Å–∏—ò–µ –Ω–∞ –Ω–æ—Ä–º–∞–ª–Ω–æ–º –∏–ª–∏ –ø–æ–≤–∏—à–µ–Ω–æ–º –ø—Ä–∏—Ç–∏—Å–∫—É, —Å—Ç–∞–ª–Ω–∏ –∏ –¥–∏—Ä–µ–∫—Ç–Ω–∏ –º–æ–Ω–∏—Ç–æ—Ä–∏–Ω–≥ –∫–∞–∫–æ –≤–∏—Ç–∞–ª–Ω–∏—Ö –ø–∞—Ä–∞–º–µ—Ç–∞—Ä–∞, —Ç–∞–∫–æ –∏ –ø—Ä–µ–º–∞ —É–∫–∞–∑–∞–Ω–æ—ò –ø–æ—Ç—Ä–µ–±–∏, –∏ –æ–¥—Ä–µ—í–∏–≤–∞—ö–µ –º–∞—Ä–∫–µ—Ä–∞ –æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–∏—Ö –æ—à—Ç–µ—õ–µ—ö–∞, –∫–∞–∫–æ –±–∏ —Å–µ –ø—Ä–∞–≤–æ–≤—Ä–µ–º–µ–Ω–æ –ø—Ä–µ–¥—É–∑–µ–ª–µ –º–µ—Ä–µ –Ω–∞ –ø–æ–±–æ—ô—à–∞—ö—É –∞–Ω—Ç–∏–æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–µ –æ–¥–±—Ä–∞–Ω–µ, –∏–ª–∏ –æ–±—É—Å—Ç–∞–≤–∏–ª–æ —Å–∞ –¥–∞—ô–æ–º –ø—Ä–∏–º–µ–Ω–æ–º –∫–∏—Å–µ–æ–Ω–∏–∫–∞.[38] –£ –æ–∫–≤–∏—Ä–∏–º–∞ —Ç–µ—Ä–∞–ø–∏—ò—Å–∫–∏—Ö pO2 –∏ –∏–∑—É–∑–µ—Ç–Ω–æ —Ä–µ—Ç–∫–µ –ø—Ä–∏–º–µ–Ω–µ –≤–∏—Å–æ–∫–∏—Ö –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∞ –¥—É–∂–µ –æ–¥ 24-48 —á–∞—Å–æ–≤–∞, –ø—Ä–∞–∫—Ç–∏—á–Ω–æ –Ω–µ–º–∞ –æ–ø–∞—Å–Ω–æ—Å—Ç–∏ –æ–¥ —Ç–æ–∫—Å–∏—á–Ω–∏—Ö –º–∞–Ω–∏—Ñ–µ—Å—Ç–∞—Ü–∏—ò–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞, –∏–∑—É–∑–µ–≤ –∫–æ–¥ –∫—Ä–∞—ò—ö–µ –∏—Å—Ü—Ä–ø—ô–µ–Ω–∏—Ö –æ—Ä–≥–∞–Ω–∏–∑–∞–º–∞ –∫–æ–¥ –∫–æ—ò–∏—Ö —Å—É –æ–∑–±–∏—ô–Ω–æ —É—Ä—É—à–µ–Ω–∏ —Å–∏—Å—Ç–µ–º–∏ –∞–Ω—Ç–∏–æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–µ –æ–¥–±—Ä–∞–Ω–µ, –∏–ª–∏ –∫–æ–¥ –∞–∫—Ü–∏–¥–µ–Ω–∞—Ç–∞ –∑–±–æ–≥ –æ—Ç–∫–∞–∑–∞ –æ–ø—Ä–µ–º–µ. –ö–ª–∞—Å–∏—Ñ–∏–∫–∞—Ü–∏—ò–∞ –∏ –∫–ª–∏–Ω–∏—á–∫–µ –º–∞–Ω–∏—Ñ–µ—Å—Ç–∞—Ü–∏—ò–µ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º–ö–ª–∏–Ω–∏—á–∫–µ –º–∞–Ω–∏—Ñ–µ—Å—Ç–∞—Ü–∏—ò–µ —Ç–æ–∫—Å–∏—á–Ω–∏—Ö –µ—Ñ–µ–∫–∞—Ç–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –∫–ª–∞—Å–∏—Ñ–∏–∫–æ–≤–∞–Ω–µ —Å—É –∫–∞–æ:
–ë–µ—Ä—Ç–æ–≤ –µ—Ñ–µ–∫–∞—Ç–ë–µ—Ä —ò–µ –ø—Ä–≤–æ–±–∏—Ç–Ω–æ –æ–ø–∏—Å–∞–æ –¥–∞ —Å–µ —Ç–æ–∫—Å–∏—á–Ω–æ—Å—Ç –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ (–¶–ù–°), –º–∞–Ω–∏—Ñ–µ—Å—Ç—É—ò–µ –Ω–∞ –ø—Ä–∏—Ç–∏—Å—Ü–∏–º–∞ > 3 –ê–¢–ê, –∞–ª–∏ —Å—É –∫–∞—Å–Ω–∏—ò–∞ –∏—Å—Ç–∞–∂–∏–≤–∞—ö–∞ –ø–æ–∫–∞–∑–∞–ª–∞ –¥–∞ —Å–µ –æ–Ω–∞ –º–æ–∂–µ —ò–∞–≤–∏—Ç–∏ –∏ –Ω–∞ –Ω–∏–∂–∏–º –ø—Ä–∏—Ç–∏—Å—Ü–∏–º–∞ > 2,2 –±–∞—Ä–∞ —à—Ç–æ —É–≥–ª–∞–≤–Ω–æ–º –∑–∞–≤–∏—Å–∏ –æ–¥ –¥—É–∂–∏–Ω–µ –∏–∑–ª–∞–≥–∞—ö–∞. –¢–æ–∫—Å–∏—á–Ω–µ –ø—Ä–æ–º–µ–Ω–µ —É (–¶–ù–°) —É–≥–ª–∞–≤–Ω–æ–º —Å—É –∏–∑–∞–∑–≤–∞–Ω–µ –æ–∫—Å–∏–¥–∞—Ü–∏—ò–æ–º –∏ –ø–æ–ª–∏–º–µ—Ä–∏–∑–∞—Ü–∏—ò–æ–º —õ–µ–ª–∏—ò—Å–∫–∏—Ö –µ–Ω–∑–∏–º–∞, —à—Ç–æ –¥–æ–≤–æ–¥–∏ –¥–æ —ö–∏—Ö–æ–≤–µ –∏–Ω–∞–∫—Ç–∏–≤–∞—Ü–∏—ò–µ, –∏ –¥–æ–≤–æ–¥–∏ –¥–æ –æ—à—Ç–µ—õ–µ—ö–∞ —Ñ—É–Ω–∫—Ü–∏—ò–∞ (–¶–ù–°).
Најчешће су променљиве и испољавају у виду, лаких подрхтавања (фасцикулација) на лицу и врату и грчевима малих мишића на рукама,[39] а код нешто интензивније периферне вазоконстрикције, због хипероксије, и грчева дијафрагме (пречаге) и појавом бледила лица и „испрекиданим“ дисањем,[40][41]
–ü—Ä–∏—Ç–∏—Å–∞–∫ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É —Ü–µ–Ω—Ç—Ä–∞–ª–Ω–æ–º –Ω–µ—Ä–≤–Ω–æ–º —Å–∏—Å—Ç–µ–º—É –∏–∑–∞–∑–∏–≤–∞ —à–∏—Ä–æ–∫ —Å–ø–µ–∫—Ç–∞—Ä –±–∏–æ–ª–æ—à–∫–∏—Ö —Ä–µ–∞–∫—Ü–∏—ò–∞, —É–∫—ô—É—á—É—ò—É—õ–∏ –≤–∞–∑–æ–∫–æ–Ω—Å—Ç—Ä–∏–∫—Ü–∏—ò—É, —Ñ–æ—Ä–º–∏—Ä–∞—ö–µ —Ä–µ–∞–∫—Ç–∏–≤–Ω–∏—Ö –∫–∏—Å–µ–æ–Ω–∏—á–∫–∏—Ö –≤—Ä—Å—Ç–∞ (–Ý–ö–í), —Ä–µ–º–µ—Ç–∏ –º–µ—Ç–∞–±–æ–ª–∏–∑–∞–º –Ω–µ—É—Ä–æ—Ç—Ä–∞–Ω—Å–º–∏—Ç–µ—Ä–∞, –≥–µ–Ω–µ—Ä–∏—à–µ –ø—Ä–æ–¥—É–∫—Ü–∏—ò—É –≤–æ–¥–æ–Ω–∏–∫ –ø–µ—Ä–æ–∫—Å–∏–¥–∞ (H2O2) –∏ —Ä–µ–º–µ—Ç–∏ –º–µ—Ç–∞–∞–±–æ–ª–∏–∑–∞–º –∞–∑–æ—Ç-–æ–∫—Å–∏–¥–∞.[52] –•–∏–ø–µ—Ä–æ–∫—Å–∏—ò–∞ –ø–æ–≤–µ—õ–∞–≤–∞ —Ä–∞–∑–ª–∞–≥–∞—ö–µ –±–∏–æ–≥–µ–Ω–∏—Ö –∞–º–∏–Ω–∞ –∏ –¥–æ–≤–æ–¥–∏ –¥–æ —Ñ–æ—Ä–º–∏—Ä–∞—ö–∞ –≤–∏—Å–æ–∫–æ —Ç–æ–∫—Å–∏—á–Ω–∏—Ö –±–∏–æ–ø—Ä–æ–¥—É–∫–∞—Ç–∞ - –≤–æ–¥–æ–Ω–∏–∫ –ø–µ—Ä–æ–∫—Å–∏–¥–∞ (H2O2) –∏ –∞–º–æ–Ω–∏—ò–∞–∫–∞, —à—Ç–æ —É –º–æ–∑–≥—É –∏–∑–∞–∑–∏–≤–∞ –ø—Ä–æ–º–µ–Ω—É –µ–ª–µ–∫—Ç—Ä–∏—á–Ω–∏—Ö –ø–æ—Ç–µ–Ω—Ü–∏—ò–∞–ª–∞, –∫–æ—ò–∏ –ø—Ä–∞—Ç–∏ –ø–æ—ò–∞–≤–∞ (‚Äû–Ω–∞–ø–∞–¥–∞‚Äú ) –∫–æ–Ω–≤—É–ª–∑–∏—ò–∞, –∫–æ—ò–µ —É–º–Ω–æ–≥–æ–º–µ —Å–ª–∏—á–µ –µ–ø–∏–ª–µ–ø—Ç–∏—á–Ω–æ–º –Ω–∞–ø–∞–¥—É.[25] –°–º–∏—Ç–æ–≤ –µ—Ñ–µ–∫–∞—Ç–¢–æ–∫—Å–∏—á–Ω–æ –¥–µ—ò—Å—Ç–≤–æ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –Ω–∞ –ø–ª—É—õ–∏–º–∞ —ò–∞–≤—ô–∞ —Å–µ —É–≥–ª–∞–≤–Ω–æ–º –Ω–∞–∫–æ–Ω –¥—É–≥–æ—Ç—Ä–∞—ò–Ω–æ–≥ –∏–∑–ª–∞–≥–∞—ö–∞ –ø—Ä–∏—Ç–∏—Å–∫—É –∫–∏—Å–µ–æ–Ω–∏–∫–∞ > 0,5 –ê–¢–ê. –°–∏–º–ø—Ç–æ–º–∏ —Å–µ —ò–∞–≤—ô–∞—ò—É –Ω–∞–∫–æ–Ω –ª–∞—Ç–µ–Ω—Ç–Ω–æ–≥ –ø–µ—Ä–∏–æ–¥–∞, —á–∏—ò–µ —Ç—Ä–∞—ò–∞—ö–µ —Å–µ —Å–∫—Ä–∞—õ—É—ò–µ —Å–∞ –ø–æ–≤–µ—õ–∞—ö–µ–º (PaO2), –∞ –ø—Ä–≤–∏ –∑–Ω–∞—Ü–∏ —Ç–æ–∫—Å–∏—á–Ω–æ—Å—Ç–∏ —Å–µ –∫–æ–¥ –≤–µ—õ–∏–Ω–µ —ô—É–¥–∏ –º–æ–≥—É —ò–∞–≤–∏—Ç–∏ –ø–æ—Å–ª–µ 10 —á–∞—Å–æ–≤–∞ –∏–∑–ª–∞–≥–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫—É –Ω–∞ –ø—Ä–∏—Ç–∏—Å–∫—É –æ–¥ 1 –ê–¢–ê.[39]
–ü—Ä–æ–¥—É–∂–µ–Ω–∞ –∏/–∏–ª–∏ –≤–∏—Å–æ–∫–∞ –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–µ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –º–æ–∂–µ –æ—à—Ç–µ—Ç–∏—Ç–∏ –µ–ø–∏—Ç–µ–ª –ø–ª—É—õ–∞, –∏–∑–∞–∑–≤–∞—Ç–∏ –ø–æ—ò–∞–≤—É —É–Ω—É—Ç–∞—Ä –∞–ª–≤–µ–ª–æ–∞—Ä–Ω–æ–≥ –æ—Ç–æ–∫–∞, –∫–æ—ò–∏ –ø—Ä–∞—Ç–∏ —Ç—Ä–∞–Ω–∑–∏—Ç–æ—Ä–Ω–æ –∑–∞–¥–µ–±—ô–∞—ö–µ –∑–∏–¥–∞ –∞–ª–≤–µ–æ–ª–∞, –∞ –∫–∞—Å–Ω–∏—ò–µ –∏ —ö–∏—Ö–æ–≤–∞ —Ñ–∏–±—Ä–æ–∑–∞, —à—Ç–æ —É –∫—Ä–∞—ò—ö–µ–º –∏—Å—Ö–æ–¥—É –¥–æ–≤–æ–¥–∏ –¥–æ –ø–æ—Ä–µ–º–µ—õ–∞—ò–∞ —Ñ—É–Ω–∫—Ü–∏—ò–µ –∏ –∞—Ç–µ–ª–µ–∫—Ç–∞–∑–µ –ø–ª—É—õ–∞.[17] –õ–µ–∑–∏—ò–µ –ø–ª—É—õ–∞ –ª–∏—á–µ –Ω–∞ –æ–Ω–µ –∫–æ–¥ –ø–∞—Ä–∞–∫—É—Ç–Ω–æ–≥ —Ç—Ä–æ–≤–∞—ö–∞.[53]
–£ –∫–ª–∏–Ω–∏—á–∫–æ—ò —Å–ª–∏—Ü–∏ –∫–æ–¥ —Ä–∞–∑–ª–∏—á–∏—Ç–∏—Ö –±–æ–ª–µ—Å–Ω–∏–∫–∞, –∫–∞–æ –∏ —É —ò–µ–¥–Ω–æ–≥ –±–æ–ª–µ—Å–Ω–∏–∫–∞ —É —Ä–∞–∑–ª–∏—á–∏—Ç–∏–º —Å—Ç–∞–¥–∏—ò—É–º–∏–º–∞ –±–æ–ª–µ—Å—Ç–∏, —É —Ä–∞–∑–ª–∏—á–∏—Ç–æ–º —Å—Ç–µ–ø–µ–Ω—É —É—á–µ—Å—Ç–≤—É—ò—É –º–∞–Ω–∏—Ñ–µ—Å—Ç–∞—Ü–∏—ò–µ;
–ö–∏—Å–µ–æ–Ω–∏–∫ —É 100% –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∏ –æ—Ä–≥–∞–Ω–∏–∑–∞–º –º–æ–∂–µ —Ç–æ–ª–µ—Ä–∏—Å–∞—Ç–∏ –Ω–∞ –Ω–∏–≤–æ –º–æ—Ä–∞, —É –≤—Ä–µ–º–µ–Ω—É –æ–¥ 24 -48 —á–∞—Å–æ–≤–∞ –±–µ–∑ –∏–∫–∞–∫–≤–∏—Ö –æ–∑–±–∏—ô–Ω–∏—ò–∏—Ö –æ—à—Ç–µ—õ–µ—ö–µ —Ç–∫–∏–≤–∞. –î—É–∂–∞ –∏–∑–ª–æ–∂–µ–Ω–æ—Å—Ç –∫–∏—Å–µ–æ–Ω–∏–∫—É –º–æ–∂–µ –∏–∑–∞–∑–≤–∞—Ç–∏ –æ–¥—Ä–µ—í–µ–Ω–∞ –æ—à—Ç–µ—õ–µ—ö–µ —Ç–∫–∏–≤–∞ –∫–æ—ò–∞ —Å–µ –º–æ–≥—É –∏—Å–ø–æ—ô–∏—Ç–∏ –∫–∞–æ;
–ö–æ–¥ –≤–µ—õ–∏–Ω–µ –±–æ–ª–µ—Å–Ω–∏–∫–∞, –æ–≤–∏ —Å–∏–º–ø—Ç–æ–º–∏ —Å–µ –ø–æ–≤–ª–∞—á–µ 4 —á–∞—Å–∞ –ø–æ –ø—Ä–µ—Å—Ç–∞–Ω–∫—É –∏–∑–ª–∞–≥–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫—É.[54] –ü—Ä–æ–º–µ–Ω–µ –Ω–∞ –æ—á–∏–º–∞–Ý–µ–≤–µ—Ä–∑–∏–±–∏–ª–Ω–æ —Å—É–∂–µ—ö–µ —É –æ–±–ª–∞—Å—Ç–∏ –ø–µ—Ä–∏—Ñ–µ—Ä–Ω–æ–≥ –≤–∏–¥–∞, –ø—Ä–æ–≥—Ä–µ—Å–∏–≤–Ω–∞ –∞–ª–∏ —Ä–µ–≤–µ—Ä–∑–∏–±–∏–ª–Ω–∏ –∫—Ä–∞—Ç–∫–æ–≤–∏–¥–æ—Å—Ç, –∏ –∫–∞—Ç–∞—Ä–∞–∫—Ç–∞ –∫–æ—ò–∞ —Å–µ –º–æ–∂–µ —Ñ–æ—Ä–º–∏—Ä–∞—Ç–∏ –Ω–µ—ò—á–µ—à—õ—É —Å—É –Ω–µ–∫–µ –æ–¥ –∫–∞—Å–Ω–∏—Ö –∫–æ–º–ø–ª–∏–∫–∞—Ü–∏—ò–∞ –Ω–∞ –æ—á–∏–º–∞. –ü—Ä–æ–º–µ–Ω–µ –Ω–∞ –æ—á–∏–º–∞ –º–æ–≥—É –±–∏—Ç–∏ –∏–∑—Ä–∞–∂–µ–Ω–∏—ò–µ –∫–∞–¥–∞ —Å—É –æ—á–∏ –∏–∑–ª–æ–∂–µ–Ω–µ –≤–∏—Å–æ–∫–∏–º –∞–º–±–∏—ò–µ–Ω—Ç–∞–ª–Ω–∏–º –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∞–º–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –∏ –ø–æ–≤–µ—õ–∞–Ω–æ–º –ø—Ä–∏—Ç–∏—Å–∫—É, –∫–∞–æ —à—Ç–æ —ò–µ –±–æ—Ä–∞–≤–∞–∫ —É ‚Äû–∫–∏—Å–µ–æ–Ω–∏—á–∫–æ–º —à–∞—Ç–æ—Ä—É‚Äú, –∏–Ω–∫—É–±–∞—Ç–æ—Ä—É –∏ —Å–ª–∏—á–Ω–æ, –Ω–µ–≥–æ –∫–∞–¥–∞ —ò–µ —Ö–∏–ø–µ—Ä–æ–∫—Å–∏—ò–∞ —É –∞—Ä—Ç–µ—Ä–∏—ò—Å–∫—ò —Ü–∏—Ä–∫—É–ª–∞—Ü–∏—ò–∏ –∏–∑–∞–∑–≤–∞–Ω–∞ —É–¥–∏—Å–∞—ö–µ–º –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –ø—Ä–µ–∫–æ –∫–∏—Å–µ–æ–Ω–∏—á–∫–µ –º–∞—Å–∫–µ.[41]  –Ý–µ—Ç—Ä–æ–ª–µ–Ω—Ç–∞–ª–Ω–∞ —Ñ–∏–±—Ä–æ–ø–ª–∞–∑–∏—ò–∞–Ý–µ—Ç—Ä–æ–ª–µ–Ω—Ç–∞–ª–Ω–∞ —Ñ–∏–±—Ä–æ–ø–ª–∞–∑–∏—ò–∞ –ø—Ä–µ–¥—Å—Ç–∞–≤—ô–∞ —Ä–∞–∑–≤–æ—ò–Ω–∏, –ø—Ä–æ–ª–∏—Ñ–µ—Ä–∞—Ç–∏–≤–Ω–∏ –ø–æ—Ä–µ–º–µ—õ–∞—ò –∫—Ä–≤–Ω–∏—Ö —Å—É–¥–æ–≤–∞ –∫–æ—ò–∏ —Å–µ —ò–∞–≤—ô–∞ –∫–æ–¥ –Ω–µ–ø–æ—Ç–ø—É–Ω–æ —Ä–∞–∑–≤–∏—ò–µ–Ω–∏—Ö –∫—Ä–≤–Ω–∏—Ö —Å—É–¥–æ–≤–∞ –∫–æ—ò–∏ —Å–Ω–∞–±–¥–µ–≤–∞—ò—É –º—Ä–µ–∂—ö–∞—á—É, –Ω–∞—ò—á–µ—à—õ–µ –∫–æ–¥ –Ω–µ–¥–æ–Ω–æ—à–µ–Ω–µ –¥–µ—Ü–µ (–∫–∞–æ —Ä–µ—Ç–∏–Ω–æ–ø–∞—Ç–∏—ò–∞ –Ω–µ–¥–æ–Ω–æ—à—á–∞–¥–∏ (–ª–∞—Ç. retinopathia praematurorum) –∏ —ò–µ–¥–∞–Ω —ò–µ –æ–¥ –Ω–∞—ò—á–µ—à—õ–∏—Ö —É–∑—Ä–æ–∫–∞ —Å–ª–µ–ø–∏–ª–∞ –∫–æ–¥ –º–∞–ª–µ –¥–µ—Ü–µ, —Ç–æ–∫–æ–º –¥–µ—Ç–∏—ö—Å—Ç–≤–∞ (–æ–±–∏—á–Ω–æ —Å–µ —ò–∞–≤—ô–∞ —É –ø—Ä–≤–∏—Ö 6 –º–µ—Å–µ—Ü–∏ –Ω–∞–∫–æ–Ω —Ä–æ—í–µ—ö–∞). –£–∑—Ä–æ–∫ —ò–µ –≥–æ—Ç–æ–≤–æ —É–≤–µ–∫ –ø—Ä–∏–º–µ–Ω–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É –≤–µ—õ–æ—ò –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∏ (–∏–∑–Ω–∞–¥ 40%), —É –¥—É–∂–µ–º –≤—Ä–µ–º–µ–Ω—Å–∫–æ–º –ø–µ—Ä–∏–æ–¥—É (1‚Äî2 –¥–∞–Ω–∞) –Ω–∞–∫–æ–Ω —Ä–æ—í–µ—ö–∞. –ö–æ–¥ –ø—Ä–µ—Ä–∞–Ω–æ —Ä–æ—í–µ–Ω–µ –¥–µ—Ü–µ, —Å–∞ –º–∞—ö–µ –æ–¥ 30 –Ω–µ–¥–µ—ô–∞ –≥–µ—Å—Ç–∞—Ü–∏—ò–µ, –∏–ª–∏ —Å–∞ –ø–æ—Ä–æ—í–∞—ò–Ω–æ–º —Ç–µ–∂–∏–Ω–æ–º –æ–¥ 1.500 –≥—Ä–∞–º–∞, —Ä–∏–∑–∏–∫ –Ω–∞—Å—Ç–∞–Ω–∫–∞ –æ–≤–∏—Ö –ø—Ä–æ–º–µ–Ω–∞ —ò–µ –≤–µ—õ–∏ .[55] –ö–æ–¥ –æ–≤–∏—Ö –Ω–æ–≤–æ—Ä–æ—í–µ–Ω—á–∞–¥–∏ —Ç–∞–∫–æ—í–µ –ø–æ—Å—Ç–æ—ò–∏ –∏ –≤–µ—õ–∞ –≤–µ—Ä–æ–≤–∞—Ç–Ω–æ—õ–∞ –¥–∞ —Ä–∞–∑–≤–∏—ò—É —Ö—Ä–æ–Ω–∏—á–Ω—É –±–æ–ª–µ—Å—Ç –ø–ª—É—õ–∞ –∏ –∏–Ω—Ç—Ä–∞–≤–µ–Ω—Ç—Ä–∏–∫—É–ª–∞—Ä–Ω—É —Ö–µ–º–æ—Ä–∞–≥–∏—ò—É –∏–∑–∞–∑–≤–∞–Ω—É —Ç—Ä–æ–≤–∞—ö–µ–º –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º. –ü–∞—Ç–æ–ª–æ–≥–∏—ò–∞ —Ä–µ—Ç—Ä–æ–ª–µ–Ω—Ç–∞–ª–Ω–µ —Ñ–∏–±—Ä–æ–ø–ª–∞–∑–∏—ò–µ[56] –ù–æ—Ä–º–∞–ª–Ω–∞, –≤–∞—Å–∫—É–ª–∞—Ä–∏–∑–∞—Ü–∏—ò–∞ –º—Ä–µ–∂—ö–∞—á–µ –Ω–∞—Å—Ç–∞–≤—ô–∞ —Å–µ –Ω–µ–ø–æ—Å—Ä–µ–¥–Ω–æ –Ω–∞–∫–æ–Ω —Ä–æ—í–µ—ö–∞. –ö–∏—Å–µ–æ–Ω–∏–∫ —É –≤–∏—Å–æ–∫–∏–º –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∞–º–∞ –∏/–∏–ª–∏ —É —Ç–æ–∫—É –ø—Ä–æ–¥—É–∂–µ–Ω–æ–≥ –∏–∑–ª–∞–≥–∞—ö–∞, –º–æ–∂–µ –∏–∑–∞–∑–≤–∞—Ç–∏ –≤–∞–∑–æ–∫–æ–Ω—Å—Ç—Ä–∏–∫—Ü–∏—ò—É, –ø–æ—Å–µ–±–Ω–æ —Ç–µ–º–ø–æ—Ä–∞–ª–Ω–æ–≥ –¥–µ–ª–∞ —Ä–µ—Ç–∏–Ω–µ (–º—Ä–µ–∂—ö–∞—á–µ) –∫–æ—ò–∞ —Å–µ –ø–æ—Å–ª–µ–¥—ö–∞ –≤–∞—Å–∫—É–ª–∞—Ä–∏–∑—É—ò–µ (–ø—Ä–æ–∂–∏–º–∞ –∫—Ä–≤–Ω–∏–º —Å—É–¥–æ–≤–∏–º–∞), —à—Ç–æ –¥–æ–≤–æ–¥–∏ –¥–æ –≥—É–±–∏—Ç–∫–∞ –ª—É–º–µ–Ω–∞ –∫—Ä–≤–Ω–∏—Ö —Å—É–¥–æ–≤–∞ –∑–±–æ–≥ –∞–Ω–æ–∫—Å–∏—ò–µ –∏ –Ω–∞—Å—Ç–∞–Ω–∫–∞ –æ—à—Ç–µ—õ–µ—ö–∞ –µ–Ω–¥–æ—Ç–µ–ª–∞ —É –∑–∏–¥—É –∫—Ä–≤–Ω–æ–≥ —Å—É–¥–∞. –ù–∞–∫–æ–Ω –ø—Ä–µ—Å—Ç–∞–Ω–∫–∞ —Ç–µ—Ä–∞–ø–∏—ò–µ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º, —Ä–µ–≥–µ–Ω–µ—Ä–∞—Ü–∏—ò–∞ –∫—Ä–≤–Ω–∏—Ö —Å—É–¥–æ–≤–∞ —ò–∞–≤—ô–∞ —Å–µ —É –∑–∞—Ö–≤–∞—õ–µ–Ω–æ–º –ø–æ–¥—Ä—É—á—ò—É –∏–∑–∞ –º—Ä–µ–∂—ö–∞—á–µ. –î–∏–ª–∞—Ç–∞—Ü–∏—ò–∞ (–ø—Ä–æ—à–∏—Ä–µ—ö–µ) –∏ —Ä—É–ø—Ç—É—Ä–∞ (–ø—É—Ü–∞—ö–µ) –æ–≤–∏—Ö –∫—Ä–≤–Ω–∏—Ö —Å—É–¥–æ–≤–∞ –º–æ–∂–µ –¥–æ–≤–µ—Å—Ç–∏ –¥–æ –∫—Ä–≤–∞—Ä–µ—ö–∞ —É —Å—Ç–∞–∫–ª–∞—Å—Ç–æ–º —Ç–µ–ª—É –∏–ª–∏ –º—Ä–µ–∂—ö–∞—á–∏, —Ñ–∏–±—Ä–æ–∑–µ –∏ –∞–¥—Ö–µ–∑–∏—ò–∞ –∫–æ—ò–∞ –º–æ–∂–µ –¥–∞ –ø—Ä–∞—Ç–∏, –æ—à—Ç–µ—õ–µ—ö–µ –º—Ä–µ–∂—ö–∞—á–µ –∏ –ø–æ—ò–∞–≤–µ —Å–ª–µ–ø–∏–ª–∞. –¢–æ–∫—Å–∏—á–Ω–∏ –µ—Ñ–µ–∫—Ç–∏ –Ω–∞ –¥—Ä—É–≥–∏–º —Ç–∫–∏–≤–∏–º–∞[57]–ö–∏—Å–µ–æ–Ω–∏—á–∫–æ —É–≤–æ –ö–∏—Å–µ–æ–Ω–∏—á–∫–æ —É–≤–æ —ò–µ —Å–∏–Ω–¥—Ä–æ–º —Å–ª–∏—á–∞–Ω –±–∞—Ä–æ—Ç—Ä–∞—É–º–∞—Ç—Å–∫–æ—ò —É–ø–∞–ª–∏ —Å—Ä–µ–¥—ö–µ–≥ —É–≤–∞ –∏ —ò–µ–¥–Ω–∞ —ò–µ –æ–¥ —Ä–µ—Ç–∫–∏—Ö –Ω–µ–∂–µ—ô–µ–Ω–∏—Ö –ø–æ—Å–ª–µ–¥–∏—Ü–∞ —É–¥–∏—Å–∞—ö–∞ 100% –∫–∏—Å–µ–æ–Ω–∏–∫–∞. –°–∏–º–ø—Ç–æ–º–∏ —Å—É –∏—Å—Ç–∏ –∫–∞–æ –∫–æ–¥ –∞–µ—Ä–æ–æ—Ç–∏—Ç–∏—Å–∞, –∞–ª–∏ —ò–µ —Ä–∞–∑–ª–∏–∫–∞ —É —Ç–æ–º–µ —à—Ç–æ –∫–æ–¥ –∫–∏—Å–µ–æ–Ω–∏—á–∫–æ–≥ —É–≤–∞ –æ–Ω–∏ –Ω–∞—Å—Ç–∞—ò—É 2 –∏–ª–∏ –≤–∏—à–µ —á–∞—Å–æ–≤–∞ –Ω–∞–∫–æ–Ω –∏–∑–ª–∞–≥–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫—É.[58] 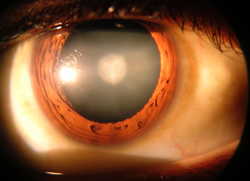 –ö—Ä–∞—Ç–∫–æ–≤–∏–¥–æ—Å—Ç –∏ –∫–∞—Ç–∞—Ä–∞–∫—Ç–∞ (–º—Ä–µ–Ω–∞) –ö—Ä–∞—Ç–∫–æ–≤–∏–¥–æ—Å—Ç (–ª–∞—Ç. myopia) –∏ –∫–∞—Ç–∞—Ä–∞–∫—Ç–∞ (–º—Ä–µ–Ω–∞, –∑–∞–º—É—õ–µ—ö–µ –æ—á–Ω–æ–≥ —Å–æ—á–∏–≤–∞, (–ª–∞—Ç. cataractae)), –º–æ–∂–µ –Ω–∞—Å—Ç–∞—Ç–∏ –Ω–∞–∫–æ–Ω —É–¥–∏—Å–∞—ö–∞ 100% –∫–∏—Å–µ–æ–Ω–∏–∫–∞, –∫–æ–¥ —Å—Ç–∞—Ä–∏—ò–∏—Ö –æ—Å–æ–±–∞ –∏–ª–∏ –Ω–∞–∫–æ–Ω –¥—É–∂–µ–≥ –∏–∑–ª–∞–≥–∞—ö–∞ (–≤–µ—õ–µ–º –±—Ä–æ—ò—É —Å–µ–∞–Ω—Å–∏) 100% –∫–∏—Å–µ–æ–Ω–∏–∫—É –Ω–∞ –ø–æ–≤–∏—à–µ–Ω–æ–º –ø—Ä–∏—Ç–∏—Å–∫—É (–•–ë–û–¢). –ü—Ä–∏ —á–µ–º—É —ò–µ –∫—Ä–∞—Ç–∫–æ–≤–∏–¥–æ—Å—Ç –ø—Ä–æ–ª–∞–∑–Ω–∞ –∞ –∫–∞—Ç–∞—Ä–∞–∫—Ç–∞ (–º—Ä–µ–Ω–∞) —Ç—Ä–∞—ò–Ω–∞ –∏ —ò–∞–≤—ô–∞ —Å–µ –Ω–∞—ò—á–µ—à—õ–µ –∫–∞–æ –∫–æ–º–ø–ª–∏–∫–∞—Ü–∏—ò–∞ –≤–µ—õ –ø–æ—Å—Ç–æ—ò–µ—õ–µ–≥ –æ—à—Ç–µ—õ–µ—ö–∞ –æ—á–Ω–æ–≥ —Å–æ—á–∏–≤–∞. –û–≤–∏ –ø–æ—Ä–µ–º–µ—õ–∞—ò–∏ —Å—É –ø–æ—Å–ª–µ–¥–∏—Ü–∞ –¥–µ–ª–æ–≤–∞—ö–∞ —Å–ª–æ–±–æ–¥–Ω–∏—Ö –∫–∏—Å–µ–æ–Ω–∏—á–∫–∏—Ö —Ä–∞–¥–∏–∫–∞–ª–∞ –Ω–∞ –æ—á–Ω–æ–º —Å–æ—á–∏–≤—É, —à—Ç–æ –∏–º–∞ –∑–∞ –ø–æ—Å–ª–µ–¥–∏—Ü—É —Å—Ç–≤–∞—Ä–∞—ö–µ –≤–µ–ª–∏–∫–∏—Ö –∏ –≥—É—Å—Ç–∏—Ö –º–æ–ª–µ–∫—É–ª–∞ –∞–≥—Ä–µ–≥–∞—Ç–∞. –°–æ—á–∏–≤–æ –æ–∫–∞ —Å–µ —à—Ç–∏—Ç–∏ –æ–¥ —Å–ª–æ–±–æ–¥–Ω–∏—Ö –∫–∏—Å–µ–æ–Ω–∏—á–∫–∏—Ö —Ä–∞–¥–∏–∫–∞–ª–∞ —É–≥–ª–∞–≤–Ω–æ–º –≥–ª—É—Ç–∞—Ç–∏–æ–Ω–æ–º –∏ –≤–∏—Ç–∞–º–∏–Ω–æ–º –ï, –ø–∞ —Å–µ –∑–∞—Ç–æ –∫–æ–¥ —Å—Ç–∞—Ä–∏—ò–∏—Ö –æ—Å–æ–±–∞ –∏ –∫–æ–¥ –ø—Ä–æ–¥—É–∂–µ–Ω–∏—Ö —Å–µ—Ä–∏—ò–∞ (–•–ë–û–¢), –ø—Ä–µ–ø–æ—Ä—É—á—É—ò–µ –ø–æ–≤–µ—õ–∞–Ω —É–Ω–æ—Å –∞–Ω—Ç–∏–æ–∫—Å–∏–¥–∞–Ω–∞—Ç–∞ –∏ –ø–æ–≤—Ä–µ–º–µ–Ω–∞ –∫–æ–Ω—Ç—Ä–æ–ª–∞ –æ—á–Ω–æ–≥ –ª–µ–∫–∞—Ä–∞.[58] –î–∏—ò–∞–≥–Ω–æ–∑–∞ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º–ö–ª–∏–Ω–∏—á–∫–∏ —Å–µ —Ç—Ä–æ–≤–∞—ö–µ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º –º–æ–∂–µ –∏—Å–ø–æ—ô–∏—Ç–∏ —É –¥–≤–∞ –æ–±–ª–∏–∫–∞, –∫–∞–æ;
–î–∏—ò–∞–≥–Ω–æ–∑–∞ –∞–∫—É—Ç–Ω–æ–≥ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É —Ç–∏–ø–∏—á–Ω–∏–º —Å–ª—É—á–∞—ò–µ–≤–∏–º–∞ –Ω–∏—ò–µ —Ç–µ—à–∫–∞. –û–¥—Ä–µ—í–µ–Ω–µ –ø–æ—Ç–µ—à–∫–æ—õ–µ –º–æ–≥—É –Ω–∞—Å—Ç–∞—Ç–∏ –∫–∞–¥–∞ —Å–µ –æ—Å–æ–±–∞ –Ω–∞–ª–∞–∑–∏ –ø–æ–¥ –∞–Ω–µ—Å—Ç–µ–∑–∏—ò–æ–º —É –Ω–µ—Å–≤–µ—Å–Ω–æ–º —Å—Ç–∞—ö—É, –∏–ª–∏ —É –¥—Ä—É–≥–∏–º –ø–æ—Ä–µ–º–µ—õ–∞—ò–∏–º–∞ —Å–≤–µ—Å—Ç–∏. –ù–µ–º–∞ –∞–ø—Å–æ–ª—É—Ç–Ω–∏—Ö —Å–∏–º–ø—Ç–æ–º–∞ –∫–∞—Ä–∞–∫—Ç–µ—Ä–∏—Å—Ç–∏—á–Ω–∏—Ö —Å–∞–º–æ –∑–∞ —Ç—Ä–æ–≤–∞—ö–µ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º. –ü–æ—á–µ—Ç–Ω–∞ –º–∞–Ω–∏—Ñ–µ—Å—Ç–∞—Ü–∏—ò–∞ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º –º–æ–∂–µ –∑–∞–ø–æ—á–µ—Ç–∏ –ø–æ—ò–∞–≤–æ–º –Ω–µ–ª–∞–≥–æ–¥–Ω–æ—Å—Ç–∏, –∫–æ—ò–∞ —Å–µ —É –∞–∫—É—Ç–Ω–æ—ò —Ñ–∞–∑–∏ –∏–Ω—Ç–æ–∫—Å–∏–∫–∞—Ü–∏—ò–µ –º–æ–∂–µ –º–∞–Ω–∏—Ñ–µ—Å—Ç–æ–≤–∞—Ç–∏ —Å–ª–µ–¥–µ—õ–∏–º –∑–Ω–∞—Ü–∏–º–∞;
–°–ø–æ—ô–∞—à—ö–µ –º–∞–Ω–∏—Ñ–µ—Å—Ç–∞—Ü–∏—ò–µ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º –∏—Å–ø–æ—ô–∞–≤–∞—ò—É —Å–µ —Å–ª–µ–¥–µ—õ–∏–º –∑–Ω–∞—Ü–∏–º–∞:
–ü—Ä–µ—Ç—Ö–æ–¥–Ω–µ –º–∞–Ω–∏—Ñ–µ—Å—Ç–∞—Ü–∏—ò–µ –∫–æ—ò–µ —Å–µ —ò–∞–≤—ô–∞—ò—É –ø–æ–Ω–µ–∫–∞–¥ –∏ –ø—Ä–µ –ø–æ—ò–∞–≤–µ –ø–æ—á–µ—Ç–Ω–∏—Ö –º–∞–Ω–∏—Ñ–µ—Å—Ç–∞—Ü–∏—ò–∞ —Ç—Ä–æ–≤–∞—ö–∞. –û–Ω–µ –º–æ–≥—É –∑–∞–ø–æ—á–µ—Ç–∏ —ò–∞—Å–Ω–æ –∏–∑—Ä–∞–∂–µ–Ω–∏–º –∑–Ω–∞—Ü–∏–º–∞ –∞–∫—É—Ç–Ω–æ–≥ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º, –Ω–∞—ò—á–µ—à—õ–µ —É –≤–∏–¥—É –ø–æ—ò–∞–≤–µ —Å–ª–∞–±–∏—Ö –∏–ª–∏ —ò–∞—á–∏—Ö –Ω–∞–ø–∞–¥–∞ –≥—Ä—á–µ–≤–∞ (–ø–æ —Ç–∏–ø—É —Ç–æ–Ω–∏—á–∫–æ-–∫–ª–æ–Ω–∏—á–∫–∏—Ö –≥—Ä—á–µ–≤–∞), –≤–µ–æ–º–∞ —Å–ª–∏—á–Ω–∏—Ö –æ–Ω–∏–º –∫–æ–¥ –µ–ø–∏–ª–µ–ø—Å–∏—ò–µ –ì–∞—Å–Ω–µ –∞–Ω–∞–ª–∏–∑–µ
 Гасне анализе и (pH) су од изузетног значаја за одређивање вредности респирацијских гасова (PaO2 и PaCO2) и ацидобазне равнотеже у артеријској крви, на основу којих се најефикасније одређује и подешава терапија кисеоником и процењују нежељене последице. Гасне анализе, а код болести плућа заједно са спирометријом, су најбољи показатељ неповољног дејства хипероксије, али и најбољи начин за одмеравање „дозе оксигенотерапије“. Нормалне вредности парцијалног притиска кисеоника износе (PaO2 > 10,5 kPa и његова физиолошка вредност лако опада са годинама живота). Сатурација артериске крви кисеоником у здравих особа износи 0,94 kPa. Парцијални притисак угљен-диоксида (PaCO2) у здравих особа износи између 4,5 и 6,0 kPa и не мења се са старошћу. На основу праћења одступања од ових (нормалних) вредности спроцењује се и промене у хипероксији.[62] Новине у дијагностициНајновија истраживања о употреби кисеоника у нормобаричним и хипербаричним условима данас се све више интензивирају (посебно у обласи хипербаричне медицине) уз коришћење високе технологије, укључујући и примену изотопа, магнетне резонантне томографије (MRI) и компјутеризоване емисионе томографије (SPECT). Бројна истраживања спроведена пре и после примене хипероксије уз примену магнетне резонантне томографије (MRI) и компјутеризоване емисионе томографије, дала су вредан увид у механизме и поступке хипербаричне и нормобаричне терапије применом оксигенације. Захваљујући овим истраживањима бројне индикације које су претходно сматрне да имају лошу прогнозу у хипероксији, укључујући и повреде мозга, мождани удар, не само да су оповргнуте већ су се манифестовале побољшањем неуролошког стања, уз изузетно мали број тровања кисеоником. Истраживања у овој области се и даље настављају.[63] Спречавање тровања кисеоником Спречавање тровања кисеоником обухвата следеће мере и поступке:
–ü—Ä–∞–∫—Ç–∏—á–Ω–∏ —Å–∞–≤–µ—Ç–∏ –∑–∞ —Å–ø—Ä–µ—á–∞–≤–∞—ö–µ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º–ê–∫–æ –¥–æ—í–µ –¥–æ –º–∞–Ω–∏—Ñ–µ—Å—Ç–∞—Ü–∏—ò–∞ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º —É —Ü–∏—ô—É –∑–∞—É—Å—Ç–∞–≤—ô–∞—ö–∞ –∏ –æ—Ç–∫–∞—ö–∞—ö–∞ –ø–æ—Å–ª–µ–¥–∏—Ü–∞ –ø—Ä–∏–º–µ—ö—É—ò—É —Å–µ —Å–ª–µ–¥–µ—õ–µ –º–µ–¥–∏—Ü–∏–Ω—Å–∫–µ –º–µ—Ä–µ:[53][56]
 –ö–æ–¥ –±–æ–ª–µ—Å–Ω–∏–∫–∞ —Å–∞ —Ö—Ä–æ–Ω–∏—á–Ω–æ–º —Ö–∏–ø–æ–∫—Å–µ–º–∏—ò–æ–º, –∫–∞–æ —à—Ç–æ —Å—É —Ç–µ—à–∫–µ —Ö—Ä–æ–Ω–∏—á–Ω–∞ –æ–ø—Å—Ç—Ä—É–∫—Ç–∏–≤–Ω–∞ –±–æ–ª–µ—Å—Ç –ø–ª—É—õ–∞ (–•–û–ë–ü), –±–µ–∑–±–µ–¥–Ω–∏—ò–µ —ò–µ –ø—Ä–∏–º–µ–Ω–∏—Ç–∏ –∫–∏—Å–µ–æ–Ω–∏–∫ —É –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∏ –∫–æ—ò–∞ —ò–µ –Ω–∞ –≥—Ä–∞–Ω–∏—Ü–∏ –Ω–∞—ò–Ω–∏–∂–µ–≥ –º–æ–≥—É—õ–µ–≥ –Ω–∏–≤–æ–∞ –ø–∞—Ä—Ü–∏—ò–∞–ª–Ω–æ–≥ –ø—Ä–∏—Ç–∏—Å–∫–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É –∞–ª–≤–µ–æ–ª–∞–º–∞ (Pa02), –∫–æ—ò–∞ –º–æ–∂–µ –±–∏—Ç–∏ —á–∞–∫ –∏ –¥–æ 50-55 mmHg (Pa02), —à—Ç–æ —ò–µ –Ω–∞—ò—á–µ—à—õ–µ –∏ –¥–æ–≤–æ—ô–Ω–æ –∑–∞ —Å—Ç–∞–±–∏–ª–∏–∑–∞—Ü–∏—ò—É (–•–û–ë–ü). –ü–æ–∑–∏—Ç–∏–≤–Ω–∏ –ø—Ä–∏—Ç–∏—Å–∞–∫ –Ω–∞ –∫—Ä–∞—ò—É –∏–∑–¥–∏—Å–∞—ò–∞ (–∏–∑–¥–∏—Å–∞—ò–Ω–∏ –ø—Ä–∏—Ç–∏—Å–∞–∫ ) —Ç—Ä–µ–±–∞ –∫–æ—Ä–∏—Å—Ç–∏ —Ç–æ–∫–æ–º –º–µ—Ö–∞–Ω–∏—á–∫–µ –≤–µ–Ω—Ç–∏–ª–∞—Ü–∏—ò–µ, –∞–∫–æ —É–¥–∞—Ö–Ω—É—Ç–∞ –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–µ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ > 50% –Ω–µ —É—Å–ø–µ–≤–∞ –¥–∞ —Ä–µ–≥—É–ª–∏—à–µ —Ö–∏–ø–æ–∫—Å–∏—ò—É.[53][56] –ö–æ–¥ –∞–∫—É—Ç–Ω–∏—Ö –ø–ª—É—õ–Ω–∏—Ö –ø–æ—Ä–µ–º–µ—õ–∞—ò–∞ —Å–∞ —Ç–µ—à–∫–æ–º —Ö–∏–ø–æ–∫—Å–∏—ò–æ–º, –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –º–æ—Ä–∞ –±–∏—Ç–∏ —Ç–æ–ª–∏–∫–∞ –¥–∞ –æ–º–æ–≥—É—õ–∞–≤–∞ –∑–∞—Å–∏—õ–µ—ö–µ –∫—Ä–≤–∏ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º –±—É–¥–µ Sa>90% –∞ –ø–∞—Ä—Ü–∏—ò–∞–ª–Ω–∏ –ø—Ä–∏—Ç–∏—Å–∞–∫ PaO2 60-65 mmHg. –ê–∫–æ, —É–ø—Ä–∫–æ—Å –∫–æ—Ä–∏—à—õ–µ—ö—É –∫–∏—Å–µ–æ–Ω–∏–∫–∞ –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–µ –Ω–∏—ò–µ –≤–µ—õ–∞ –æ–¥ 60-70% –Ω–µ —Ç—Ä–µ–±–∞ –∏—õ–∏ –Ω–∞ –ø–æ–≤–µ—õ–∞—ö–µ –ø–∞—Ä—Ü–∏—ò–∞–ª–Ω–æ–≥ –ø—Ä–∏—Ç–∏—Å–∫–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É –∞–ª–≤–µ–æ–ª–∞–º–∞ (Pa02), –≤–µ—õ —ò–µ –º—É–¥—Ä–∏—ò–µ –æ–¥–ª—É—á–∏—Ç–∏ —Å–µ –¥–∞ –¥–æ—Å—Ç–∏–≥–Ω—É—Ç–∏–º (Pa02) –∑–∞–¥—Ä–∂–∏–º–æ –±–ª–∞–∂–∏ –æ–±–ª–∏–∫ —Ö–∏–ø–æ–∫—Å–µ–º–∏—ò–µ. .[66] –ê–∫–æ —ò–µ –±–æ–ª–µ—Å–Ω–∏–∫ –≤–∏—Ç–∞–ª–Ω–æ —É–≥—Ä–æ–∂–µ–Ω –∏–∑—Ä–∞–∂–µ–Ω–æ–º —Ö–∏–ø–æ–∫—Å–∏—ò–æ–º, –æ–Ω–∞ –º–æ—Ä–∞ –±–∏—Ç–∏ –∞–¥–µ–∫–≤–∞—Ç–Ω–æ –ª–µ—á–µ–Ω–∞ —á–∞–∫ –∏ —É–ø–æ—Ç—Ä–µ–±–æ–º 100% –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —Ç–æ–∫–æ–º –¥—É–∂–µ–≥ –≤—Ä–µ–º–µ–Ω—Å–∫–æ–≥ –ø–µ—Ä–∏–æ–¥–∞, –±–µ–∑ –æ–±–∑–∏—Ä–∞ –Ω–∞ –º–æ–≥—É—õ–Ω–æ—Å—Ç —Ç—Ä–æ–≤–∞—ö–∞, —ò–µ—Ä —Å–ø–∞—à–∞–≤–∞–º–æ —ö–µ–≥–æ–≤ –∂–∏–≤–æ—Ç, –ø–∞ —ò–µ –∏ —Ä–∏–∑–∏–∫ –æ–ø—Ä–∞–≤–¥–∞–Ω. –ö–∞–∫–æ –±–∏ —Å–µ —Å–ø—Ä–µ—á–∏–ª–∞ –ø–æ—ò–∞–≤–∞ —Ä–µ—Ç—Ä–æ–ª–µ–Ω—Ç–∞–ª–Ω–µ —Ñ–∏–±—Ä–æ–ø–ª–∞–∑–∏—ò–µ –Ω–æ–≤–æ—Ä–æ—í–µ–Ω—á–∞–¥–∏, —Å–∞–≤–µ—Ç—É—ò–µ —Å–µ –∏–∑–±–µ–≥–∞–≤–∞—ö–µ –∫–æ–Ω—Ç–∏–Ω—É–∏—Ä–∞–Ω–µ —Ç–µ—Ä–∞–ø–∏—ò–µ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º, –ø–æ—Å–µ–±–Ω–æ –∫–æ–¥ –ø—Ä–µ—Ä–∞–Ω–æ —Ä–æ—í–µ–Ω–µ –¥–µ—Ü–µ, –∫–∞–æ –∏ –¥–µ—Ü–µ —Å–∞ –Ω–∏—Å–∫–æ–º –ø–æ—Ä–æ—í–∞—ò–Ω–æ–º —Ç–µ–∂–∏–Ω–æ–º, –∫–∞–æ –∏ –ø—Ä–∏–º–µ–Ω–∞ –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—ò–µ –∫–∏—Å–µ–æ–Ω–∏–∫–∞ —É —É–¥–∞—Ö–Ω—É—Ç–æ–º –≤–∞–∑–¥—É—Ö—É –∫–æ—ò–µ –ø—Ä–µ–ª–∞–∑–∏ 40%, –ø—Ä–∏ —á–µ–º—É (Pa02) –º–æ—Ä–∞ –±–∏—Ç–∏ –∏—Å–ø–æ–¥ –∫—Ä–∏—Ç–∏—á–Ω–æ–≥ –Ω–∏–≤–æ–∞ –æ–¥ 160 mmHg.[53][56] –ü–æ–º–æ—õ–Ω–∞, –µ–≥–∑–æ–≥–µ–Ω–∞ –ª–∏–Ω–∏—ò–∞ –∞–Ω—Ç–∏–æ–∫—Å–∏–¥–∞—Ç–∏–≤–Ω–µ –æ–¥–±—Ä–∞–Ω–µ —Å—É –∏ –Ω–µ–µ–Ω–∑–∏–º—Å–∫–µ —Å—É–ø—Å—Ç–∞–Ω—Ü–µ (–º–∏–∫—Ä–æ–µ–ª–µ–º–µ–Ω—Ç–∏) –∫–æ—ò–∏ –Ω–µ—É—Ç—Ä–∞–ª–∏—à—É —Å–ª–æ–±–æ–¥–Ω–µ —Ä–∞–¥–∏–∫–∞–ª–µ (–Ω–ø—Ä: –≤–∏—Ç–∞–º–∏–Ω –ï, –≤–∏—Ç–∞–º–∏–Ω –¶, –≥–ª—É—Ç–∞—Ç–∏–æ–Ω (GHS), –∫–æ–µ–Ω–∑–∏–º (Q10), –∫–æ—ò–∏ —Ç–∞–∫–æ—í–µ —É —É—Å–ª–æ–≤–∏–º–∞ –ª–æ—à–µ –∏—Å—Ö—Ä–∞–Ω–µ –∏ –∏–∑—Ä–∞–∂–µ–Ω–µ —Ö–∏–ø–µ—Ä–æ–∫—Å–∏—ò–µ –Ω–µ –º–æ–≥—É –∏—Å–ø–æ—ô–∏—Ç–∏ —Å–≤–æ—ò –∞–Ω—Ç–∏–æ–∫—Å–∏–¥–∞–Ω—Ç–Ω—É –∑–∞—à—Ç–∏—Ç—É —É –¥–æ–≤–æ—ô–Ω–æ–º –æ–±–∏–º—É. –ó–∞—Ç–æ –ø—Ä–µ–º–∞ –Ω–µ–∫–∏–º –∏—Å—Ç—Ä–∞–∂–∏–≤–∞—ö–∏–º–∞ –∏–º–∞ –æ–ø—Ä–∞–≤–¥–∞—ö–µ –ø—Ä–∏–º–µ–Ω–∞ –æ–≤–∏—Ö –º–∏–∫—Ä–æ–µ–ª–µ–º–µ–Ω–∞—Ç–∞ —É –≤–µ—õ–∏–º –¥–æ–∑–∞–º–∞ –ø—Ä–µ –ø–æ—á–µ—Ç–∫–∞ –∏ —É —Ç–æ–∫—É –ª–µ—á–µ—ö–∞ —Ö–∏–ø–µ—Ä–æ–∫—Å–∏—ò–æ–º —É —Ü–∏—ô—É –ø—Ä–µ–≤–µ–Ω—Ü–∏—ò–µ —Ç—Ä–æ–≤–∞—ö–∞ –∫–∏—Å–µ–æ–Ω–∏–∫–æ–º.[15] –ù–∞–ø–æ–º–µ–Ω–µ
–í–∏–¥–∏ —ò–æ—à
–Ý–µ—Ñ–µ—Ä–µ–Ω—Ü–µ
–õ–∏—Ç–µ—Ä–∞—Ç—É—Ä–∞
–°–ø–æ—ô–∞—à—ö–µ –≤–µ–∑–µ
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
Portal di Ensiklopedia Dunia















